
干细胞治疗常见问题疑问一:干细胞通过何种方式进入人体?
干细胞并非凭空出现在病灶,其进入人体依赖于精密的医疗递送技术,主要分为三大途径:
全身性播散——静脉输注:如同点滴输液,将干细胞悬液通过外周静脉注入血液循环。
-
首过效应(First Pass Effect):首次通过肺部毛细血管床时,大量干细胞(尤其是直径较大的细胞)会发生机械性滞留,随后缓慢释放。这意味着只有一小部分细胞能进入全身血液循环并到达非肺部损伤点。
-
适用性:广泛应用于系统性炎症、心脏病(如心肌梗死后)、糖尿病等全身或弥散性疾病。
中枢直通车——鞘内注射:通过腰椎穿刺,将干细胞直接注射到包裹着大脑和脊髓的脑脊液中。
- 目的:规避血脑屏障 (BBB),使干细胞能通过脑脊液的循环,直接到达大脑、脑干和脊髓表面的损伤区域。
- 适用性:脊髓损伤、肌萎缩侧索硬化症(ALS)、脑瘫、多发性硬化症等中枢神经系统疾病。
精准靶向投放——局部注射:在影像技术引导下,将干细胞精准注射至病灶区域,如心肌梗死区、损伤的关节腔内或视网膜下。
-
优势:最大化了细胞在目标部位的浓度,显著减少了全身分布和免疫排斥的风险。
-
适用性:骨关节炎、局部缺血性肢体病、肌肉损伤、伤口修复等。
疑问二:注入后,干细胞能自己“找到”损伤位置吗?
答案是:能,但效率有限。这一过程被称为“归巢”。
这是一个关于干细胞“归巢”(Homing)的关键问题,干细胞具有一定的趋向性,但并非百分之百的“精准导弹”(图1)[1]。
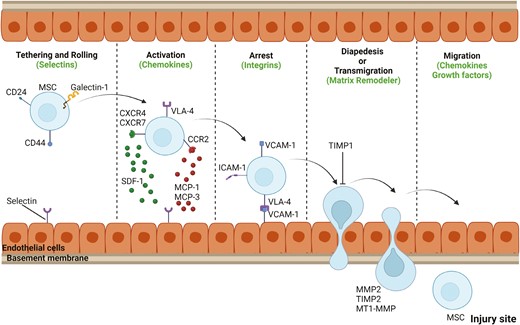
图1:间充质干细胞(MSC)归巢机制概述。间充质干细胞的系统性归巢包括五个不同的步骤,包括黏附和滚动、激活、细胞停滞、渗出或跨内皮迁移以及迁移。
干细胞,尤其是间充质干细胞(MSC),具有天然的归巢特性。当身体组织发生损伤、炎症或缺血时,受损部位会释放出特定的信号分子,如:
-
趋化因子(Chemokines)
-
细胞因子(Cytokines)
-
生长因子(Growth Factors)
这些信号分子就像“导航灯”,能够被干细胞表面的相应受体识别。干细胞会沿着这些信号的浓度梯度移动,穿过血管壁,到达损伤区域并聚集。
然而,现实并非完美。静脉注射的干细胞如同被投入急流的救援队,大量细胞会被肺、肝、脾等器官“截留”,最终仅有约1%-5%能成功归巢到靶点。因此,提高归巢效率是当前研究的关键突破点。
疑问三:归巢效率如此低,治疗还有效吗?
研究发现,干细胞修复组织的关键,未必在于大量分化为新细胞直接“补缺”。更重要的是,它们如同“微型药厂”,在归巢途中和到达后,能持续分泌大量生物活性因子:
- 营养与修复因子:如VEGF、BDNF,促进血管新生、保护受损细胞、刺激内源性修复。
- 免疫调节因子:调节炎症环境,从“破坏性炎症”转为“修复性炎症”。
- 细胞外囊泡(外泌体):携带蛋白质、核酸等信息物质,调控周围细胞行为。
因此,即使少数干细胞抵达,也能通过强大的旁分泌作用,改善损伤部位的“土壤”(微环境),唤醒机体自身的修复潜能。这正是干细胞治疗有效的底层逻辑之一。
疑问四:大脑有坚固的“血脑屏障”,干细胞如何进入并修复神经?
血脑屏障(BBB)是一道由脑血管内皮细胞和紧密连接构成的严密防线,它可以阻止血液中的有害物质进入大脑,但也极大地限制了干细胞通过静脉输注进入中枢神经系统(CNS)。
针对大脑和CNS疾病的治疗,主要采取以下策略:
-
局部绕行:采用鞘内注射或脑室注射。这绕过了血管系统,将干细胞直接递送到脑脊液中。通过脑脊液的循环,干细胞可以更直接、更高效地接触到脊髓和大脑的受损区域。
-
短时开放:研究人员正在探索通过某些药物或超声技术[3],暂时、可逆地打开血脑屏障,以便静脉注射的干细胞能够进入大脑(图3)。
-
跨屏障机制:少数干细胞可能通过特殊的跨细胞转运或在炎症状态下通透性增加的血管进入大脑。
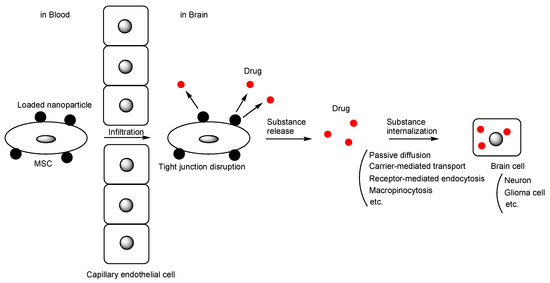
图3:载有纳米颗粒的间充质干细胞(MSC)介导的药物通过血脑屏障进入大脑的途径。黑色圆圈表示载有药物的纳米颗粒(红色圆圈所示)。药物从大脑中的纳米颗粒释放后被脑细胞内化。
除了鞘内/脑室注射这种直接绕行的策略外,研究还探索了其他潜在机制:
-
炎症/损伤诱导渗透性增加:在严重损伤(如脑卒中、创伤性脑损伤)急性期,BBB的通透性会暂时增加,为静脉输注的干细胞提供了一个短暂的进入“窗口”。
-
鼻腔递送:鼻腔粘膜下的神经末梢可作为干细胞进入CNS的潜在通道,该方法具有非侵入性的优势,但到达效率尚待优化。
-
外泌体递送:由于外泌体体积微小(30-150nm),它们更容易穿透BBB,将干细胞的修复信号(如miRNA和蛋白质)递送到脑部损伤灶。
疑问五:不同的注射方式,对疗效有决定性影响吗?
是的,注射方式是疗效的“战略决策”。它直接决定了干细胞的初始分布、存活率和作用模式(表1)。
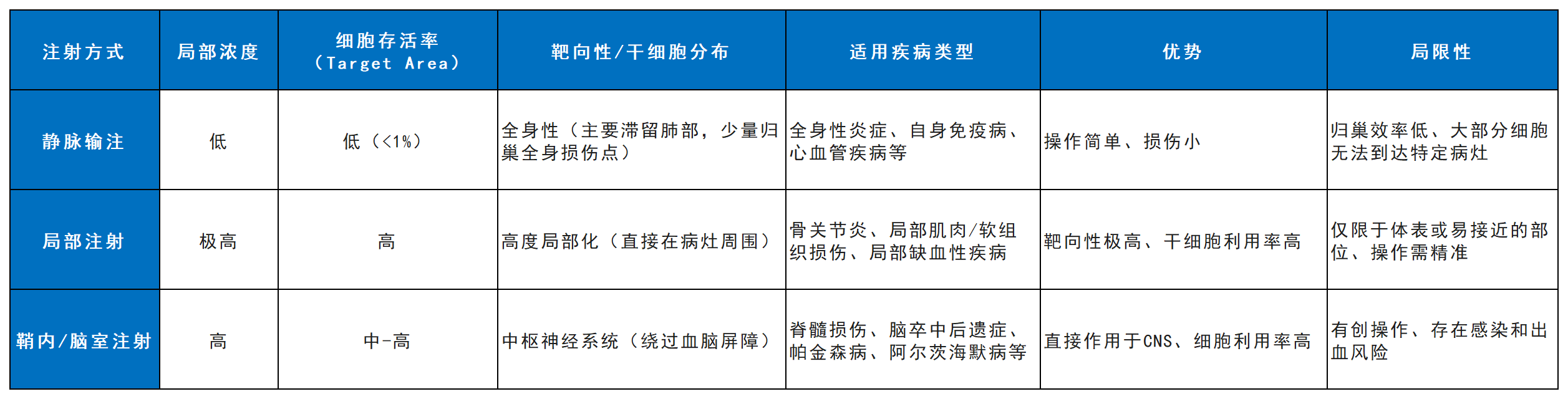
表1
临床选择需基于疾病性质、损伤范围和安全评估,进行个体化设计,有时甚至会联合使用多种方式。
疑问六:干细胞到达后,究竟如何“修复”损伤?
修复是一个多管齐下的协同过程:
- 细胞替代与融合:在适宜条件下,少量干细胞可分化为神经元、星形胶质细胞等,直接替换死亡细胞;或与现有细胞融合,提供支持。
- 营养与保护:分泌的神经营养因子,宛如“强心针”,滋养濒死神经元,延长其存活时间。
- 调控微环境:调节免疫反应,减轻有害炎症;促进血管新生,为受损区域恢复血液供应。
- 激活内源干细胞:唤醒大脑中处于休眠状态的神经干细胞,促进其增殖分化,实现自我更新。
疑问七:干细胞治疗的未来趋势是什么?
为了提高干细胞治疗的效果和安全性,未来的研究重点主要集中在以下方面:
-
增强归巢能力:通过基因工程或体外预处理技术,改造干细胞使其表面受体表达更高,从而更有效地识别和到达损伤部位。
-
优化细胞载体:使用生物材料支架或水凝胶等,将干细胞包裹后递送,提高细胞在病灶处的存活率和作用时间。
-
细胞无细胞疗法:集中研究干细胞分泌的外泌体(Exosomes)等旁分泌产物。这些“干细胞信使”具有低免疫原性、易储存和易穿透屏障的优势,有望成为更安全的治疗新方向。
总结而言,干细胞治疗是一个从“精准递送”到“智能修复”的复杂系统工程。 它不仅是细胞的简单移植,更是对机体修复机制的深度动员与重启。
尽管归巢效率、屏障跨越等挑战依然存在,但随着递送技术、生物工程和材料科学的进步,我们正朝着让干细胞治疗变得更精准、更高效、更安全的目标稳步迈进。每一次科学的突破,都在为无数患者点亮再生与康复的希望之光。
参考资料:
[1] Umar Sajjad, Muhammad Ahmed, M Zohaib Iqbal, Mahrukh Riaz, Muhammad Mustafa, Thomas Biedermann, Agnes S Klar, 探索间充质干细胞归巢机制及改进策略, 干细胞转化医学, 第13卷, 第12期, 2024年12月, 第1161-1177页, https://doi.org/10.1093/stcltm/szae045
[2] Gnecchi, M., Danieli, P., Malpasso, G., Ciuffreda, MC (2016). 间充质干细胞在组织修复中的旁分泌机制。见:Gnecchi, M. (编) 间充质干细胞。分子生物学方法,第1416卷。Humana出版社,纽约州纽约市。https://doi.org/10.1007/978-1-4939-3584-0_7
[3] Tashima, T. 基于间充质干细胞 (MSC) 的药物递送穿过血脑屏障进入大脑。Pharmaceutics 2024 , 16 , 289。https: //doi.org/10.3390/pharmaceutics16020289
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


اترك تعليقاً