这一决定不仅标志着中国在细胞治疗领域实现了从“跟跑”到“并跑”的关键跨越,也为全球再生医学版图增添了极具分量的中国坐标。
一剂新药,一个起点:中国首款干细胞新药获批周年回顾,能否撬动万亿产业?
继2024年12月美国FDA批准首款MSC疗法Ryoncil后,中国在短短数周内迎来了本土MSC新药的获批,彰显出中国在该领域积累的科研深度与监管成熟度。此次批准将进一步激活国内细胞治疗产业链,推动从基础研究到临床转化、从政策制定到市场准入的全生态升级,为全球MSC研发浪潮注入强劲的东方动能。
艾米迈托赛:为何是aGVHD?
艾米迈托赛的获批适应症,决定了它并非面向大众市场,而是一款救命罕用药。
疾病的致命性:急性移植物抗宿主病(aGVHD)是造血干细胞移植后最严重、最致命的并发症之一。当患者(如白血病患者)移植了供者的造血干细胞后,供者的免疫细胞可能“反客为主”,攻击患者的身体。其中,消化道受累的aGVHD尤为凶险,患者会出现难以控制的严重腹泻、腹痛和出血,传统一线激素治疗失败后,死亡率极高。
明确的临床价值:艾米迈托赛作为一种异体脐带来源الخلايا الجذعية الوسيطة الوسيطة MSC (في بيولوجيا الخلية)注射液,其核心作用在于强效的免疫调节。它像一名“调解员”,能抑制过度的免疫攻击,控制炎症风暴,为患者争取生存机会。其获批,为深陷绝境的患者和医生提供了一款强有力的武器。
此次“附条件批准”,是基于其显著的早期临床疗效数据。监管机构在确认其现有数据提示突出临床价值且风险可控的前提下,允许其先上市,同时要求企业继续完成确证性临床研究。这条路径兼顾了危重患者的紧急用药需求与科学的审慎原则。
获批之后:产业与信心的双重激活
一款罕见病干细胞药物的获批,其涟漪效应远超单一疾病领域。
首先,它验证了中国细胞治疗产品完整的产业化路径。从细胞来源、标准化扩增、质量检测到冷链运输,艾米迈托赛的成功上市,意味着我国已初步打通了干细胞作为“药品”而非“技术”的全链条生产质量管理规范(GMP)。这为后来者铺平了技术道路。
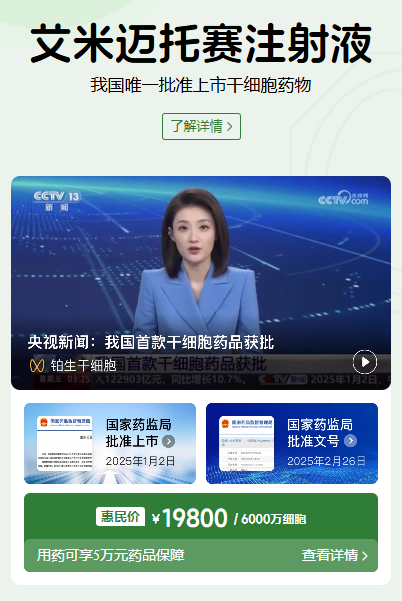
其次,它重构了细胞治疗的价值与定价认知。艾米迈托赛注射液的单次治疗定价为1.98万元人民币。与此前舆论猜测的“天价”不同,这个价格仅为美国同类产品Ryoncil(约140万元人民币/剂)的七十分之一。这一定价策略,不仅体现了可及性的巨大突破,更预示着中国创新药在未来全球竞争中可以采取一种更灵活、更具社会价值的商业策略。
资本市场与研发管线随之重新校准方向。投资界开始更深入地审视那些针对明确临床空白、拥有扎实生物学机制的细胞治疗项目。同时,研发热点也不再盲目追逐“大适应症”,而是更关注在像aGVHD这样“小而危重”的领域实现快速突破的可能性。
艾米迈托赛注射液获批之后,在2025年期间发生的大事件
获批上市:自2025年1月2日获得国家药监局附条件批准上市以来,艾米迈托赛注射液(商品名:睿铂生)在国内的进展并非简单的商业上市,而是一系列快速、扎实且环环相扣的里程碑事件。这些事件共同描绘了一款突破性罕见病药物从获批到真正惠及患者的完整轨迹,展现了中国创新药落地的新速度。
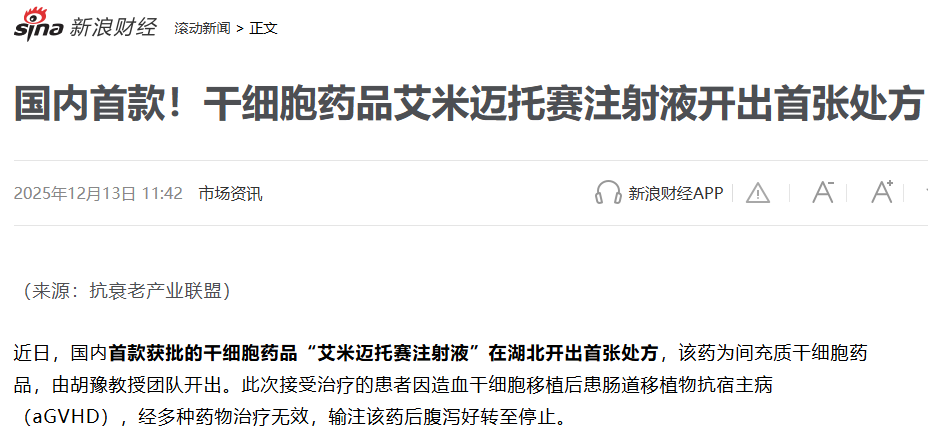
首张处方开出:2025年初的获批,只是一个起点。真正的突破发生在同年6月5日,由北京大学人民医院黄晓军院士团队开出了全国首张处方并完成了首针注射。这标志着这款中国首款干细胞新药正式从监管文件走向临床实践,开启了拯救生命的实际应用。
商业合作达成:紧随其后的是商业化布局的关键一步。在2025年6月,研发企业与阿里健康达成了全渠道独家经销合作。这一合作不仅关乎销售渠道,更是通过阿里健康的药品追溯体系和专业冷链物流,确保了这款活细胞药品在全国范围内可及、可控、可追溯,为其大规模临床应用铺设了基础设施。
推出用药保障计划:为了解决罕见病治疗中最棘手的高昂费用问题,一项创新的支付保障计划在2025年7月2日迅速推出。阿里健康联合众安保险,为用药患者提供了专项保障:在完成一个标准疗程(8次输注)后,若经评估为疾病进展,患者最高可获得5万元人民币的补偿。这一举措显著降低了患者的用药经济风险,体现了“让患者用得上、用得起”的本土化创新。
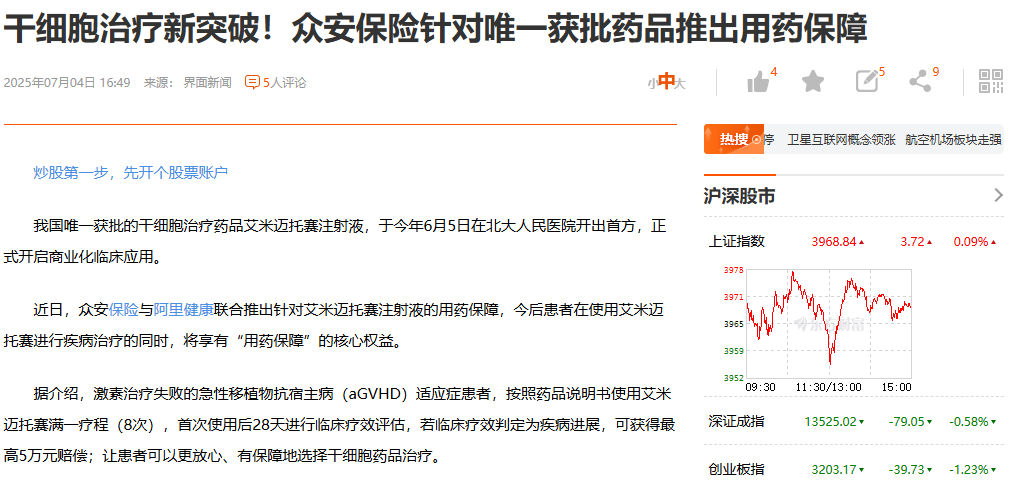
首位患者康复出院:临床应用的真实效果很快得到了验证。2025年9月14日,中央电视台报道了首位接受艾米迈托赛治疗的重症肠道aGVHD患者顺利康复出院的消息。这例成功的真实世界病例,为该药的疗效提供了最具说服力的早期证据,给予了临床医生和更多患者极大信心。
实现广泛临床覆盖:在此基础上,药物的可及性迅速扩大。截至2025年9月,通过线上平台的预约服务已覆盖全国20个省份,超过20家顶尖的造血干细胞移植中心开始了该药的应用,累计治疗患者已达百余人。这一覆盖速度在罕见病治疗领域是罕见的。
湖北首张处方落地:随后在2025年12月12日,华中科技大学同济医学院附属同济医院胡豫教授团队开出了湖北省的首张处方,标志着其临床应用正从核心医院向全国重点医疗区域深化。
除了这条清晰的主线,两个重要的背景信息同样关键:
第一,在支付端,该药1.98万元/剂的亲民定价(仅为美国同类药的约1/70),以及被多地“惠民保”及商业保险纳入的探索,构建了多层次支付保障。
第二,在研发端,针对糖尿病肾病、急性肾损伤等新适应症的临床研究已在获批后陆续展开,预示着其未来更大的治疗潜力。
全球已获批MSC疗法版图更新:中国力量崛起
随着艾米迈托赛注射液的上市,全球完全获批的MSC疗法数量更新为19款,地域分布如下表所示:
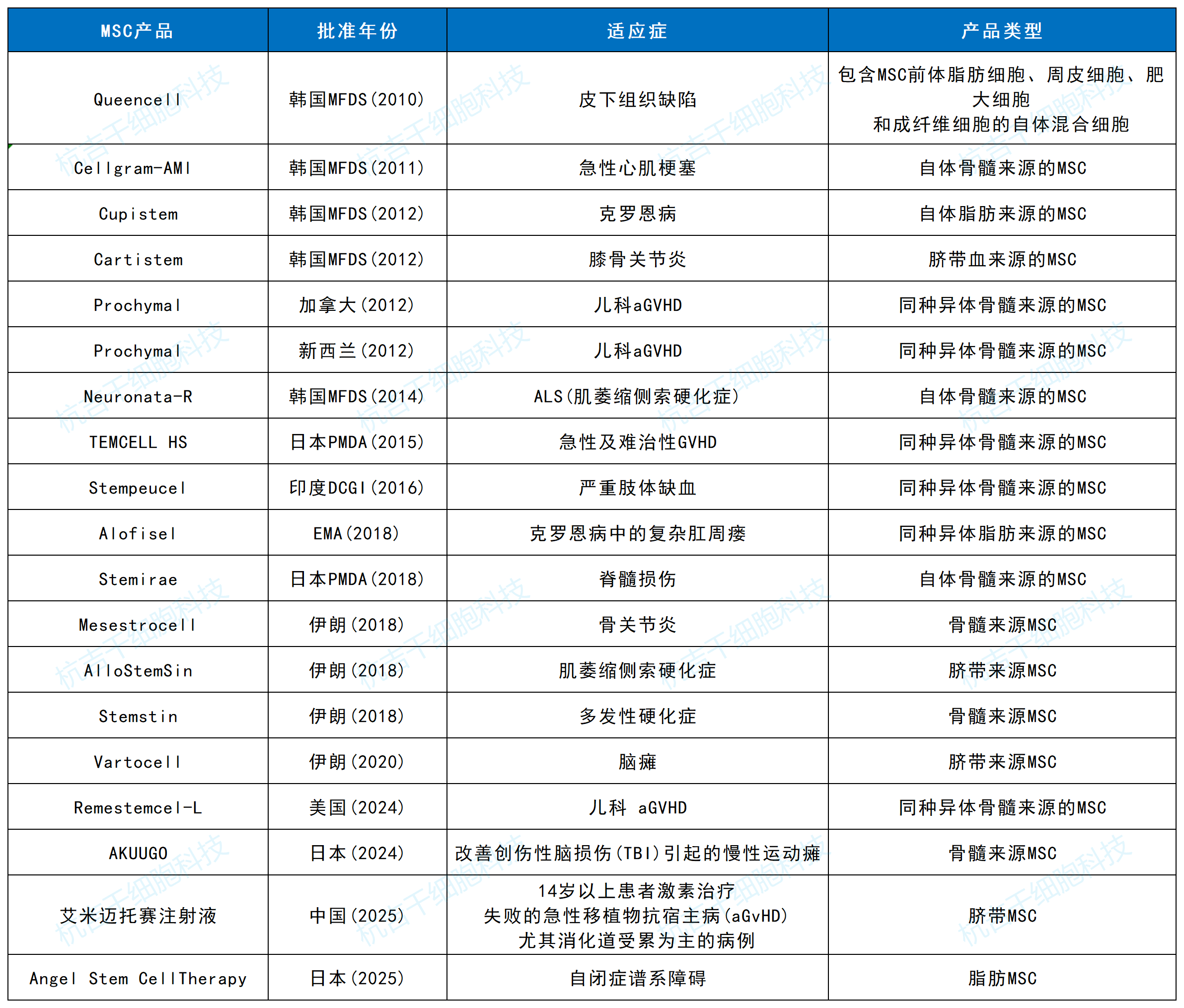
这一格局清晰表明,东亚(中、日、韩)已成为全球MSC疗法商业化应用的核心区域,其中中国凭借庞大的市场潜力、快速进步的研发体系和日益开放的监管态度,正迅速成长为全球不可忽视的领导者之一。
驱动中国再生医学浪潮的核心引擎:系统优势的集中释放
中国MSC领域能在短时间内取得突破性进展,源于多重内外部因素的合力:
战略政策牵引:“十四五”生物经济发展规划等顶层设计将细胞治疗明确为前沿生物技术重点,从国家战略层面提供持续支持。
临床需求迫切:人口老龄化加速,退行性疾病、免疫性疾病患者基数巨大,催生了巨大的临床应用市场。
研发基础扎实:中国在干细胞基础研究领域发表论文和申请专利数量已居世界前列,积累了丰富的科学人才和知识储备。
监管科学进步:NMPA近年来持续推进药品审评审批制度改革,针对细胞治疗等前沿产品,建立了更具灵活性且不降低标准的审评路径,与国际监管快速接轨。
资本积极涌入:在政策鼓励和市场前景吸引下,大量风险投资和产业资本进入细胞治疗赛道,支撑了从研发到生产的长期投入。
前路:一场更复杂的马拉松刚刚开始
获批是终点,更是起点。艾米迈托赛面临的挑战极具代表性:
第一关是市场教育与临床渗透。如何让全国范围内血液科的移植医生充分认知并信任这款全新的细胞药物,将其规范地纳入诊疗方案,是商业化的第一道坎。
第二关是确证性临床研究的压力。“附条件批准”意味着企业必须如期完成更严格的验证性临床试验,以确保持续满足完全批准的标准。这是一场不容有失的“期中大考”。
第三关是生产工艺的极致稳定。活细胞药品的每一剂都是“活的”。如何确保成千上万份产品在复杂的制备过程中,其细胞活性、纯度和功能毫厘不差,是生命线所在。
第四关是出海与国际认同。中国创新的终极试炼场是全球。艾米迈托赛能否以其中国数据,设计并开展符合国际标准的多中心临床试验,最终获得FDA或EMA的认可,将决定它能否从“中国新药”蜕变为“全球疗法”。
结语
艾米迈托赛注射液的批准,不是关于一个热门赛道的狂欢,而是一次关于 “临床价值本源” 的回归。它证明,中国的生物医药创新,完全有能力在最艰难、最危急的疾病阵地上,拿出世界级的解决方案。
它更像一个宣言:在全球细胞治疗的第二波浪潮中,中国不仅要做参与者,更要以独特的临床洞察、高效的研发体系和极具竞争力的可及性策略,成为重要规则的定义者之一。
2025年,中国细胞治疗的故事,从此翻开新的一页。它的主题不再是“能否做出新药”,而是 “我们如何定义好药” 。艾米迈托赛注射液,正是这个新叙事的开篇。
主要参考资料:网络资料整理
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。




اترك تعليقاً