近期,国际期刊杂志《干细胞研究与治疗》发表了一篇“一项针对亨廷顿病患者采用两种剂量水平的静脉注射人牙髓干细胞(NestaCell®)的I期开放标签研究”的综述。这项前瞻性、开放标签、单中心、首次人体临床试验评估了静脉注射牙髓干细胞治疗亨廷顿病患者的安全性、耐受性和初步疗效[1]。

结果初步疗效分析表明,NestaCell®在亨廷顿病患者中展现出良好的安全性,即使在长达五年的多次给药后,也未发生与治疗相关的严重不良事件。轻微不良事件(如暂时性毛发色素沉着)耐受性良好,未观察到致瘤性或显著免疫原性反应。临床获益体现在统一亨廷顿病评定量表总运动评分和总功能能力评分的稳定或改善,支持开展更大规模试验以进一步验证其疗效。
研究背景与产品特性
亨廷顿病(HD)是一种进行性神经退行性疾病,目前尚无获批的疾病修饰疗法。人牙髓干细胞(hDPSCs)因其神经发生、神经营养和免疫调节特性而具有潜在的治疗价值。与其他来源的间充质干细胞相比,hDPSCs在增殖速度、分化能力和获取便利性方面更具优势。

本研究采用的NestaCell®是一种由冷冻保存的hDPSCs悬浮于无菌生理盐水中组成的新型产品。它高表达巢蛋白并分泌高水平的脑源性神经营养因子,且因HLA-DR抗原低表达,可安全用于异体移植而无需免疫抑制。转录组分析显示其具有独特的促进轴突生长的基因表达谱。临床前研究表明,静脉注射的NestaCell®能在亨廷顿病模型动物中促进关键神经标志物表达,并迁移至中枢神经系统,且在高剂量下耐受性良好。
鉴于此,我们进行了一项前瞻性、开放标签、单中心的首次人体临床试验,旨在评估静脉注射NestaCell®在HD患者中的长期安全性、耐受性、初步疗效及免疫学效应。
方法:研究设计与评估
研究设计与受试者:本研究采用分阶段剂量递增的I期临床试验设计。招募了21-65岁、携带特定CAG重复序列的男性亨廷顿病患者。给药严格遵循分阶段原则:首名受试者接受低剂量(100万细胞/公斤)治疗,经至少30天观察确认安全性后,再纳入后续受试者。低剂量组完成并经安全委员会审查后,方启动高剂量组(200万细胞/公斤)研究。初始方案为三个月内三次给药,基于中期安全性数据,方案修订允许在五年随访期内增加给药次数。
细胞制备与质量控制:NestaCell®来源于健康儿童捐献的乳牙,在符合药品生产质量管理规范条件下分离、培养并建立细胞库。产品放行前经过严格检测,包括细胞活力、表面标志物(CD90、CD73高表达,HLA-DR低表达)、BDNF分泌能力、无菌性及内毒素等,确保其安全性和功能性。
安全性及疗效评估:安全性评估包括给药后48小时密集监测、定期体格检查、实验室检查(重点关注肝功能和免疫参数)、以及长达四年的肿瘤筛查。疗效通过统一亨廷顿病评定量表总运动评分和总功能能力评分的变化进行评估。免疫学效应通过监测CD4/CD8淋巴细胞计数及特定炎症细胞因子水平来探讨。
牙髓干细胞治疗亨廷顿病的结果
研究人群
本试验共筛选了7名患者,随后纳入6名。所有入组患者均完成了为期两年的随访;其中5名完成了三年随访,4名完成了四年随访,2名完成了整个五年试验。4名患者提前退出试验:1名患者因在100万细胞/公斤剂量下发生严重不良事件(肺癌,研究者终止试验),1名患者失访,2名患者撤回知情同意(图1)。患者的基线人口统计学特征和UHDRS评分汇总于表1。
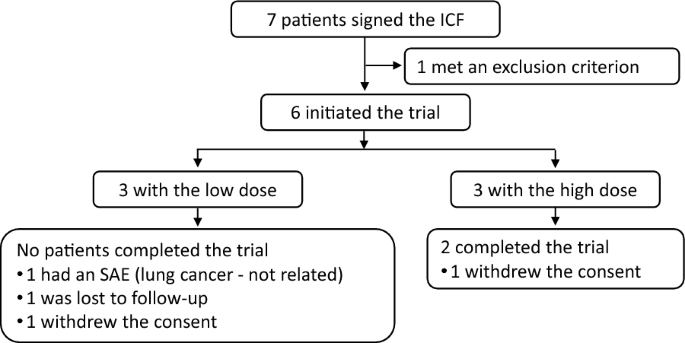
图1:研究流程图。
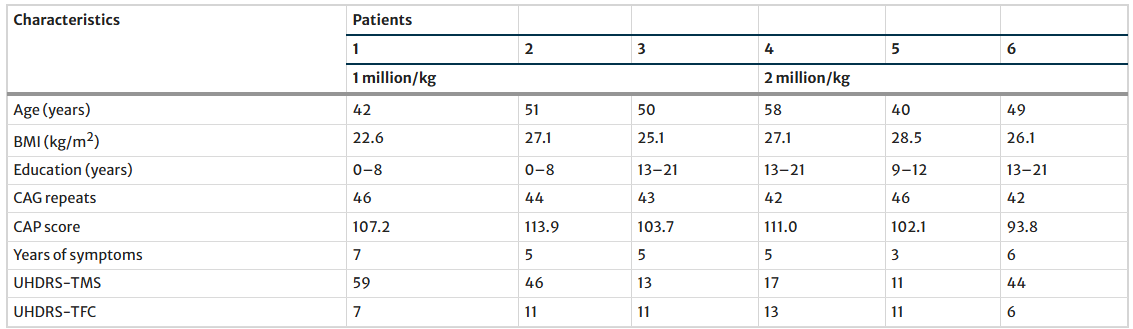
表1每位患者的人口统计学基线特征(V-1)
接受情况
表2总结了患者接受NestaCell®治疗的情况,共进行了102次给药:其中31次剂量为100万个细胞/公斤,71次剂量为200万个细胞/公斤。P3接受了一次长期给药,21天后停止治疗。
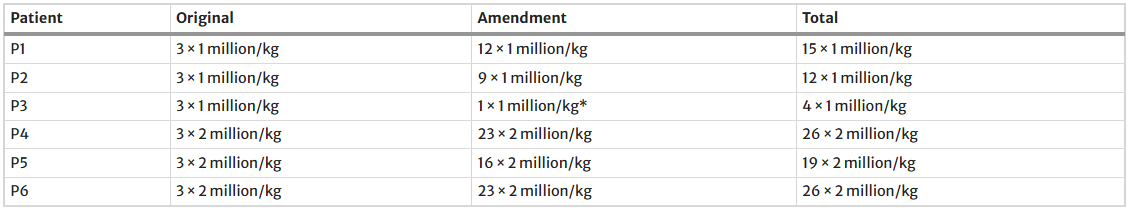
表2研究产品的暴露情况,以NestaCell®给药次数确定
安全情况
表3显示了按强度和与研究产品的关系分类的治疗期间出现的不良事件 (TEAE), 而表4详细列出了所有报告的TEAE 。
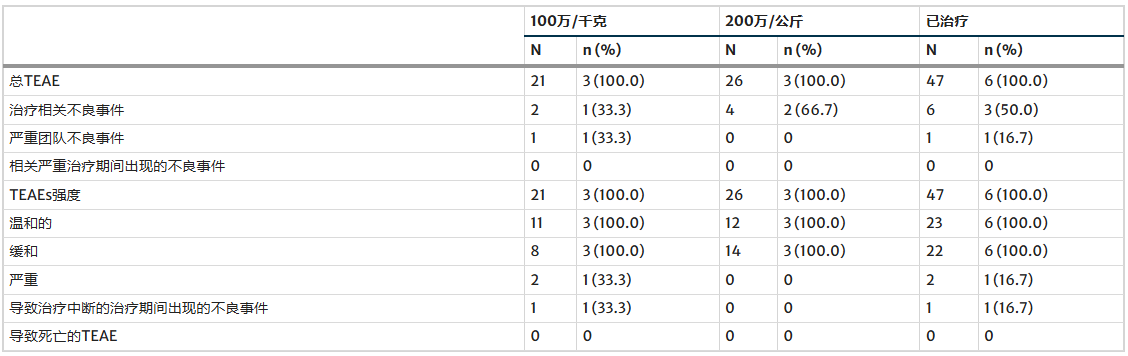
表4 按因果关系、强度和严重程度分类的治疗期间出现的不良事件(TEAE)。
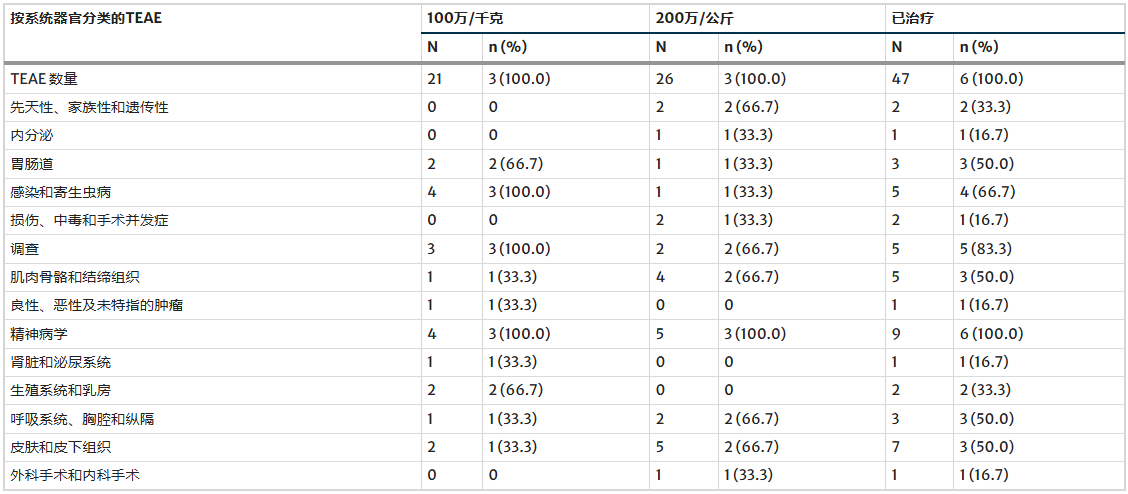
表4:按受影响器官类别划分的治疗期间出现的不良事件 (TEAE),定义见医学术语集 (MedDRA,版本 24.1,2021 年 9 月)
本研究的安全性数据显示,治疗期间患者在接受重症监护室(ICU)48小时监测后未出现任何不良事件。在为期五年的随访中,共报告47例治疗期间出现的不良事件,其中仅6例被评估与治疗相关,表现为暂时性的毛发色素沉着或再生改变,且均在约一个月内自行缓解;其余大多数事件与亨廷顿病本身进展相关,如精神障碍或皮肤问题,均被认为与治疗无关。
在严重不良事件方面,一例患者在治疗29个月后确诊肺腺癌,但基因分析证实肿瘤组织中不存在治疗细胞来源的物质,评估为与治疗无关;另一例抑郁加重事件与治疗的关系不明确,可能反映疾病自然病程。此外,少数患者出现肝功能酶轻度升高或淋巴细胞计数波动,但均在正常参考值范围内,无临床意义,且未显示明确的免疫抑制或激活模式。
其他监测指标如细胞因子(IL-4、IL-6)的个别升高可能与基础疾病或感染无关,生命体征和心电图参数基本保持正常。总体而言,该治疗在研究中表现出可接受的安全性特征,治疗相关不良反应轻微且短暂,未发现与治疗直接相关的严重安全性问题。
疗效方面
本研究通过年化斜率变化评估了患者在接受治疗第一年及长期随访期间的疗效,重点关注运动功能(UHDRS-TMS)和日常功能(UHDRS-TFC)两个核心指标。结果显示,不同患者对治疗的反应存在显著个体差异,且两个指标的变化趋势并不完全一致,提示疗效具有复杂性。
在运动功能(UHDRS-TMS)方面,初期阶段半数患者(P1-P4)呈现改善趋势(负斜率),而P5、P6则表现为恶化(正斜率)。在长期随访中,部分患者趋势发生转变:P1、P2维持改善;P5由恶化转为改善;P4则由改善转为轻微恶化;P6虽持续恶化但速度减缓。患者P3因提前退出,无法计算长期斜率(图2)。
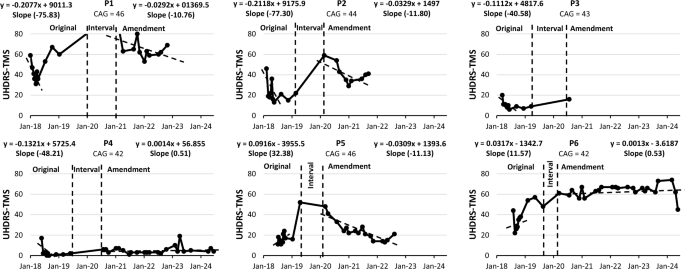
图2:在整个研究过程中,对每位受试者进行UHDRS-TMS评分。P1、P2和P3接受了100万个细胞/kg的剂量;P4、P5和P6接受了200万个细胞/kg的剂量。TMS值越低,运动功能恢复越好。原始数据:研究的第一年,从V0到V9。间隔期:V9到根据方案修订首次给予NestaCell®的时间段。
在日常功能(UHDRS-TFC)方面,初期仅P1和P3显示改善(正斜率)。长期随访数据显示,部分患者情况发生变化:P2和P4转为改善趋势;而其他患者则维持功能下降(负斜率)。同样,P3因数据不足未纳入长期分析。总体而言,治疗在部分患者身上显示出延缓疾病进展或改善症状的潜力,但疗效不一致,个体反应差异显著(图3)。
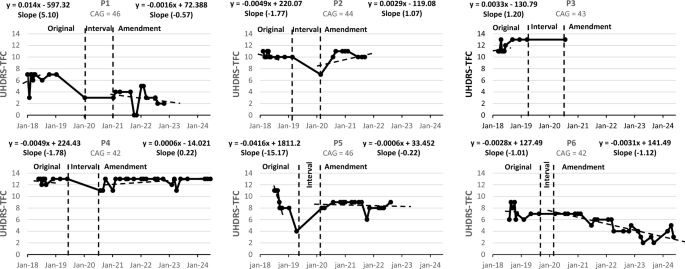
图3:研究期间,个体UHDRS-TFC值均被记录。P1、P2和P3接受了100万个细胞/kg的剂量;P4、P5和P6接受了200万个细胞/kg的剂量。TFC值越高,表明功能预后越好。原始数据:研究的第一年,从V0到V9。间隔期:V9到根据方案修订首次给予NestaCell®的时间段。
讨论
本项研究首次在亨廷顿病患者中评估了NestaCell®的安全性与耐受性,结果显示其在极高暴露剂量下(随访期内最多26次给药)仍具有显著的耐受性。短期密集监测未发现相关不良事件,中长期随访中记录的大多数不良事件被判定与疾病进展或偶发疾病无关,仅少数表现为暂时性毛发变化,可能与治疗相关。一例严重不良事件(肺部结节增大)经基因分析证实与治疗无关,且未检测到细胞植入,进一步支持了该干细胞产品的非致瘤特性,总体安全性良好。
研究观察到患者免疫参数(如CD4/CD8淋巴细胞计数)存在个体化波动,这可能与人牙髓干细胞的免疫调节特性相关。间充质干细胞的免疫作用具有情境依赖性,受剂量、局部微环境等因素影响;高剂量输注可能导致免疫应答差异,且细胞在促炎与抗炎表型间可转换,以适应慢性神经炎症状态。这些波动均处于正常生理范围,未伴随临床免疫抑制或自身免疫症状,与其他长期研究报道一致,反映了治疗反应的复杂性。
基于令人鼓舞的安全性和初步疗效证据,研究方案在随访期内修订增加了给药次数。两种剂量组均显示出潜在临床获益,体现为统一亨廷顿病评定量表的总运动评分和总功能能力评分的稳定或改善。这为未来进一步探索干细胞治疗在神经退行性疾病中的应用提供了有益参考。
结论
NestaCell®展现出良好的安全性,即使在长达五年的广泛用药后,也未发生与治疗相关的严重不良事件。轻微不良事件,例如暂时性毛发色素沉着变化,耐受性良好。未观察到致瘤性或显著的免疫原性反应。临床获益包括UHDRS-TMS和UHDRS-TFC评分的稳定或改善,支持开展更大规模的试验以进一步验证其疗效和长期获益。
参考资料:[1]:Fernandes, J.M.S., Pagani, E., Wenceslau, C.V. et al. A phase I, open-label study of intravenous human dental pulp stem cells (NestaCell®) at two dose levels in patients with Huntington’s disease. Stem Cell Res Ther 16, 611 (2025). https://doi.org/10.1186/s13287-025-04703-w
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

اترك تعليقاً