2025年12月28号,权威期刊《国际干细胞协会会刊》发表了一篇题为《从实验台到临床:中风康复干细胞疗法的演进历程》的重要综述[1]。
该文指出,包括间充质干细胞(MSCs)、神经干细胞(NSCs)和诱导多能干细胞(iPSCs) 在内的多种干细胞,其安全性与治疗潜力已在大量临床前及临床研究中得到验证。利用这些细胞的再生与修复潜能,被视为改善患者预后、减轻卒中全球疾病负担的关键策略。因此,持续推进相关技术的临床转化与系统化研究,对于卒中治疗的发展至关重要。

本综述的突出贡献在于,它不仅整合了关于血脑屏障(BBB)通透性、旁分泌效应及基因编辑策略等机制层面的见解,还系统分析了最新的临床试验数据,并纳入了“干细胞作为卒中治疗新兴范式”(STEPS)倡议的最新建议,从而提供了比以往更全面、更深入的视角。
干细胞为什么能够治疗中风?凭借的机制原理是什么?——结合最新临床试验数据的结果来了
那么,干细胞为什么能够治疗中风?其背后的核心机制是什么?下文将结合最新证据,从细胞类型、作用机制、临床进展及现存挑战等方面展开详细阐述。
一、 间充质干细胞(MSCs):以旁分泌为核心的“微环境调节者”
01、起源与特性:广泛的组织来源与多能特性
الخلايا الجذعية الوسيطة الوسيطة MSC (في بيولوجيا الخلية)是一类具有自我更新和多向分化潜能的成体干细胞。它们并非源自单一谱系,而是广泛存在于多种组织的微血管周围,被认为是周细胞或周细胞样细胞。
其经典来源包括骨髓、脂肪组织、脐带血以及牙髓等。这些细胞具有低免疫原性的关键优势,并能分化为成骨、成脂、成软骨乃至神经谱系等多种细胞,这种多能性是其应用于再生医学的细胞学基础。
02、卒中恢复中的作用机制
间充质干细胞治疗缺血性卒中的核心机制并非直接分化为神经元,而是通过强大的 “旁分泌”作用实现系统性修复。移植后的MSCs会释放一个复杂的生物活性因子集合(即“分泌组”),MSC的多方面治疗机制总结于图1。包括:
- 血管内皮生长因子(VEGF):促进缺血区血管新生,改善血供。
- 脑源性神经营养因子(BDNF):支持神经元存活,增强突触可塑性。
- 多种抗炎因子(如PGE2、IL-10):调节免疫反应,抑制有害炎症,促进小胶质细胞向保护型转化。
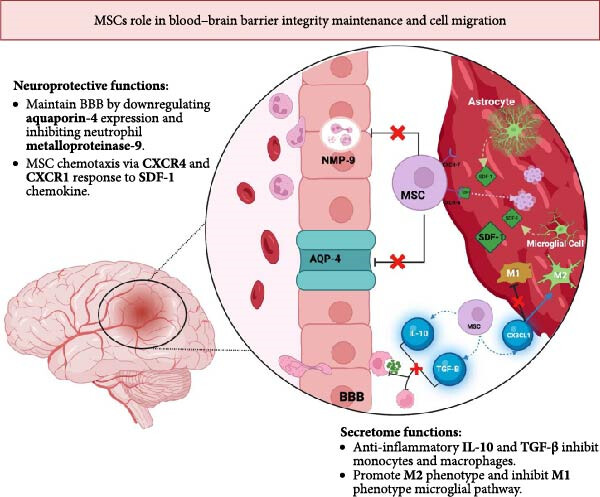
图1:图示为间充质干细胞(MSCs)在脑梗死区域的血脑屏障(BBB)保护和迁移能力。MSCs通过下调水通道蛋白4(AQP4)和中性粒细胞金属蛋白酶9(NMP-9)来维持BBB的完整性。星形胶质细胞和小胶质细胞分泌SDF-1,从而促进MSCs向梗死区趋化。MSCs分泌的细胞组促进抗炎性小胶质细胞(M2)分化,并下调单核细胞和巨噬细胞分化。
这些因子协同作用,在免疫调节、促进血管新生和增强内源性神经可塑性三大方向上修复卒中后受损的脑微环境。
03、临床研究进展
MSCs的临床转化研究最为活跃。在ClinicalTrials.gov上注册的相关临床试验已超过30项,多数处于I/II期。早期试验(如NCT00174323)一致证实,通过静脉或局部注射MSCs治疗卒中患者安全性良好,耐受性高。
近年来,规模更大的II期试验(如MASTERS、TREASURE)虽未完全达到主要疗效终点,但为优化给药时机、剂量和患者选择提供了关键数据。目前,III期试验(如MASTERS-2, NCT03545607)正在进行中,旨在进一步验证其疗效。
04、转化应用的关键限制:异质性、机制复杂性与标准化挑战
尽管前景广阔,但MSCs的广泛应用仍面临若干根本性挑战。首要限制是细胞的异质性,不同组织来源、供体个体差异及制备工艺会导致细胞产品在效能和特性上不一致,为治疗标准化带来巨大困难。
其次,其作用机制高度复杂且依赖于微环境,如何精确调控其旁分泌效应以达到最佳疗效仍需深入阐明。
此外,确定最优的治疗时间窗、给药途径、细胞剂量,以及通过大规模III期临床试验获得确切的疗效证据,都是其迈向常规临床实践前必须解决的关键问题。
二、 神经干细胞(NSCs):直接的“细胞替代者”
01、起源与特性:发育与成年的动态存在
الخلية الجذعية العصبية是具有自我更新和多向分化潜能的成体干细胞,是构建和修复神经系统的基础细胞。在胚胎发育阶段,它们起源于神经管,通过对称与不对称分裂产生神经元和各类胶质细胞,是中枢神经系统的“种子”。
在成年大脑中,NSCs主要存在于脑室下区和海马齿状回等特定区域,通常保持静息状态,但在脑缺血、损伤等病理刺激下可被激活,产生新的神经细胞。然而,内源性NSCs的激活程度和再生能力极其有限,无法有效应对如卒中导致的大规模神经细胞死亡,这构成了外源性NSCs移植治疗的理论基础。
02、卒中恢复中的作用机制:直接替代与营养支持双轨并行
NSCs治疗卒中的作用机制呈现双重特性,图2总结了神经干细胞特有的治疗机制。
- 一方面,其核心优势在于固有的神经谱系定向分化潜能,能够直接迁移至损伤区域,并分化为神经元、星形胶质细胞和少突胶质细胞,直接替代丢失的细胞,重建神经环路。
- 另一方面,与间充质干细胞类似,NSCs也通过强大的旁分泌作用发挥疗效,释放脑源性神经营养因子(BDNF)、血管内皮生长因子(VEGF)、血小板反应蛋白(TSP1/2)等多种因子。
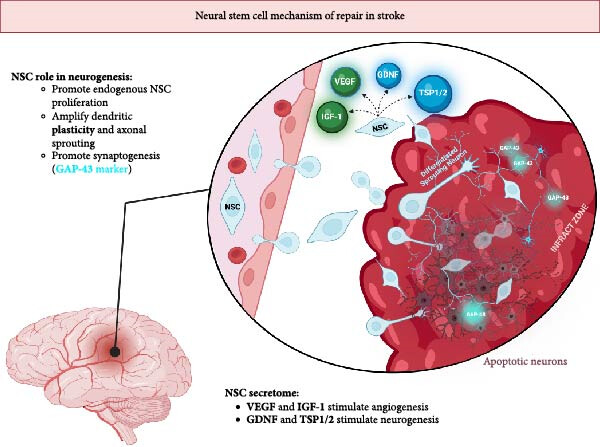
图2:图示移植的神经干细胞(NSCs)的神经调控功能。GAP-43的表达表明突触生成活跃。NSCs积极分裂并替换凋亡的神经元,同时促进树突可塑性和轴突萌生。NSCs通过分泌GDNF、TSP1/2、IGF-1和VEGF促进神经发生(蓝色)和血管生成(绿色)。
这些因子协同作用,可抑制炎症、促进血管新生、保护现存神经元并增强内源性神经可塑性,为细胞替代和新细胞的整合创造有利的微环境。
03、临床研究进展:早期探索与来源安全性的演进
NSCs的临床探索较早但道路曲折。早期研究(如使用NT2/D1细胞系)显示了安全性及初步功能改善迹象。PISCES系列临床试验(使用人胎儿皮层来源的CTX0E03细胞)是重要里程碑,证实了颅内移植NSCs的长期安全性,并在特定患者亚组中观察到上肢运动功能改善。目前,研究重点转向更安全、可再生的iPSCs来源的NSCs。
04、转化应用的关键限制:来源、存活与整合的严峻挑战
NSCs的临床应用面临一系列严峻的科学与技术瓶颈。首先,细胞来源与制备是根本挑战,原代获取困难且具有伦理争议,而诱导多能干细胞来源则需解决致瘤风险与分化纯度问题。其次,移植后细胞的存活率低、功能整合效率差是主要障碍,缺血区域的恶劣微环境严重阻碍了移植细胞的定植与突触连接。
此外,免疫排斥风险(尤其异种移植)、供体细胞的高度变异性以及最佳移植时机、途径和剂量的不确定性,共同制约了其治疗效果的可靠性与可重复性。因此,如何保障安全、稳定且功能完善的NSCs来源,并提高其在宿主脑内的存活与整合效率,是当前转化研究的核心课题。
三、 诱导多能干细胞(iPSCs):个性化的“全能种子库”
01、起源与核心优势:体细胞重编程开启个性化治疗时代
诱导多能干细胞并非源自胚胎或特定成体组织,而是通过生物技术将成熟体细胞(如皮肤成纤维细胞)“逆转”回胚胎样多能状态而获得(图3)。其核心技术突破源于2006年山中伸弥团队发现的“OSKM”转录因子组合,通过病毒载体导入可实现重编程。
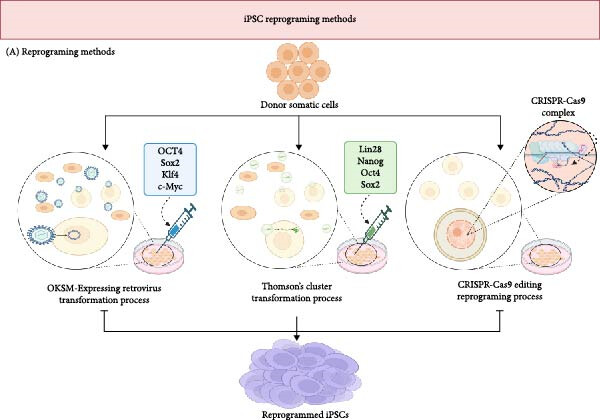
图3:图示为目前将体细胞重编程为诱导多能干细胞(iPSCs)的机制。细胞重编程可通过OKSM和Thompson簇转录因子的组合,或通过CRISPR-Cas9基因编辑实现。
此后,技术不断演进,开发了非整合型仙台病毒、微环DNA等更安全的载体以降低致瘤风险。iPSCs最革命性的优势在于其自体来源的可能性,即用患者自身的细胞制造治疗用细胞,从而在理论上避免了免疫排斥,并为再生医学提供了近乎无限的、符合伦理的个性化细胞来源。
02、卒中恢复中的作用机制:全能分化与多效修复的结合
iPSCs本身并非直接用于移植,而是作为“种子细胞库”,预先分化为所需的功能细胞(如神经干细胞、特定神经元或间充质干细胞样细胞)后再进行移植。
因此,其治疗机制融合并扩展了NSCs和MSCs的优势:
- 一方面,它能分化为真正的神经元,直接替换卒中区死亡细胞,并能在宿主脑内形成功能性突触连接;
- 另一方面,它及其分化产物能通过强大的旁分泌作用,分泌VEGF、BDNF等多种营养因子,发挥与MSCs类似的免疫调节(如抑制促炎因子)、促进血管新生和保护现存神经元的作用。
这种“细胞替代”与“营养支持”的双重能力,使其修复潜力理论上最为全面。
03、临床研究进展:临床前证据充分,卒中临床应用方兴未艾
目前,iPSCs在缺血性卒中治疗领域尚处于临床前研究向早期临床过渡的关键阶段。其疗效已在大量动物模型中得到验证,证实其在改善神经功能、促进组织修复方面的潜力。
在更广泛的神经系统疾病领域,如帕金森病,基于iPSCs分化的多巴胺能神经元移植已进入首例患者临床试验,为其神经系统应用的安全性和可行性提供了先行参考。尽管针对卒中的直接临床试验尚未大规模展开,但其强大的潜力正推动研究者致力于建立标准化、安全的分化方案,为即将到来的临床探索奠定基础。
04、转化应用的关键限制:安全、成本与制备工艺的严峻挑战
iPSCs走向临床面临一系列极高门槛的限制。首要且核心的限制是安全性问题,尤其是致瘤风险,这既可能来源于重编程因子(如c-Myc)的残留或再激活,也可能来自未完全分化的iPSCs污染。
其次,复杂的生产工艺导致成本高昂、周期长且难以标准化,从体细胞采集、重编程、定向分化到严格的质控(排除遗传异常和致瘤性),每一步都充满技术挑战,严重阻碍其成为可普及的疗法。
此外,即使使用自体iPSCs,其表观遗传记忆和分化过程中的免疫原性变化也可能引发意想不到的免疫反应。因此,如何在确保绝对安全的前提下,实现规模化、经济且稳定的细胞产品生产,是其转化道路上必须攻克的堡垒。
四、 干细胞给药途径:疗效的关键决定因素
干细胞的给药途径和时机是卒中治疗效果的关键决定因素,给药方式可以是全身给药或局部给药。图4概述了目前的给药途径及其各自的优势和局限性。
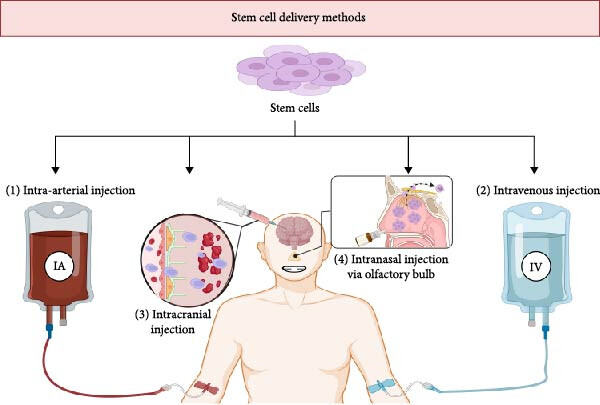
图4:全身(静脉注射、动脉注射)和局部(脑室内注射、鼻内注射)干细胞输送方法。
时机尤为重要:在卒中后24小时内且不晚于72小时内进行干细胞移植,可观察到梗死体积最大程度的减少和功能改善。在卒中后0-8小时内进行的移植可显著缩小梗死面积,而24小时后进行的移植仍能改善行为表现。
相比之下,在亚急性期和慢性期(卒中后7-30天)进行的治疗通常效果较差。这些发现强调了干细胞治疗的时间敏感性,以及优化治疗窗口以达到最佳临床疗效的必要性。
01、主要给药途径的分类与基本原理
干细胞治疗脑卒中的给药途径主要分为全身性与局部性两大类。全身给药以静脉注射(IV) 和动脉注射(IA) 为代表,前者操作最简便但细胞在脑部的生物分布极低(约1%),多数滞留于肺、肝等外周器官;后者通过颈内或大脑中动脉进行靶向输注,提高了脑部靶向性,但仍有99%以上的细胞无法到达,且存在微血栓风险。
局部给药则旨在绕过血脑屏障,直接作用于中枢神经系统,包括脑室内注射(ICV)、鞘内注射(IT) 和鼻内给药(IN)。这些途径利用脑脊液循环或神经通路,能显著提高病灶区域的细胞驻留率(如脑室内注射可达60%),但侵入性操作(如ICV)伴随更高的手术风险。
02、各途径的疗效与安全性权衡
不同给药途径在疗效与安全性间存在显著权衡。疗效方面,动脉注射因其相对精准的靶向性,在动物模型中显示出优于静脉注射的神经功能恢复;而局部给药的脑室内注射则能让最多细胞滞留于病灶,理论上局部治疗效应最强。
安全性方面,数据显示静脉注射的不良事件总发生率最高(达65.42%),但多为轻度或系统性反应;而侵入性最强的脑室内注射,其严重不良事件(如出血、感染)的比例最高(44.44%)。非侵入性的鼻内给药虽前景广阔,但疗效与机制尚需更多临床验证。因此,途径选择需综合考量急性期还是恢复期治疗、患者整体状况及手术耐受能力。
03、生物材料辅助递送的技术进展
为克服传统给药的局限,生物材料工程正成为优化递送策略的关键方向。其核心目标是提高移植细胞的存活率、靶向性与功能持续性。
例如,可注射的水凝胶能为细胞提供三维保护性微环境,并持续释放营养因子;纳米颗粒可作为载体,增强细胞的靶向迁移或实现治疗因子的可控释放;纤维蛋白胶等支架材料可直接填充梗死腔,将细胞固定于损伤区域,促进其定植与分化。
未来,复合系统(如载纳米颗粒的水凝胶)有望通过协同作用,更智能地对抗卒中后有害微环境,实现精准修复。
04、个体化与精准化的递送策略
综上所述,不存在“最优”的通用给药途径,其选择高度依赖于治疗目标、时间窗和细胞类型。急性期治疗可能更看重快速与可及性,而恢复期修复可能追求病灶内更高的细胞驻留。
未来的发展趋势将是开发个体化、精准化的递送方案,并结合生物材料技术以最大化疗效并控制风险。通过将特定细胞类型与最适配的递送途径及生物材料相结合,有望系统性提升干细胞治疗脑卒中的可靠性、安全性与有效性,推动其从实验研究向成熟临床治疗的转化。
五、干细胞治疗中风的临床试验历史
尽管临床前证据已证实干细胞疗法具有令人鼓舞的再生、神经保护和免疫调节作用,但其临床转化仍需通过人体试验进行严格评估。
目前,多种干细胞类型已在缺血性卒中(IS)患者中进行了测试,测试方法包括不同的给药途径、剂量和卒中后时间窗。这些试验主要集中于验证其安全性和可行性,并初步显示出治疗获益。
表1概述了近期临床试验,总结了关键的研究设计和结果,以阐明当前的转化现状。以下章节将概述造血干细胞、间充质干细胞和神经谱系干细胞的临床进展,详细介绍主要发现和仍然存在的转化障碍。
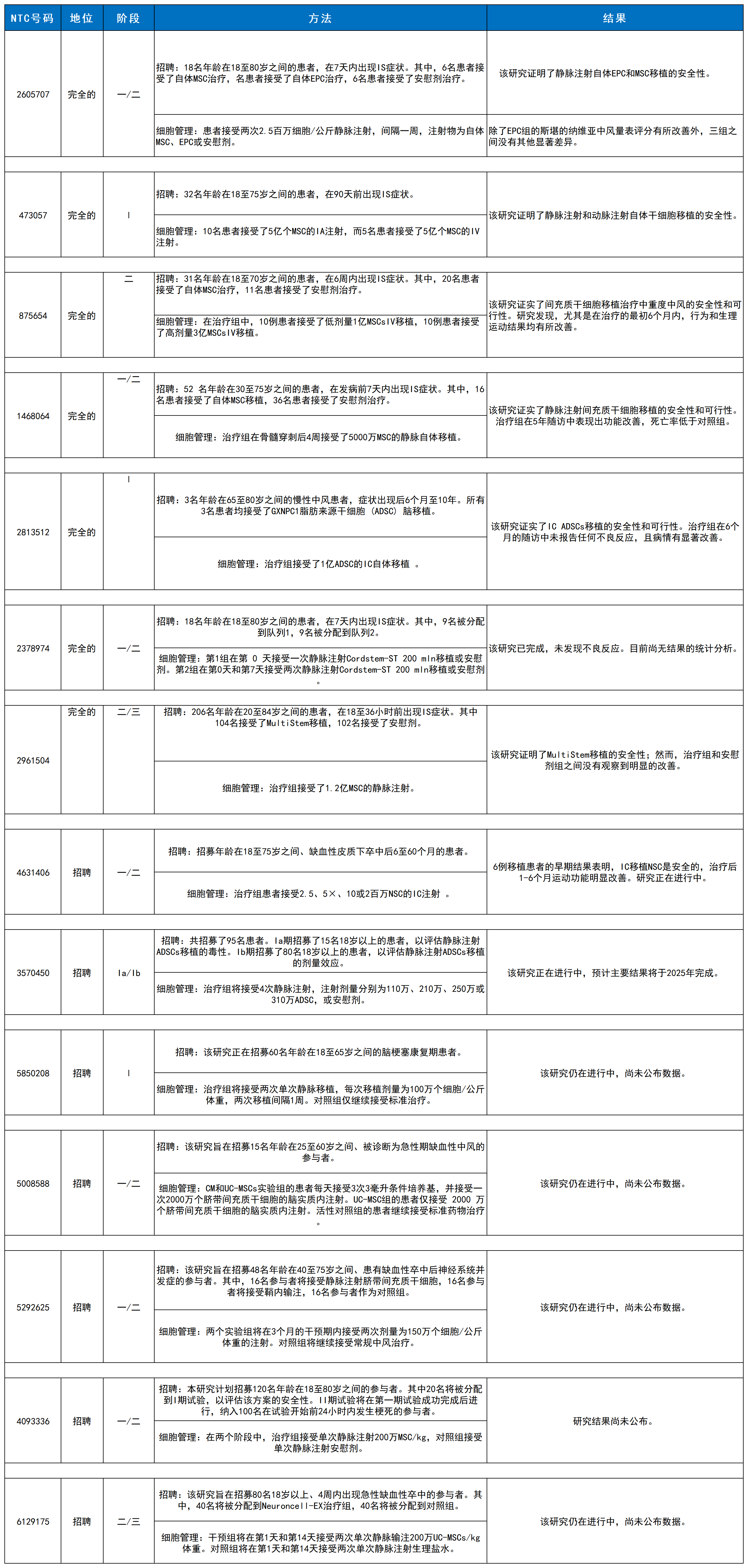
表1:使用干细胞治疗中风的临床试验。
造血干细胞/骨髓单核细胞:早期试验证实了安全性,但大规模III期试验(如TREASURE)未显示显著临床获益,提示需优化患者选择与给药策略。
间充质干细胞:积累了最多的安全性与可行性数据。尽管部分II期试验结果未达终点,但长期随访显示部分患者功能持续改善。III期试验正在进行中。
神经谱系干细胞:PISCES试验证明了颅内移植的安全性,并在预设亚组中观察到功能改善。未来方向聚焦于iPSCs来源的NSCs。
六、结论与未来展望
干细胞疗法为卒中修复带来了范式转变,其核心机制并非简单的细胞替换,而是通过旁分泌介导的多元修复(神经保护、免疫调节、血管新生、促进内源性再生)来重塑损伤微环境。
尽管不同类型的干细胞都展现出治疗潜力,但它们的局限性对临床转化至关重要。间充质干细胞(MSCs)面临供体差异和异质性,影响其可重复性;神经干细胞(NSCs)由于依赖于胎儿或肿瘤来源的细胞系,引发了伦理和来源方面的担忧;而诱导多能干细胞(iPSCs)则存在致瘤性和高昂的生产成本风险。
图5比较了MSCs、NSCs和iPSCs的核心特征,重点阐述了它们各自的优势和局限性如何影响治疗方案的选择。
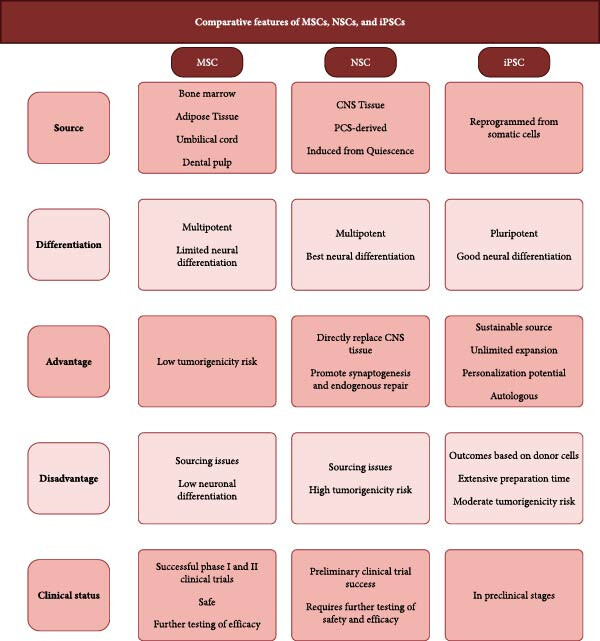
图5:图表总结了间充质干细胞 (MSC)、神经干细胞 (NSC) 和诱导多能干细胞 (iPSC) 在中风治疗中应用的关键特征。比较的类别包括细胞来源、分化能力、治疗优势、治疗劣势和当前临床应用状况。
当前的研究前沿正从“是否有效”转向“如何优化”,策略包括:
- 利用基因编辑(如CRISPR)增强细胞功能或安全性。
- 开发无细胞的“分泌组”疗法,规避细胞移植风险。
- 结合生物材料优化递送效率。
- 严格遵循STEPS等转化框架,精细化定义患者分层、治疗时间窗及康复联合方案。
未来突破将依赖于跨学科的系统性整合——将细胞生物学、材料科学、影像学与临床神经病学紧密结合,推动干细胞疗法从一项前景广阔的研究,转化为可重复、安全且惠及广大卒中患者的常规治疗手段。
主要参考资料:
[1] Waszczuk, Daniel , Manikandan, Shrivats, Manikandan, Varsha, Stone, Erian, Buehre, Shannon, Shore, Steiv, Panchatcharam, Manikandan, Miriyala, Sumitra, 从实验室到临床:干细胞疗法在卒中康复中的发展现状, 《干细胞国际》,2025,3734659,15页,2025。https://doi.org/10.1155/sci/3734659
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

اترك تعليقاً