مرض باركنسون是一种以中脑黑质多巴胺能神经元逐渐丧失为核心病理的进行性神经退行性疾病,现有药物如左旋多巴,仅能缓解症状,如同为一条逐渐断联的电路进行临时充电,却无法阻止神经元本身的持续死亡。疾病进程无法逆转,是当前治疗的核心困境。
于是,一个根本性的问题被推向医学前沿:如果我们可以替换大脑中那些死去的神经元呢? 这个大胆的设想,正将基因编辑技术结合干细胞治疗帕金森推向灯光下,它们承诺的不是症状管理,而是潜在的治愈可能。

一、帕金森病:被“冻结”的大脑
帕金森病的核心病理,在于大脑黑质中分泌多巴胺的神经元进行性、不可逆地死亡。多巴胺作为神经递质,是控制运动流畅性的关键信使。它的锐减导致大脑运动环路“断联”,从而引发震颤、僵直与运动迟缓。
传统疗法已触及天花板。左旋多巴类药物虽有效,但随着病程延长,其“蜜月期”会结束,并引发复杂的运动并发症。深部脑刺激(DBS)作为外科疗法,如同在大脑中植入一个“神经起搏器”,能有效调节异常电信号,但它依然是对症状的调控,无法修复或再生神经细胞。
真正的治本之道,在于 “修复与替换”。这正是干细胞与基因编辑技术结合的使命:干细胞作为新细胞的“种子”,而基因编辑则是修正细胞内在缺陷的“手术刀”。
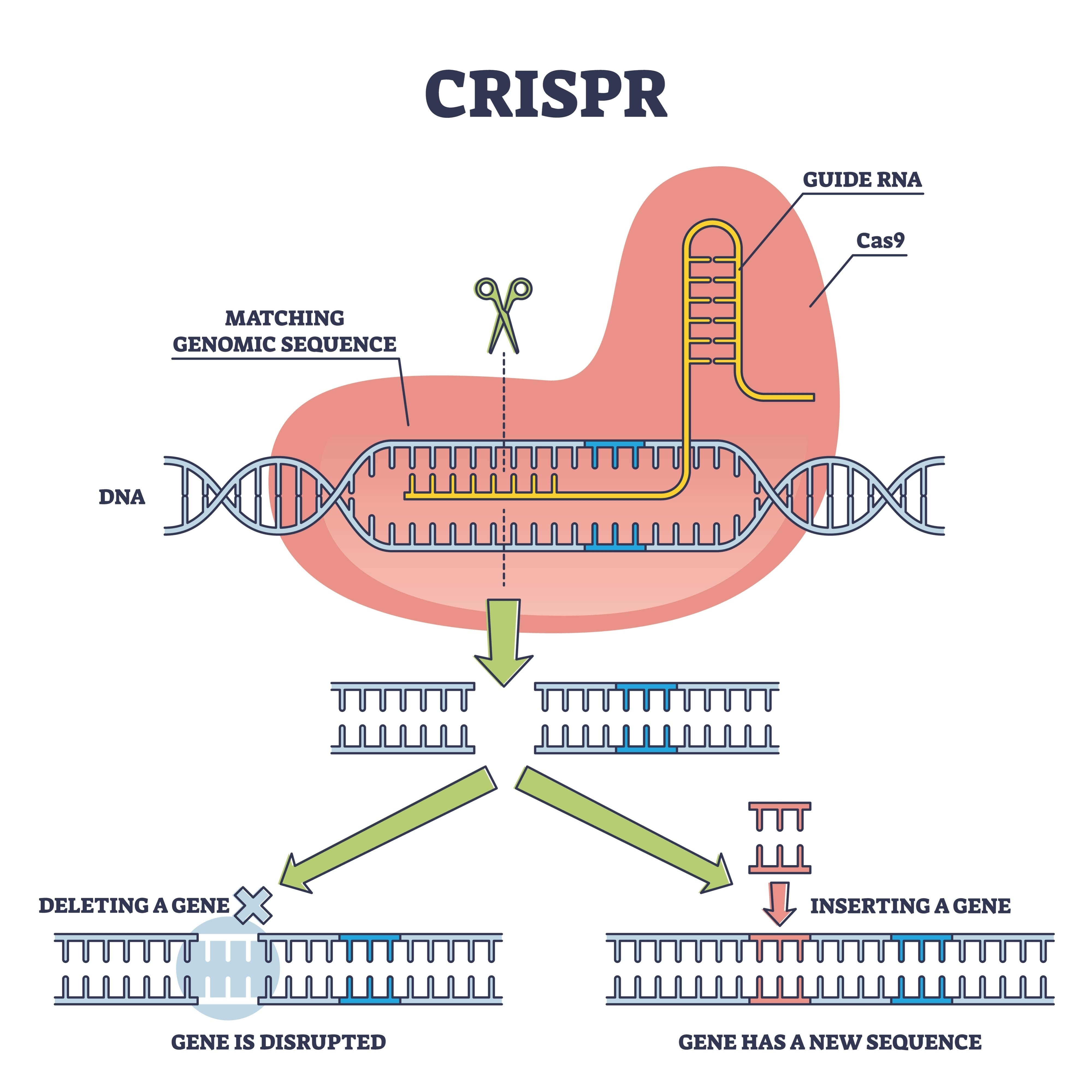
二、基因编辑技术结合干细胞治疗帕金森的技术蓝图:当干细胞遇见CRISPR
1. 干细胞——生命的“种子细胞”
其中,诱导多能干细胞(iPS细胞)技术带来了革命。科学家可以将患者自身的皮肤或血液细胞“逆转时光”,重编程为具有无限潜能的干细胞,再将其定向分化为多巴胺能神经元前体。这种“个性化”方案理论上避免了免疫排斥,也绕开了胚胎干细胞的伦理争议,为每位患者量身定制修复材料。
2. 基因编辑——精准的“分子手术刀”
然而,对于一些遗传性帕金森病患者,其自身的iPS细胞仍携带致病基因突变(如LRRK2、GBA、PINK1等)。此时,CRISPR-Cas9基因编辑技术便隆重登场。它像一把精确的分子剪刀,可以在干细胞阶段就精准剪除或修正致病基因,从源头创造健康的细胞。关键突破在于,这些经过“编辑”的干细胞,能够被成功诱导为功能正常、不携带遗传缺陷的多巴胺能神经元。
3. 动物实验中的希望之光
概念已在动物模型中得到验证。例如,日本京都大学团队将利用人源iPS细胞分化的多巴胺能神经元前体,移植到帕金森病模型猴的脑中。这些细胞成功存活、整合,并显著改善了猴子的运动功能。这束“希望之光”证明了原理的可行性。但挑战同样醒目:移植细胞的存活率、与宿主大脑建立功能性突触连接的能力,以及潜在的肿瘤形成风险,都是必须跨越的障碍。
三、现实的壁垒:从实验室到病房的距离
1. 科学挑战
-
细胞精准递送与定位:大脑是人体最精密的器官。如何将数十万个细胞精准移植到豆粒大小的黑质区域?即便送达,又如何确保它们能像原生的神经元一样,长出长达数厘米的轴突,准确“接线”到纹状体,并接收正确的调控信号?
-
基因编辑的“脱靶效应”:CRISPR技术并非绝对精确,可能存在“误伤”其他正常基因的风险,引发不可控的突变,尤其是在临床应用要求绝对安全的前提下。
-
疾病复杂性:绝大多数帕金森病是遗传、环境与衰老等多因素交织的结果。即便修复了已知的少数基因,能否完全阻止复杂网络下的神经退行?
2. 临床转化之难
-
免疫风险:即便使用自体细胞,基因编辑过程本身也可能改变细胞的免疫原性,仍需警惕排斥反应。
-
长期安全性:编辑后的细胞将在患者体内存活数十年。它们会稳定工作吗?会否衰亡或发生其他转化?这需要长达数十年的随访数据。
-
代价与可及性:个性化细胞疗法流程漫长、成本高昂,如何从“天价”变为医保可覆盖的普惠治疗,是巨大的社会经济挑战。
3. 伦理与社会的“大脑迷宫”
-
改变“人的属性”? 编辑人类神经细胞、植入人工培育的神经元,是否在本质上改变了人的生物属性或认知连续性?
-
不确定下的知情同意:如何向患者清晰说明这项前沿技术巨大的潜力与未知的长期风险?
-
公平性困境:若技术成功,会否成为只有少数人可及的“奢侈品”,加剧全球健康不平等?
四、有两者之间联合治疗的实际临床案例吗?
确实已经有了一些非常振奋人心的实际临床案例。虽然“基因编辑+干细胞”的完全组合疗法大多仍处于临床试验(Clinical Trials)阶段,但干细胞移植治疗帕金森在近两年(2024-2025年)取得了突破性的里程碑进展。
以下是几个最具有代表性的真实案例和研究进展:
1. 中国首例:自体干细胞移植成功(2025年最新)
2025年3月至4月,上海瑞金医院完成了中国首例 GCP 级(临床试验质量管理规范)自体干细胞治疗帕金森病的临床手术。
-
案例细节: 一位患病14年的66岁女性患者沈女士,接受了由中科院脑智卓越中心陈跃军团队研发的 UX-DA001 注射液治疗。
-
技术路径: 医生采集患者自身的血液细胞,诱导成为 iPS 细胞,再分化为多巴胺能神经前体细胞并精准植入脑部。
-
显著效果: 手术一个月后,沈女士原本僵硬的手脚变得灵活,实现了整天自主行走,且睡眠质量大幅改善。因为使用的是自体细胞,她无需服用免疫抑制剂。
2. 全球领先:BlueRock 的“现货型”细胞疗法(2024-2025年)
拜耳旗下的 BlueRock Therapeutics 正在进行的 Bemdaneprocel (BRT-DA01) 试验是目前全球进展最快的项目之一。
-
最新数据: 2024年和2025年公布的 I/II 期临床数据显示,12名受试者在移植36个月后,安全性良好。
-
临床表现: 高剂量组患者的运动症状评分(MDS-UPDRS Part III)平均下降了 17.9分。
-
意义: 该疗法在2024年获得了美国 FDA 的“再生医学先进疗法(RMAT)”认证,并于2025年启动了全球首个 III 期关键性临床试验(exPDite-2),标志着干细胞治疗离正式上市仅一步之遥。
3. “基因编辑+干细胞”的组合拳:实验室向临床的飞跃
虽然目前获批进入人体试验的案例多以单纯的“干细胞替换”为主,但基因编辑的介入主要体现在以下两个实际应用场景中:
-
同基因对照模型(Isogenic Controls): 在加州再生医学研究所(CIRM)支持的项目中,科学家通过基因编辑(如 ZFN 或 CRISPR)“修正”患者 iPSC 中的 LRRK2 或 SNCA 突变。这不仅用于实验室研究,更在为未来的“精准医疗”铺路——即先编辑修复基因,再进行移植。
-
通用型“隐身”细胞: 某些初创公司(如 Universal Cells)正在利用 CRISPR 编辑干细胞的 HLA(人类白细胞抗原)基因,使这些细胞对任何人的免疫系统都“不可见”。这意味着未来不需要用患者自己的细胞(昂贵且耗时),可以直接从“细胞库”取用编辑好的通用细胞进行治疗。
五、未来图景:在“治愈”与“管理”之间
展望未来,道路渐进而清晰:
-
短期现实(5-10年):这项技术最直接的应用是构建精准疾病模型。用患者的编辑后细胞在培养皿中构建“微型大脑”(类器官),用于高效筛选传统药物,加速现有疗法的优化。
-
中期突破(10-15年):针对由特定基因突变(如LRRK2)驱动的帕金森病亚型,个性化的“基因修复+细胞移植”疗法最有希望率先实现临床应用,成为这部分患者的根治性选择。
-
长期愿景:科学家正致力于开发通用型、“现货型”的“细胞工厂”,即利用健康供体的细胞制备标准化、经基因编辑避免排斥的“现成”细胞产品。但要实现对所有类型帕金森病的全面逆转,我们仍需对疾病本质有更深刻的理解。
结语:在希望中前行,在审慎中突破
中国科学院神经所及同济大学干细胞中心等机构的研究者们,正与全球科学家同步,在微观世界里为人类的自由而战。正如一位帕金森患者在接受临床试验咨询时所说:“我们不是在寻找奇迹,而是在寻找可能性。”
基因编辑与干细胞的结合,既不是遥不可及的幻想,也不是触手可及的坦途。它是一条由科学的严谨、伦理的审慎与人文的关怀共同铺就的长路。每一次实验室里的细胞跳动,都是在为人类夺回被“冻结”的自由而努力。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

اترك تعليقاً