干细胞治疗儿童1型糖尿病代表着超越单纯胰岛素替代的疾病修饰疗法的重要研发方向。1型糖尿病(T1DM)是一种由自身免疫介导的疾病,其特征是胰岛β细胞被破坏,导致患者终生依赖外源性胰岛素。对于儿童患者,亟需能够保护或恢复残余β细胞功能的疗法。
新突破!异体脂肪干细胞治疗儿童1型糖尿病获临床证实:安全有效,显著减糖降药
在此背景下,一项于2026年1月15日在《Research Square》上发布的研究综述,深入探讨了名为GXIPC1的异体AD-MSC产品在T1DM中的临床应用。GXIPC1是一种在严格GMP标准下生产、不含异种成分的“现成”疗法。

该综述总结的1期单臂临床试验表明,静脉输注GXIPC1在新近发病的T1DM儿童中安全性良好,并且显示出改善血糖控制、减少胰岛素用量的初步积极信号。这些发现支持进一步开展随机对照研究以确证其疗效。
那么,我们应如何全面理解这项研究及其意义?下文将通过四个核心问题展开分析:为何选择异体脂肪间充质干细胞作为治疗1型糖尿病的策略?本研究如何设计与评估?其安全性与初步疗效结果究竟如何?以及,这些发现指向怎样的未来方向?
一、为什么选择异体脂肪来源的间充质干细胞作为治疗1型糖尿病的新策略?
01、当前1型糖尿病主流治疗的局限性
现有策略无法满足“疾病修饰”的根本需求:
- 外源性胰岛素治疗:属于替代疗法,无法阻止自身免疫对β细胞的持续攻击,且存在低血糖风险、严格生活管理负担和长期并发症问题。
- 胰岛/胰腺移植:虽能恢复内源性胰岛素分泌,但面临供体严重短缺、需要长期使用免疫抑制剂(带来感染、肿瘤等风险)以及手术相关风险。
结论:亟需一种能够调节自身免疫、保护或恢复残余β细胞功能的疾病修饰疗法。
02、间充质干细胞作为理想的疾病修饰治疗候选
MSCs的核心价值在于其双重作用机制:
强大的免疫调节与抗炎能力:抑制树突状细胞、T细胞、NK细胞等效应免疫细胞的活化。促进具有保护作用的调节性T细胞扩增。从而可能阻断或减缓对胰岛β细胞的自身免疫攻击。
组织修复与再生潜能:通过分泌多种旁分泌因子(细胞因子、生长因子等),创造有利于β细胞存活、增殖和血管再生的微环境。在特定条件下,有潜力分化为胰岛素分泌细胞。
低免疫原性:由于其表面主要组织相容性复合体(MHC)分子表达低,异体移植后排斥反应风险小,无需或仅需短期免疫抑制,这解决了胰岛移植的关键痛点。
初步临床证据:已有多项临床研究表明MSCs治疗能降低新诊断T1D患者的胰岛素需求、维持C肽水平,证实其潜在疗效。
03、为何特别选择“脂肪来源”的MSCs?
在多种组织来源的MSCs中,脂肪来源的MSCs具有独特优势:
更强大的免疫调节能力:与骨髓或脐带来源相比,AD-MSCs表现出更强的抑制T细胞活化的能力,并分泌独特的细胞因子谱(如IL-8, CCL5, IDO),这使其在抑制自身免疫反应方面可能更具效力。
易于获取与扩增:脂肪组织储量丰富,可通过微创抽脂术大量获取,细胞得率高,且体外增殖能力强,便于制备满足临床治疗所需的大量细胞。
质量稳定:与可能受年龄和疾病状态影响的骨髓MSCs相比,脂肪组织来源的细胞功能相对稳定。
04、为何使用“异体”而非“自体”AD-MSCs?
这是该策略的关键创新点之一:
规避患者自身MSCs的功能缺陷:研究表明,糖尿病患者自身的MSCs可能存在功能受损,表现出活力下降和促炎特征。使用有缺陷的自体细胞进行治疗,疗效可能大打折扣。
确保细胞质量与疗效:使用来自健康供体的异体AD-MSCs,可以确保输入的是具有完整免疫调节和组织修复功能的“强效”细胞,为治疗提供可靠的质量基础。
实现“现成”疗法:异体AD-MSCs可以提前从健康供体采集、制备、严格质检并冷冻保存,形成标准化、即用型的细胞产品。当患者被确诊时,能够立即开始治疗,无需等待漫长的自体细胞提取和培养过程,这在疾病早期干预窗口期至关重要。
二、这项1期临床试验是如何设计与实施的,以评估GXIPC1的安全性与初步疗效?
本研究是一项在越南单一中心开展的单臂、开放标签1期临床试验,旨在评估异体脂肪来源间充质干细胞产品GXIPC1的安全性与初步疗效。研究共纳入10名新近诊断(病程≤12个月)的1型糖尿病儿童患者,其核心入组标准包括存在至少一种胰岛自身抗体(如GAD抗体)且临床状况稳定(图1)。
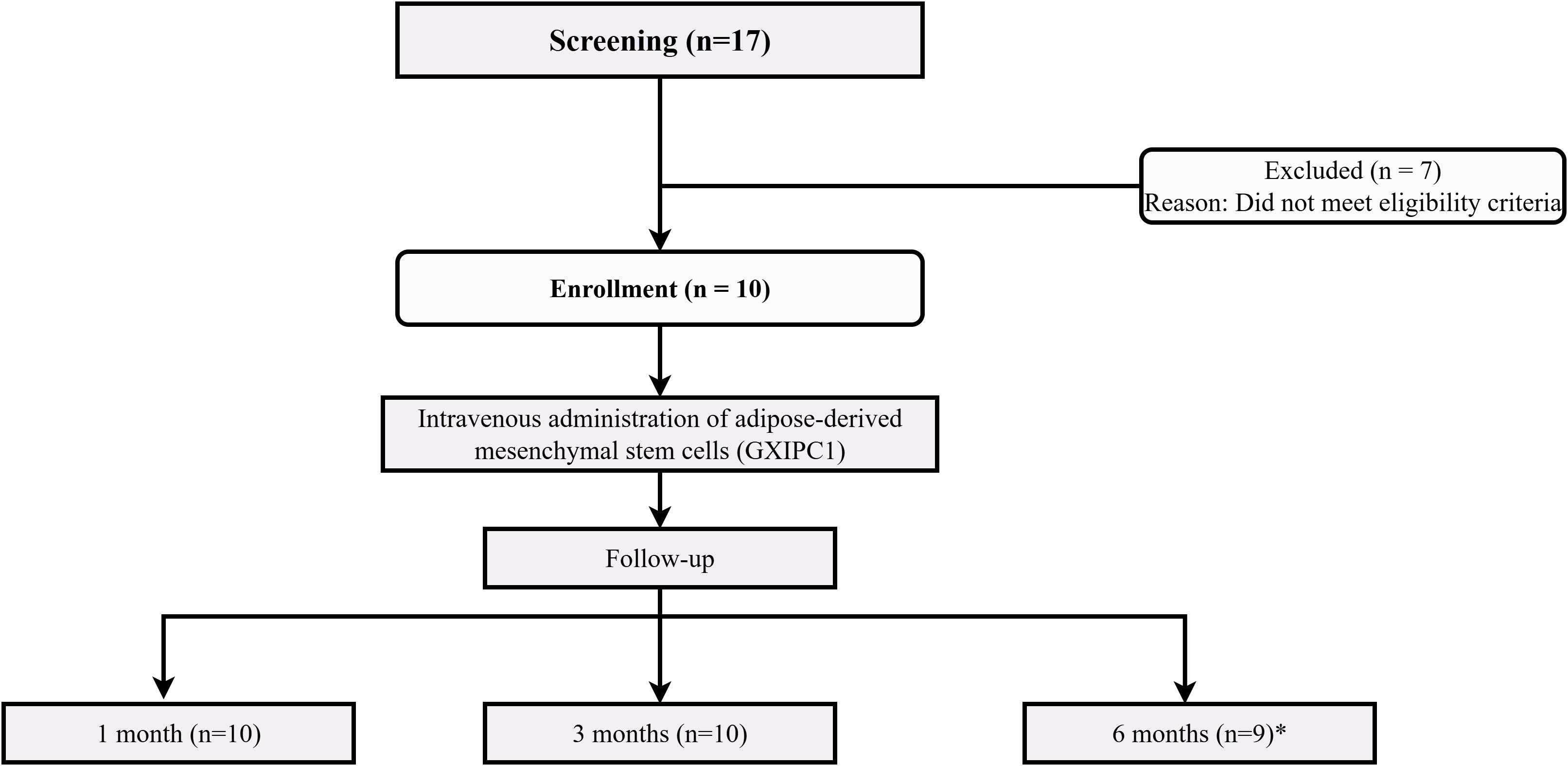
图1:CONSORT流程图展示了参与者的筛选、分配、干预和随访过程。共筛选了17名参与者,其中7名不符合入组标准。10名参与者被纳入研究并接受了静脉注射GXIPC1细胞治疗。分别在1个月、3个月和6个月时进行随访。1名患者因家属未回复而在6个月时失访。
表1展示了入组患者的基线特征。平均年龄为9.6±2.4岁(范围6-13岁),其中女性6例(60%),男性4例(40%)。基线时,空腹血糖中位数为15.3mmol/L,糖化血红蛋白(HbA1c)中位数为7.39%,C肽中位数为0.35ng/mL。这表明其胰岛功能已显著受损。严格的排除标准确保了入组患者无活动性感染、其他主要器官严重疾病或使用免疫抑制药物,从而尽可能减少干扰因素,专注于评估细胞治疗本身的效果。
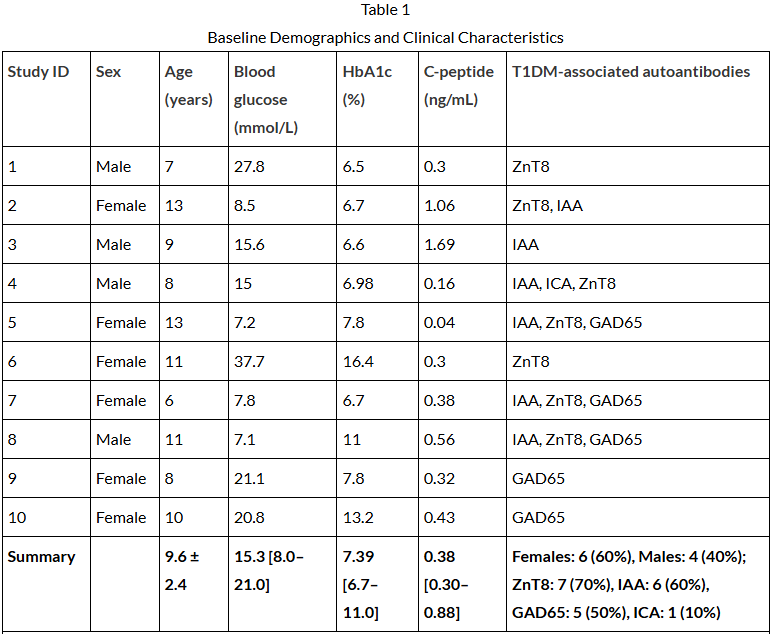
表1:基线人口统计学和临床特征
在干预措施方面,GXIPC1细胞来源于经严格筛查的健康供体脂肪组织,在符合药品生产质量管理规范(GMP)的条件下进行培养、扩增和冷冻保存(表2)。产品经过包括无菌性、活力和免疫表型在内的多重质控。冷冻细胞通过符合国际标准的冷链运输至临床中心,在输注前于床旁解冻、洗涤并重悬。
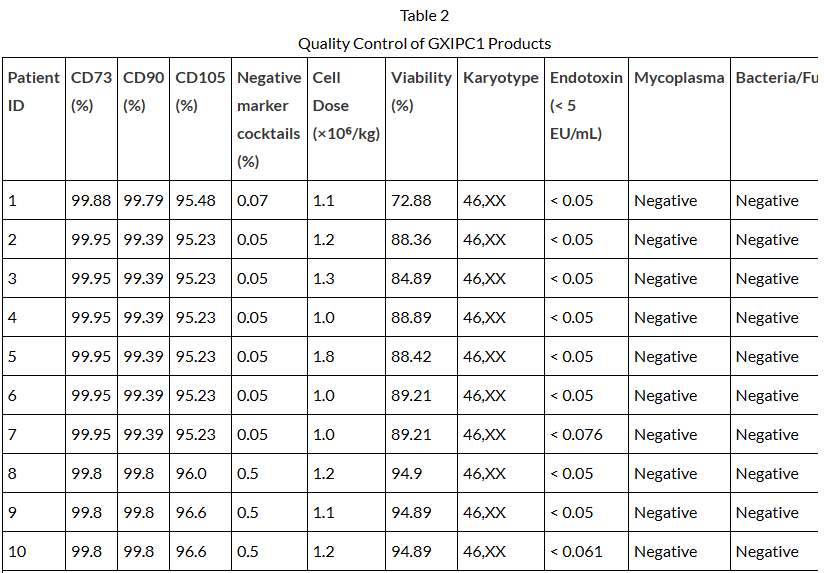
表2:GXIPC1产品的质量控制
所有受试者均接受单次静脉输注,剂量为每公斤体重1×10^6个细胞。主要研究终点为安全性,通过系统监测输注相关反应、不良事件、生命体征及系列实验室检查(如血常规、肝肾功能)进行全面评估。次要终点为初步疗效,重点观察输注后1、3、6个月时代谢控制的指标变化,包括糖化血红蛋白(HbA1c)水平、空腹血糖、反映内源性胰岛素分泌能力的空腹C肽水平以及每日外源性胰岛素需求量。
三、GXIPC1输注治疗新发1型糖尿病儿童的安全性及初步疗效结果如何?
05、安全性结果良好,耐受性优异
为期6个月的随访显示,GXIPC1输注表现出良好的安全性和耐受性。未发生任何严重不良事件(SAE)。所有报告的不良事件(共8例,发生率为60%)均为轻至中度,主要包括可自行缓解的轻度病毒性鼻炎和可通过调整胰岛素剂量控制的低血糖事件;这些事件均被评估为与GXIPC1产品不太可能相关(表3)。
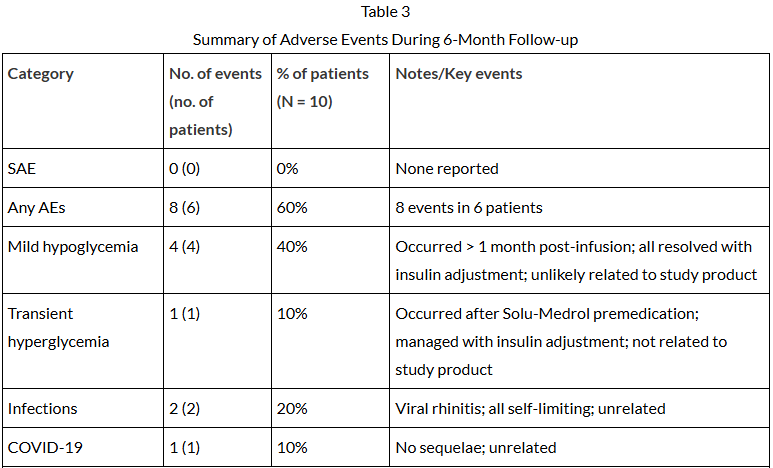
表3:6个月随访期间不良事件总结
此外,患者的生命体征及全面的实验室检查(包括肝肾功能、血常规等)在整个研究期间均保持稳定,未出现具有临床意义的异常。这些数据共同支持了单次输注异体脂肪来源间充质干细胞的安全性。
06、代谢控制与β细胞功能呈现积极信号
在初步疗效方面,研究观察到了一些积极的代谢改善趋势。血糖控制指标显示,糖化血红蛋白(HbA1c)中位数在输注后3个月内保持相对稳定(基线7.39%,3个月时7.41%),且有30%的患者在6个月时HbA1c低于基线。
空腹血糖方面:基线时,空腹血糖中位数为15.3mmol/降至1个月的5.8mmol/L。3个月和6个月时,空腹血糖中位数分别为8.1mmol/L和7.9mmol/L。大多数患者在1个月时血糖水平显著改善,并在随后的随访中观察到疗效持续。
尽管所有患者的空腹C肽水平(反映β细胞自身分泌胰岛素的能力)在基线时已处于低位,但在6个月的随访期内保持了相对稳定,提示残余的β细胞功能可能得到了某种程度的维持,未出现疾病的快速进展。
07、胰岛素需求显著降低,但疗效持续性需探索
最令人鼓舞的疗效信号体现在外源性胰岛素需求的变化上。患者每日胰岛素需求的中位剂量从基线时的22.5IU/天显著下降至3个月时的12.5IU/天(每日胰岛素需求量减少了 44%)。尤为突出的是,一名患者在输注后3个月实现了完全的“胰岛素非依赖”并得以维持,这为疾病缓解提供了直接证据。
然而,到6个月时,整体胰岛素需求的中位剂量有回升趋势(23IU/天),同时HbA1c水平也有所上升。这提示GXIPC1单次治疗可能产生了具有临床意义的短期疗效,但其效果的持续性可能有限,未来需要通过优化治疗方案(如重复输注)来探索能否实现长期稳定的疾病修饰。
四、如何解读这些发现?这项研究的局限性与未来方向是什么?
08、研究发现:安全性可靠,短期疗效信号积极
本研究数据显示,单次输注异体脂肪来源间充质干细胞(GXIPC1)在新近诊断的儿童1型糖尿病患者中展现出明确的安全性与值得关注的疗效信号。
安全性方面,治疗相关不良事件均为轻中度且可控,发生率为60%,最常见为可通过调整胰岛素剂量管理的轻度低血糖(40%),这与Izadi等人(2021)和ProTrans研究(2022)报道的间充质干细胞治疗良好安全性特征一致。
疗效方面,代谢指标呈现积极变化:糖化血红蛋白中位数在3个月内保持稳定(基线7.39%,3个月7.41%),空腹血糖在1个月时显著改善(从15.3mmol/L降至5.8mmol/L)。
最具提示性的信号来自β细胞功能与外源性胰岛素需求:尽管空腹C肽水平普遍较低,但在3个月时其中位数从基线的0.35ng/mL维持于0.26ng/mL,显示残余功能可能得到维持;与此同时,每日胰岛素剂量中位数在3个月时显著降低44%(从22.5IU/天降至12.5IU/天),且一名患者在3个月后实现并维持了胰岛素非依赖。
这些发现与Habiba等人(2024)荟萃分析中“部分患者实现C肽升高与暂时性胰岛素非依赖”的结果相印证,其潜在机制可能与AD-MSCs分泌的免疫调节因子(如IL-10、TGF-β)和营养因子(如VEGF、IGF-1)保护了残余β细胞并改善了胰岛素敏感性有关。
09、研究局限:样本与设计限制结论的确定性
然而,研究存在若干关键局限性,影响了对疗效强度和持久性的判定。首先,样本量极小(n=10)且为单中心研究,限制了结果的统计效力和外推性。其次,研究设计为单臂开放标签,缺乏随机双盲对照,无法排除安慰剂效应或疾病自然病程(如“蜜月期”)对观察结果的干扰。
最重要的是,疗效信号在6个月时呈现减弱趋势:糖化血红蛋白中位数回升至8.27%,每日胰岛素需求中位数也回升至23IU/天,仅30%的患者糖化血红蛋白低于基线。这提示单次输注产生的免疫调节或旁分泌效应可能是暂时的,与Hwang等人(2019)提出的“MSCs作用时间窗口期”概念相符。较短的6个月随访期不足以评估长期安全性及疗效的真正持续性。
10、未来方向:迈向优化方案的对照临床试验
基于上述“疗效随时间减弱”的数据模式及作用机制,未来的研究核心应聚焦于探索优化给药策略以维持和增强疗效。明确的下一步是开展更大规模、随机双盲、安慰剂对照的II期临床试验。此类试验应纳入足够的样本量,并将随访期延长至至少12-24个月,以确证疗效并评估长期安全性。
关键研究问题应包括:重复输注(如在3个月或6个月时加强)能否使代谢获益维持更久?不同剂量或给药途径(如胰腺动脉局部输注)能否提升效果? 通过解答这些问题,才能为将这种有前景的疾病修饰疗法转化为稳定、可靠的临床治疗方案奠定坚实基础。
结论
总之,这项I期临床试验初步证实,异体AD-MSC产品GXIPC1在改善近期发病的1型糖尿病患儿的血糖控制和保护残余β细胞功能方面安全有效。尽管这些发现支持异体AD-MSC疗法的生物学合理性和安全性,但仍需开展更大规模、更长时间随访的随机对照II期研究,以验证其疗效、优化给药方案并确定代谢获益的长期持久性。
参考资料:[1]: Liem T. Nguyen, Hoan T. Nguyen, Kien T. Nguyen 等. 静脉注射异体脂肪间充质干细胞 (GXIPC1) 治疗 1 型糖尿病患者的安全性和初步疗效:一项 1 期单臂开放标签临床试验,2026 年 1 月 15 日,预印本(版本 1)可在 Research Square 获取 [https://doi.org/10.21203/rs.3.rs-8189178/v1]
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


اترك تعليقاً