帕金森病(PD)是一种常见的进行性神经退行性慢性疾病,尤其在65岁以上人群中发病率约为12%。其主要病理特征为黑质致密部(SNc)多巴胺能(DAergic)神经元的选择性退化与丢失。目前,帕金森病尚缺乏有效且根治的治疗方法,加之中枢神经系统(CNS)自我修复能力有限,因此开发神经干细胞外泌体治疗帕金森病的新策略显得尤为迫切。
近年来,基于神经干细胞(NSCs)的治疗方法受到广泛关注。 NSCs可直接从多能干细胞(如胚胎干细胞、诱导多能干细胞及间充质干细胞)分化获得,具备增殖、自我更新及分化为神经元、星形胶质细胞、少突胶质细胞,尤其是多巴胺能神经元的能力。移植NSCs旨在促进内源性NSCs的增殖、存活、迁移与分化,或直接补充丢失的细胞,从而为帕金森病治疗提供可能。
成为治疗帕金森病的新希望!源自神经干细胞外泌体治疗帕金森病的新策略!
与此同时,外泌体疗法成为继NSCs疗法后另一重要研究方向。外泌体是直径为30至150纳米的细胞外囊泡,作为中枢神经系统微环境的关键组成部分,可通过传递蛋白质、脂质、RNA等生物活性分子介导细胞间通讯,参与免疫调节、细胞凋亡、神经可塑性等多种生理病理过程。
源自神经干细胞的外泌体,不仅继承了其母细胞的神经调节与修复潜能,还具备易穿越血脑屏障、免疫原性低、致瘤风险小等优势。因此,NSCs来源的外泌体被视为一种极具前景的治疗新策略,有望通过多途径协同作用,调节PD的病理微环境,保护并促进多巴胺能神经元的存活与功能恢复。
成为治疗帕金森病的新希望!源自神经干细胞外泌体治疗帕金森病的新策略!
2026年1月3号,知名期刊杂志《分子神经生物学》发表了一篇名为《源自神经干细胞的外泌体货物:帕金森病治疗的新策略》的研究综述。

综述系统梳理了帕金森病的病理特征、现有疗法局限,并深入探讨了神经干细胞疗法及外泌体治疗的潜在机制,进一步提出了NSCs外泌体可能提供更有效治疗途径的假设[1]。总体而言,神经干细胞及其外泌体为帕金森病等神经系统疾病的治疗开辟了具有前景的新方向,但将其真正应用于临床仍面临诸多挑战。
一、 神经干细胞:生物学特性、来源与治疗潜力
神经干细胞是一类存在于中枢神经系统内的未分化细胞,具有自我更新和多向分化潜能,能够分化为神经元、星形胶质细胞和少突胶质细胞(图1),是神经发育、维持及内源性修复的细胞基础。
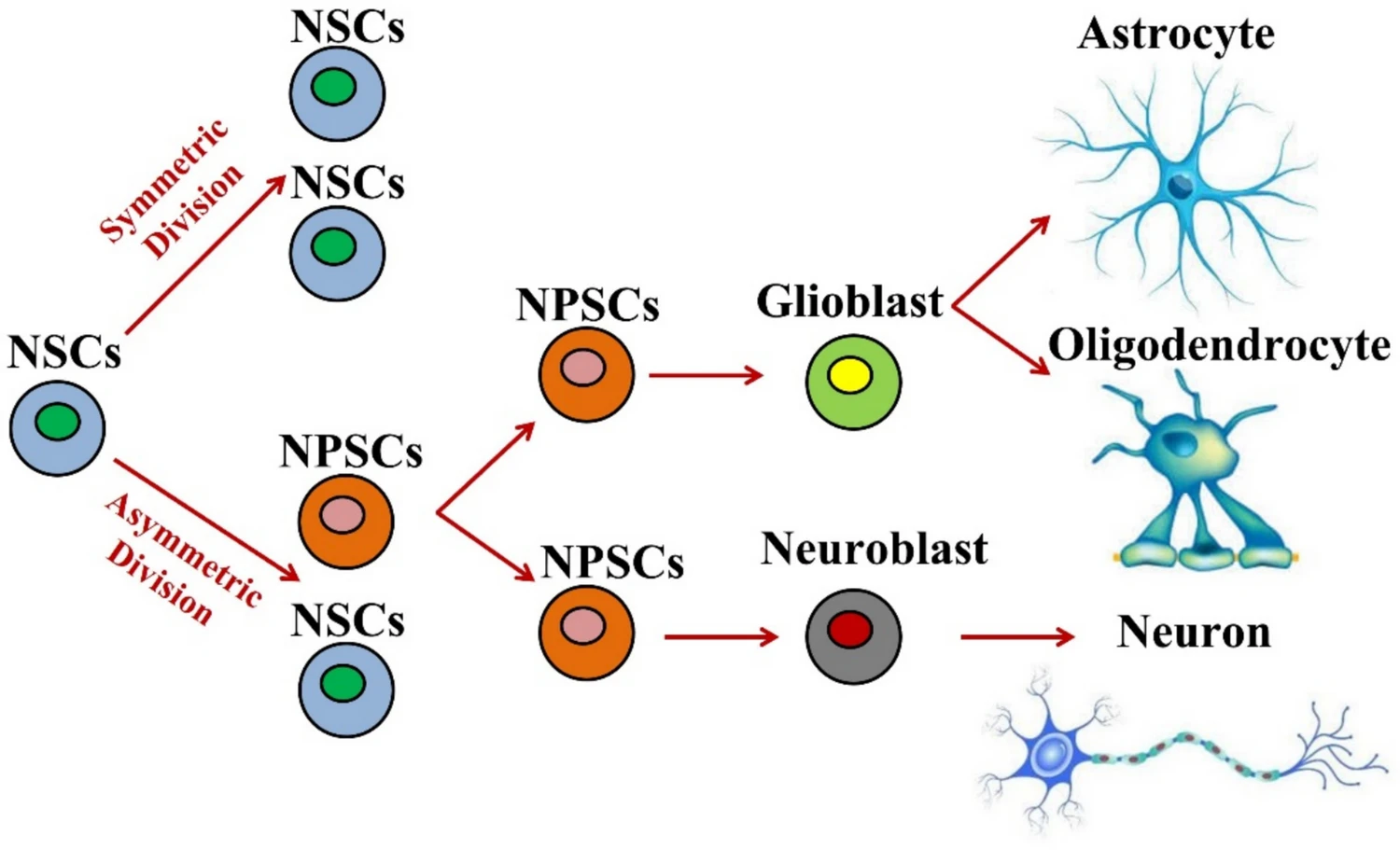
图1:神经干细胞自我更新和增殖途径的模型。神经干细胞具有自我更新能力,通过对称分裂维持细胞数量,并通过不对称分裂产生神经祖细胞(NPSC)。NPSC 也可分化为子细胞,但其分化能力仅限于神经元或胶质细胞。
神经干细胞主要有三大来源:从胎脑组织直接分离、由多能干细胞(如胚胎干细胞或诱导多能干细胞)定向分化、以及通过体细胞谱系重编程获得(图2)。其中,由多能干细胞分化而来的NSCs因其可扩展性及避免伦理争议而备受关注。例如,研究已成功将小鼠成纤维细胞转分化为NSCs,并进一步在体外诱导分化为成熟的神经细胞。
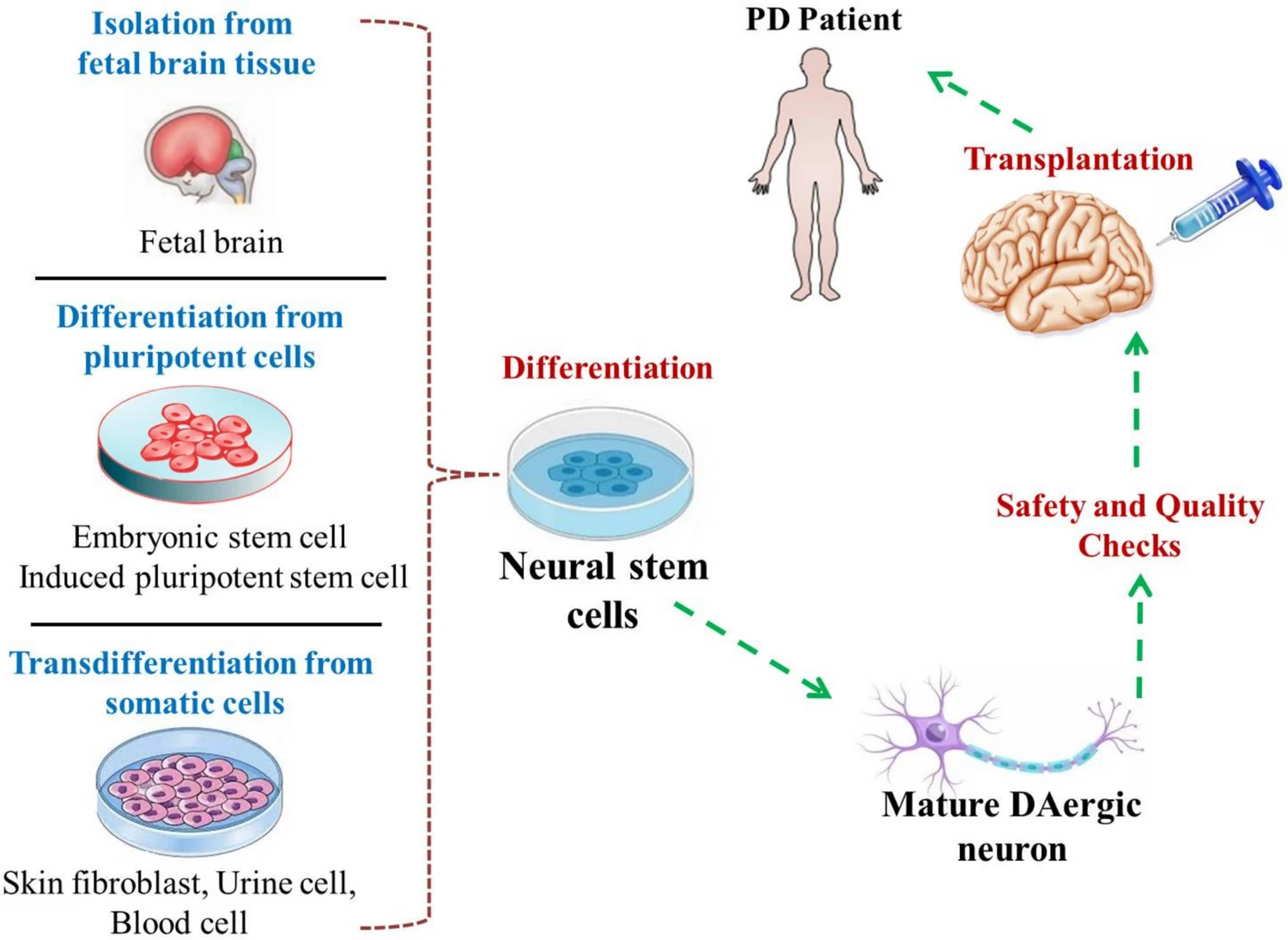
图2:图示为神经干细胞(NSCs)在帕金森病细胞治疗中的应用。NSCs是多能干细胞,其来源主要有三种:从胎儿脑组织中分离;多能干细胞和胚胎干细胞分化;以及成纤维细胞、尿液细胞和血细胞等体细胞分化。上述来源的NSCs可以大量扩增,然后分化为多巴胺能神经元,用于移植到帕金森病患者体内。
在治疗应用中,NSCs主要通过两种机制发挥作用:
- 一是细胞替代,即定向分化为多巴胺能神经元,直接补充丢失的细胞;
- 二是微环境调节,通过旁分泌作用释放神经营养因子、抗炎因子等生物活性物质,以支持残存神经元存活、抑制神经炎症、促进血管生成与突触可塑性。
研究表明,人源NSCs可分泌胶质细胞源性神经营养因子和脑源性神经营养因子,在疾病模型中支持运动神经元功能。其释放的抗炎因子还能抑制小胶质细胞过度活化,保护多巴胺能神经元。
二、 帕金森病:发病机制与现有治疗策略概述
帕金森病的典型病理特征包括黑质致密部多巴胺能神经元进行性丢失,以及神经元胞浆内出现以α-突触核蛋白为主要成分的路易体。其发病是遗传与环境多因素共同作用的结果,涉及线粒体功能障碍、氧化应激、神经炎症及异常蛋白聚集等复杂机制(图3)。
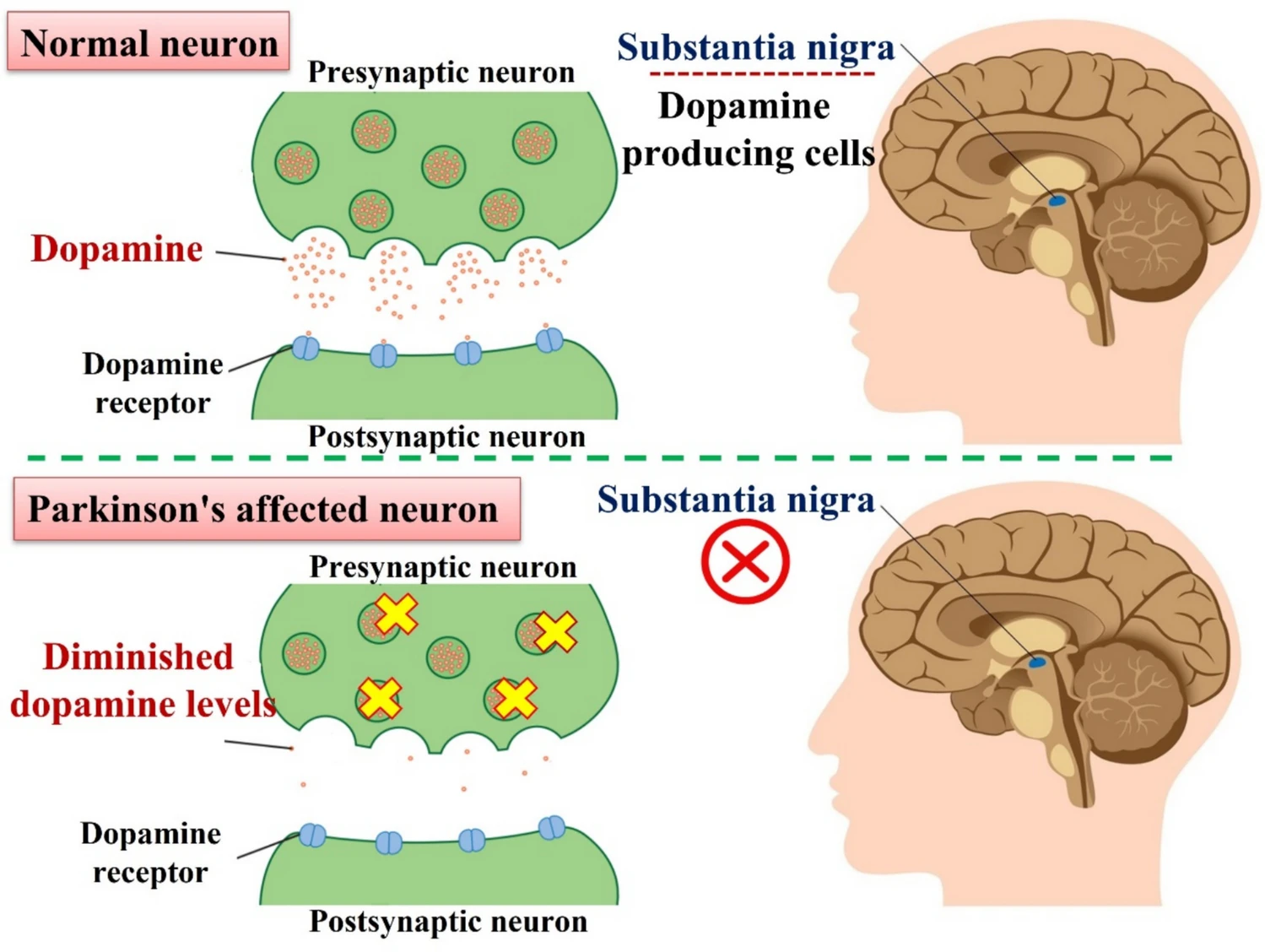
图3:帕金森病(PD)是中脑黑质多巴胺(DA)神经元退化的直接结果。 DA神经元产生多巴胺,这是一种负责与大脑其他神经元进行通讯的化学信使。这些神经元延伸至基底神经节(纹状体区域),该区域与运动控制和功能密切相关。因此,纹状体中多巴胺水平的降低会导致帕金森病患者常见的运动和非运动症状。
临床表现上,PD以运动症状为主,如静止性震颤、肌强直、运动迟缓和姿势平衡障碍。疾病后期常伴随多种非运动症状,包括认知障碍、抑郁、睡眠障碍、自主神经功能障碍等。
由于帕金森病目前仍被认为是一种无法治愈的疾病,因此已提出了多种治疗方法。目前,帕金森病的治疗策略包括药物干预、手术干预、基因治疗、非药物干预,以及基于干细胞的治疗和无细胞治疗等新兴方法(图4)。
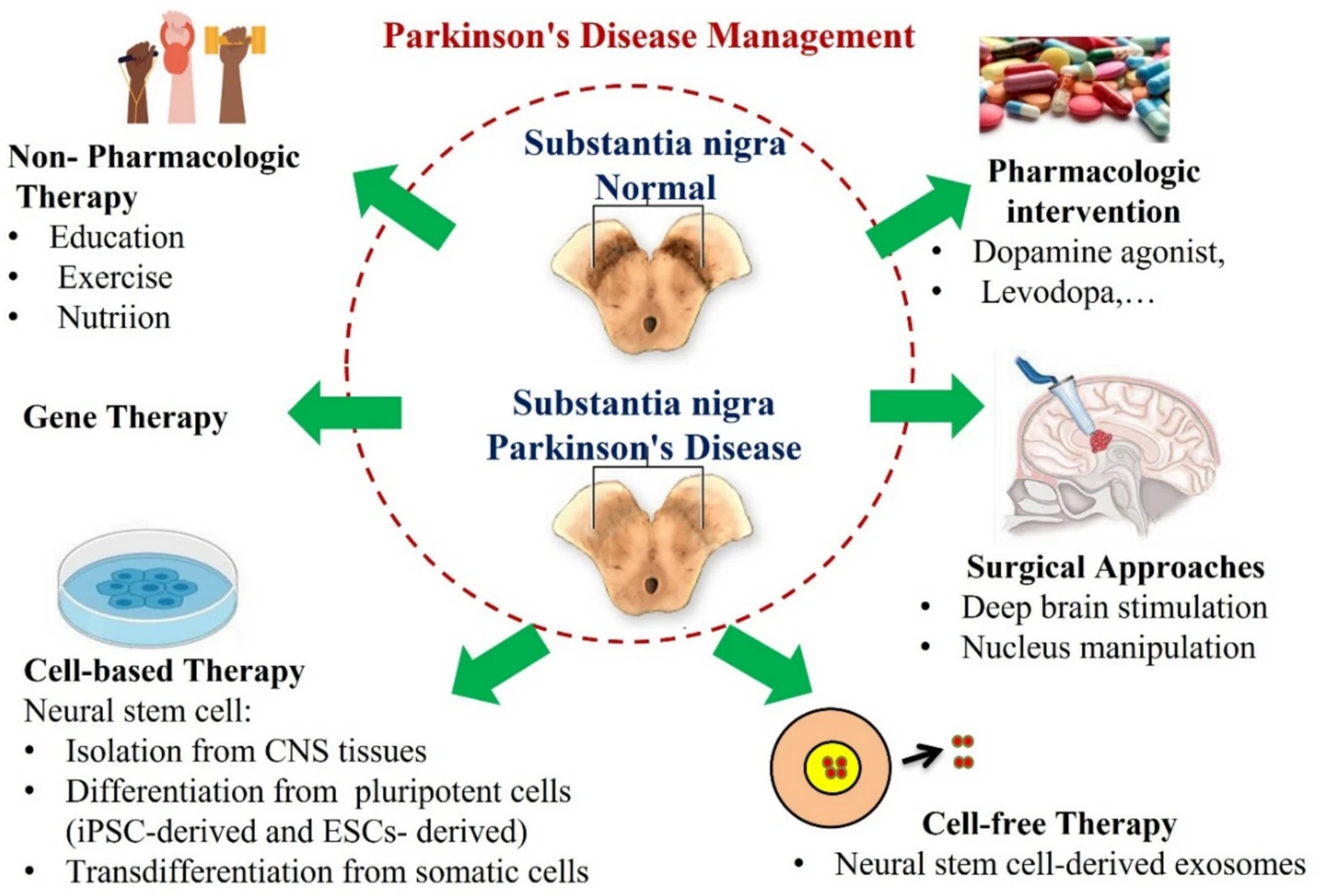
图4:帕金森病(PD)的治疗。黑质多巴胺能神经元的退化是PD的基本病理特征。
01、药物疗法:药物干预是目前帕金森病临床治疗的主要方法,其核心是通过多巴胺替代疗法来补偿患者脑内多巴胺的缺乏,从而缓解运动症状。常用药物包括多巴胺受体激动剂(直接刺激多巴胺受体)以及左旋多巴(多巴胺前体,需与外周脱羧酶抑制剂联用以确保其入脑转化)。这些药物能有效改善震颤、肌强直和运动迟缓,提高患者生活质量。
然而,药物治疗存在明显的局限性:其效果因人而异,仅能延缓疾病进展、控制症状而非根治;长期使用可能引发剂末现象、异动症等运动并发症,并伴有低血压、恶心、幻觉等多种副作用。因此,药物疗法通常作为基础性、症状性的管理手段。
02、手术疗法:当药物治疗效果减退或出现严重并发症时,手术干预成为一种重要的选择。目前最主要的手术方法是脑深部电刺激术,即在大脑特定核团(如丘脑底核)植入电极,通过持续高频电刺激来调节异常的神经环路,显著改善患者的运动症状和药物导致的运动波动。
此外,核团毁损术(如苍白球切开术)以及正在发展的磁共振引导聚焦超声等新技术,也为部分患者提供了治疗可能。手术疗法虽能有效缓解症状,但仍属于有创治疗,存在手术风险,且不能阻止疾病本身的神经退行性进程。
03、基因疗法:基因治疗代表了一种旨在改变疾病进程的潜在策略。其原理是通过病毒载体等递送系统,将特定的功能基因导入患者脑内,以期实现神经营养因子的长期表达、多巴胺合成相关酶的特异性补充或对致病蛋白的调控。这种方法理论上具有靶向性强、疗效持久、可能具备神经保护作用的优势。尽管目前基因疗法多数仍处于临床研究阶段,但其为从根本上干预帕金森病的病理机制提供了新的方向。
04、康复与辅助疗法:非药物治疗是帕金森病综合管理中不可或缺的部分。规律的体育锻炼(如有氧运动、平衡训练、太极等)已被证实能改善运动功能、平衡能力和生活质量,其机制可能与促进脑内多巴胺释放、减轻神经炎症、增强神经可塑性有关。此外,认知行为疗法、物理治疗、作业治疗、言语吞咽训练以及虚拟现实技术等,都能针对性地缓解特定的运动或非运动症状,与药物和手术疗法形成有效互补。
05、细胞与生物疗法:该领域包括基于细胞的治疗和无细胞治疗两大前沿方向。细胞治疗主要指干细胞移植,通过移植embryonic stem cell,induced pluripotent stem cell或mesenchymal stem cell MSC (in cell biology)等,旨在替代丢失的多巴胺能神经元或通过旁分泌作用提供神经保护、改善局部微环境。
然而,干细胞移植面临免疫排斥、致瘤风险、伦理争议及精准整合等挑战。近年来,“无细胞治疗”策略,特别是使用神经干细胞等来源的外泌体,受到了广泛关注。外泌体作为天然的信使囊泡,能够携带蛋白质、核酸等活性物质穿越血脑屏障,调节神经炎症、促进神经元存活与修复,且具有低免疫原性和高安全性潜力,为帕金森病的治疗提供了极具前景的新途径。
三、使用神经干细胞治疗帕金森病的优势和局限性与给药途径挑战
神经干细胞治疗帕金森病的主要优势在于其来源与功能的针对性。作为神经系统固有的前体细胞,神经干细胞与受损的脑组织具有相同的胚胎起源,这在一定程度上降低了免疫排斥的风险。
它们在体内外已被证实具有自我更新能力,并能分化为神经元和胶质细胞。更重要的是,移植后的神经干细胞展现出向大脑受损区域迁移的特性,能够定位到病变部位,从而为实现精准的细胞替代或局部微环境调节提供了可能。
然而,该疗法面临显著挑战:分化效率低,分化为功能成熟的多巴胺能神经元比例不高;功能整合困难;理想细胞来源受限;此外,给药途径本身也是一大技术瓶颈:
- 直接脑内注射(立体定位注射):将细胞悬液精准注射至纹状体或黑质,虽能确保局部定位,但具有侵入性,存在手术风险、局部炎症及细胞存活率不均等问题。
- 血管内注射(静脉/动脉):作为一种系统性、侵入性较低的方案,其瓶颈在于干细胞难以有效穿越血脑屏障,脑内递送效率极低。
- 鼻内给药:一种具有前景的无创途径,细胞可通过嗅神经和三叉神经通路绕过血脑屏障进入中枢,但其递送效率、定植量及长期命运仍需优化。
四、外泌体:生物学特征与递送优势
外泌体是由细胞主动分泌的一类具有脂质双分子层膜的纳米级细胞外囊泡,其直径通常在30至150纳米之间。
根据生物发生机制的不同,细胞外囊泡主要分为外泌体、微囊泡和凋亡小体三类,其中外泌体特指起源于细胞内吞途径的囊泡:其形成始于细胞膜内陷形成早期内体,随后内体膜进一步向内出芽生成腔内囊泡,转变为多囊泡体;最终,多囊泡体与细胞膜融合,将其腔内的囊泡以外泌体的形式释放到细胞外空间。这一精致的生物发生过程决定了其作为重要细胞间通讯载体的本质。
外泌体膜富含胆固醇、鞘磷脂及CD9、CD63、CD81等标志性蛋白,内部包裹着来源细胞特异的蛋白质、RNA、脂质等“货物”。
凭借纳米尺寸和脂质双分子层结构,外泌体能稳定存在于体液中,高效穿越blood-brain barrier,通过膜融合或内吞作用将内容物递送至受体细胞,从而精确调控靶细胞功能。在中枢神经系统中,外泌体是介导神经元、胶质细胞间通讯的关键信使,参与维持神经稳态、调节突触可塑性与免疫反应。
基于其低免疫原性、高生物相容性、良好的靶向性和低致瘤风险,外泌体被认为是极具潜力的“无细胞治疗”平台。在递送策略上,外泌体相较于活细胞展现出显著优势:
- 全身性给药(静脉注射):这是最常用的方式。外泌体能通过主动转运有效穿越血脑屏障,在脑内病灶区域富集,实现了无创系统性给药下的中枢靶向。
- 鼻内给药:同样适用,可实现无创、快速的中枢递送,避免全身首过效应,提高脑内生物利用度。
- 局部/鞘内注射:适用于需要高局部浓度的情形,或可与生物材料结合实现缓释。
五、 神经干细胞来源外泌体治疗帕金森病的多维度机制
NSCs来源的外泌体通过多重协同机制,在PD治疗中展现出广阔前景:
01、神经干细胞来源外泌体的抗炎与免疫调节机制
神经干细胞来源的外泌体在治疗帕金森病中,其核心机制之一是发挥强大的抗炎与免疫调节作用。在帕金森病的病理环境中,小胶质细胞和星形胶质细胞的过度激活会导致持续的神经炎症与氧化应激,加剧多巴胺能神经元的损伤。
这些外泌体能够通过其携带的多种免疫调节因子(如前列腺素E2、转化生长因子-β)及特定的微小RNA,促使小胶质细胞从促炎的M1表型向抗炎的M2表型转化。同时,它们能下调TNF-α、IL-1β等促炎细胞因子,上调IL-10等抗炎因子,从而有效抑制神经炎症,为神经元存活与修复创造有利的微环境。
02、神经干细胞来源外泌体的神经保护与抗凋亡机制
该疗法通过抑制神经元凋亡和减轻氧化应激,直接发挥神经保护作用。帕金森病中,多巴胺能神经元常因氧化应激和凋亡通路异常激活而死亡。
神经干细胞来源的外泌体能够向神经元递送抗氧化成分,降低细胞内活性氧水平。更重要的是,其富含的特定miRNA能激活细胞自噬流,例如高表达的miR-374-5p可通过增强自噬来清除受损的细胞成分,从而抑制凋亡程序的启动,增强神经元的存活能力。
03、神经干细胞来源外泌体促进内源性神经再生
除了直接保护现有神经元,这类外泌体还能刺激大脑内源性神经干/祖细胞的活性,促进神经再生。它们可作为关键的通讯载体,与海马体、室管膜下区等神经发生区域的微环境相互作用。
研究表明,它们能显著增加新生神经元的数量,并提升细胞的增殖与存活率。这一过程部分得益于其改善了神经干细胞所处的微环境,调节了星形胶质细胞、小胶质细胞等释放的因子平衡,从而将病理环境导向支持神经再生与分化的方向。
04、神经干细胞来源外泌体促进血管生成与血脑屏障修复
维持脑血管完整性和功能对神经修复至关重要。帕金森病等神经退行性疾病常伴有血脑屏障功能障碍。神经干细胞来源的外泌体含有高水平的血管内皮生长因子等促血管生成因子,能够促进脑血管内皮细胞的增殖与迁移,刺激新血管生成。
这不仅有助于改善受损脑区的血液供应和营养输送,还能增强血脑屏障的完整性,减少有害物质入脑,为大脑提供一个更稳定、支持性的内环境。
05、神经干细胞来源外泌体作为递送治疗性物质的载体
此外,神经干细胞来源的外泌体本身是一种极佳的生物活性物质递送系统。它们可以天然携带或经工程化改造后装载神经营养因子、酶、mRNA或治疗性miRNA等“货物”。
exist帕金森病模型中,甚至已有研究使用载有多巴胺的外泌体进行递送,在发挥治疗效果的同时降低了直接给药的毒性。这些外泌体能够穿越血脑屏障,精准地将治疗分子递送至目标神经元或胶质细胞,通过调节基因表达和蛋白质合成,实现多靶点的协同治疗。
六、 临床转化现状与挑战
目前,多项使用神经干细胞治疗帕金森病的临床试验正在进行中,初步探索了其安全性与可行性。
目前,关于使用神经干细胞治疗帕金森病的临床试验(见表1)在再生医学领域正在如火如荼地进行。但说到神经干细胞来源外泌体治疗的临床试验,目前仍然非常罕见,大部分还停留在实验室阶段,或者刚刚开始早期临床试验。

表1:神经干细胞疗法治疗帕金森病的临床试验
如前所述,神经干细胞来源的外泌体在神经退行性疾病治疗中可能非常有用。在这里,我们列出了几项关于使用神经干细胞来源外泌体治疗其他神经退行性疾病的研究(见表2)。
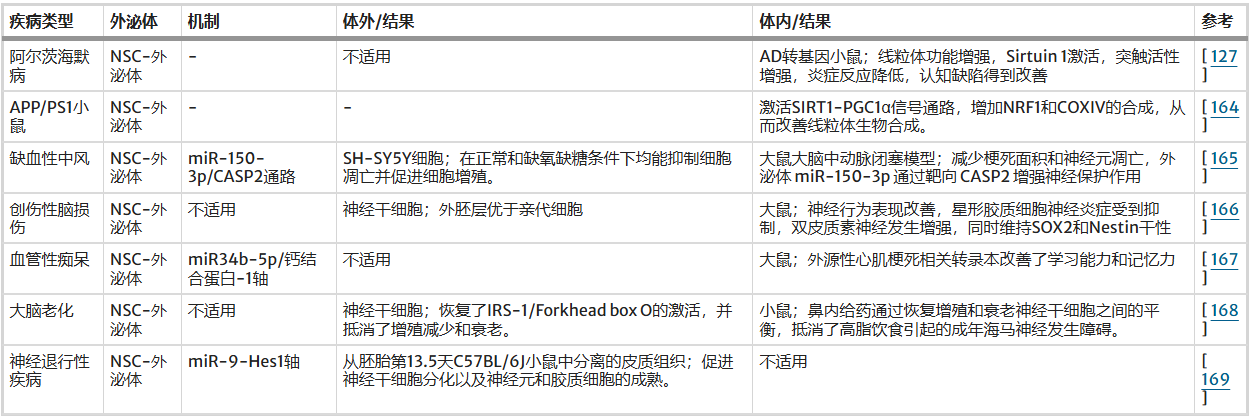
表2:神经干细胞来源的外泌体与其他神经退行性疾病
然而,关于神经干细胞来源外泌体治疗PD的临床研究仍非常有限,大多停留在临床前动物模型研究或早期探索阶段。不过,已有研究开始探索NSCs外泌体在其他神经退行性疾病(如阿尔茨海默病、脑卒中)模型中的应用,为其用于PD治疗提供了参考和依据。
reach a verdict
由于帕金森病(PD)的发病机制尚不明确,目前尚无根治方法。神经干细胞(NSCs)疗法被寄予厚望,有望实现这一目标,因为许多基于NSCs治疗PD动物模型的研究已显示出积极成果。宿主的适应性免疫反应是关键所在,它可能导致移植排斥。
目前仍需开展适当的临床研究,以获取更多信息,从而确定最佳的免疫抑制治疗方案,以预防这一问题。考虑到影响这一过程的诸多因素,如何制定一种能够提高移植细胞存活率并促进其多巴胺能分化的特异性免疫疗法,仍然是一项挑战。
尽管存在诸多挑战,但总体而言,NSCs疗法仍可能是一种合适的、有前景的PD治疗方法。目前细胞研究的进展以及无细胞疗法研究的成果,为PD的治疗提供了新的前景。
主要参考资料:[1] Tarbali, S., Dadkhah, M. & Payandeh, Z. 源自神经干细胞的外泌体货物:帕金森病治疗的新策略。Mol Neurobiol 63 , 339 (2026). https://doi.org/10.1007/s12035-025-05637-3
Disclaimer: This article is intended only to disseminate scientific knowledge and share industry perspectives, and does not constitute any clinical diagnostic advice! The information published by Hangi Stem Cells is not a substitute for the professional advice of a physician or pharmacist. If you have any questions about copyright or other issues, please feel free to contact me.
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有错误,请第一时间联系我们修改或删除,多谢。


Leave a Reply