中枢神经系统(CNS)疾病,如帕金森病、脊髓损伤与癫痫,因其神经细胞损伤或死亡后自我修复能力极低,一直是医学领域的重大治疗挑战。近年来,多能干细胞治疗中枢神经系统疾病的研究取得了令人瞩目的进展,为这些既往被认为不可逆的损伤提供了潜在的修复策略。人多能干细胞(hPSCs),包括人胚胎干细胞(hESCs)和诱导多能干细胞(iPSCs),具有无限自我更新和分化为任何细胞类型的潜能,使其成为再生医学领域理想的细胞来源。
本文旨在系统综述多能干细胞治疗中枢神经系统疾病在帕金森病、脊髓损伤与癫痫三大适应症中的最新临床研究进展,并探讨其作用机制、面临的挑战及未来发展方向。
1 干细胞治疗帕金森病:从替代到精准
帕金森病(Parkinson’s Disease, PD)作为一种常见的神经退行性疾病,其核心病理特征是中脑黑质多巴胺能神经元的选择性丧失,导致纹状体多巴胺不足而引起运动症状。全球PD患者人数众多,且随着人口老龄化加剧,其发病率呈上升趋势。当前的治疗方法主要以左旋多巴为代表的药物缓解症状,但长期使用会导致疗效减退和运动并发症等局限性。因此,干细胞替代治疗作为一种潜在疾病修饰策略,旨在重建受损的神经环路,为PD患者带来新的希望。
1.1 多能干细胞治疗中枢神经系统疾病的策略与演变
自20世纪80年代末以来,研究人员就开始尝试通过脑内移植人类胎儿中脑组织来替代PD患者脑中丢失的多巴胺能神经元。这些开创性研究证实了细胞替代治疗PD的概念可行性——移植的胎儿多巴胺能神经元能够在患者脑内存活、整合并改善运动功能。然而,胎儿组织移植存在来源有限、异质性强及伦理争议等突出问题,限制了其临床推广应用。
人多能干细胞(human pluripotent stem cells, hPSCs)技术,包括人胚胎干细胞(human embryonic stem cells, hESCs)和人诱导多能干细胞(human induced pluripotent stem cells, hiPSCs)的发展,为PD的细胞治疗提供了标准化、规模化的细胞来源。过去十年中,研究人员已建立了多种将hPSCs高效分化为中脑多巴胺能神经元前体细胞(dopaminergic progenitor cells, DAPs)的方案,这些细胞在移植到PD动物模型脑后能够成熟为功能性的多巴胺能神经元,整合到宿主神经环路中,并显着改善动物的运动行为缺陷。
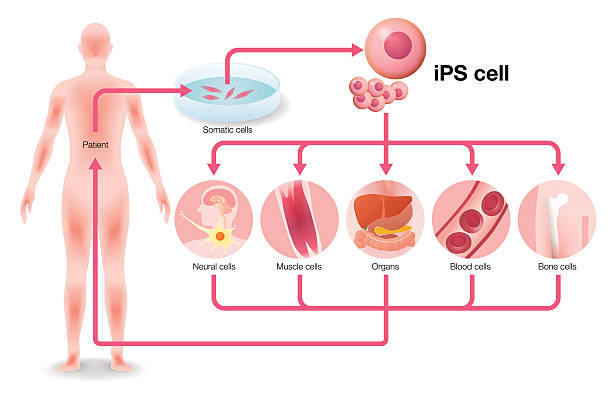
1.2 干细胞治疗帕金森病的早期临床试验
首个针对PD的人胚胎干细胞(hESC)临床试验于2015年在中国启动(NCT03119636),共为24名患者移植了DA前体细胞,但尚未公布临床结果。随后,澳大利亚的国际干细胞公司(ISCO)于2016年开展了以孤雌生殖干细胞(hpESCs)为基础的试验,并于2021年达到主要安全性终点,但公司并未公布后续临床计划。该试验因使用了一种“通用型神经干细胞(NSC)”产品而受到质疑——其作用机理被认为是通过营养因子支持保护内源DA神经元免于凋亡,而非真正恢复多巴胺功能。

国际干细胞公司宣布其帕金森病一期临床试验成功完成
研究方向随后转向更高分辨率、更精准的产品,即基于人多能干细胞(hPSC)分化的中脑DA前体细胞。日本京都大学iPS细胞研究中心(CiRA)的高桥淳(Jun Takahashi)团队开发了首个进入PD临床试验的人诱导多能干细胞(hiPSC)产品。该产品来自具有HLA单倍型的同种异体hiPSC系,并经CORIN表面标志纯化,代表中脑底板前体细胞谱系。试验于2018年启动,共7例患者,结果显示良好的安全性,并在部分患者中观察到中度改善(高桥淳个人通信)。该产品现由日本住友制药(Sumitomo Pharma)与学术机构合作,在美国继续推进临床研究。

基于诱导多能干细胞的帕金森病疗法:京都试验
1.2 近年来多能干细胞治疗帕金森病的全球临床研究进展
近年来,基于hPSCs的PD细胞治疗已从临床前研究逐步走向临床评估。 2025年发表在《自然》杂志上的两项独立临床试验为这一领域提供了令人鼓舞的安全性和初步有效性数据。
日本京都大学团队开展了一项I/II期临床试验,为7名50-69岁的PD患者移植了由hiPSCs分化而来的多巴胺能前体细胞。在24个月的随访期内,未报告严重副作用,移植的细胞产生了多巴胺,且没有过度生长或形成肿瘤——这是干细胞疗法的一种潜在风险。特别值得注意的是,在继续参与试验并进行有效性评估的6位患者中,4位在未服用标准药物的情况下帕金森病相关运动症状减少,5位在服药期间观察到相关运动症状减少。

帕金森病iPS细胞衍生多巴胺能细胞的I/II期临床试验
另一项由美国纪念斯隆-凯特琳癌症中心团队在2025年进行的I期临床试验,评估了来自人胚胎干细胞的多巴胺能前体细胞产品(bemdaneprocel)的安全性。12名中位年龄为67岁的患者接受了将该产品移植到双侧大脑壳核的手术。结果显示,细胞产品耐受性普遍良好,在18个月的随访中未报告与治疗相关的严重副作用,也没有出现运动障碍的迹象。研究团队在低剂量和高剂量组均观察到了不同程度的运动功能改善。公司已宣布即将启动Ⅱ期研究。

利用人胚胎干细胞衍生的多巴胺能神经元治疗帕金森病的I期临床试验
同样,韩国S.Biomedics公司于2023年开展hESC试验(NCT05887466),在2024年公布结果表明在3名高剂量患者中观察到12个月时PD症状下降25%–44%。

S.BIOMEDICS公司研发的用于治疗帕金森病的TED-A9细胞疗法在1/2a期临床试验中12个月时显示出积极数据
2022年,瑞典隆德大学医院(Skåne University Hospital)由Malin Parmar与Roger Barker领导的团队也在2022年启动了名为STEM-PD的临床试验(NCT05635409)。这些在美、日、瑞、韩的研究均采用16–28天的短程定向分化体系。

STEM-PD临床试验最新进展——基于干细胞的帕金森病移植
此外,中国的iRegene Therapeutics(艾瑞基因)开发了化学诱导型同种异体hiPSC产品 NouvNeu001,于2024年1月在中国启动临床,并于同年6月获得FDA批准在美国开展试验。
PD研究的成功也推动了自体细胞治疗的发展。
2017年,美国波士顿麦克莱恩医院(McLean Hospital)的一名患者成为全球第二个接受自体hiPSC移植的PD患者(单例扩展准入研究,领导者Kwang-Soo Kim团队)。术后12个月PET成像显示移植物存活迹象。
2023年,该团队获得FDA批准,将自体DA细胞移植扩大至8名患者(NCT06687837)。同年,FDA又批准了两项基于自体hiPSCs的PD试验:一项为Aspen Neuroscience公司的ANPD001项目(首例患者于2024年春季接受移植),另一项由麦克莱恩医院Penelope Hallett团队开展(NCT06422208),已完成两例移植。
这些研究首次在较大样本的临床试验中证实了hPSC来源的多巴胺能前体细胞在PD患者中的安全性和耐受性,为后续更大规模的临床试验奠定了基础。不过,研究人员也强调,仍需进一步研究来测试这些疗法的有效性和临床获益。
除了传统的细胞替代策略,创新性的给药方式和制剂策略也在不断涌现。例如,2025年10月发表的一项临床前研究探索了通过鼻内递送牙髓干细胞来源的小细胞外囊泡(sEV)包裹根皮苷(sEV-Phl)治疗PD的新策略。这种策略在慢性MPTP PD大鼠模型中显示出能够显著改善运动和认知功能,增加黑质中酪氨酸羟化酶(TH)阳性神经元数量,并减少神经炎症。这种无创、靶向的给药方式为PD治疗提供了新的思路。
目前,全球共13项经批准的PD干细胞试验正在进行,未来2–3年,当移植物成熟后,将获得关键疗效数据。
2 干细胞治疗脊髓损伤:再生修复的新希望
脊髓损伤(Spinal Cord Injury, SCI)是中枢神经系统的严重创伤性疾病,全球患者约1500万,我国患者超过300万,且每年新增约10万急性/亚急性病例。脊髓损伤多见于青壮年,常由交通事故、运动损伤等引起,具有高致残率、不可逆性和年轻化等特点,给患者家庭和社会带来沉重负担。
2.1 病理挑战与治疗策略
脊髓损伤后,受损轴突的再生能力极其有限,部分原因是损伤部位形成的抑制性微环境以及髓鞘形成细胞——少突胶质细胞的丧失。因此,促进轴突再生和再髓鞘化成为脊髓损伤修复的关键策略。
干细胞治疗通过替代丢失的细胞类型、提供神经营养支持及调制损伤后炎症反应等多种机制促进脊髓损伤修复。其中,人多能干细胞来源的少突胶质前体细胞(oligodendrocyte progenitor cells, OPCs)和神经前体细胞(neural progenitor cells, NPCs)是主要的研究方向。
2.2 多能干细胞治疗脊髓损伤的临床转化与进展
脊髓损伤后,髓鞘形成的少突胶质细胞丧失,导致轴突失去保护与营养支持。因此,替代少突胶质细胞可能有助于促进轴突修复与功能恢复。近年来,脊髓损伤的干细胞治疗取得了突破性进展,特别是在诱导多能干细胞(iPSC)衍生细胞治疗领域。
2010年,该产品获得FDA批准进入临床,成为全球首个进入人体的hPSC产品。首项I期研究(NCT01217008)共5例急性胸段损伤患者,10年安全性随访显示治疗耐受良好,无严重不良事件或肿瘤形成,但疗效有限,可能与剂量偏低有关。Geron于2011年终止该项目,随后技术转移至Asterias Biotherapeutics并改名为AST-OPC1,于2015年在颈髓损伤患者中启动I/II期剂量递增试验(NCT02302157)。
结果显示,大多数患者(96%)恢复了至少一侧身体的一个或多个神经节段功能,32%恢复了两个或以上功能水平,安全性良好。由于样本量有限,疗效归因尚不明确。Asterias后被BioTime公司收购并更名为Lineage Cell Therapeutics,产品亦改称LCT-OPC1。
此外,日本庆应义塾大学与韩国S.Biomedics也分别开展了基于hPSC来源神经干/前体细胞的脊髓损伤试验。两者的作用机制均是通过分泌神经营养因子促进修复与再髓鞘化。韩国项目采用hESC来源PSA-NCAM+神经前体细胞鞘内注射,尚无公布数据。庆应大学冈野英之(Hideyuki Okano)团队则在完全性颈/胸段急性脊髓损伤患者中移植hiPSC来源NSCs(每例200万细胞),目前4例受试者均未报告严重不良事件(冈野英之个人通信)。

首次人体临床试验:移植诱导多能干细胞来源的神经干细胞/祖细胞治疗亚急性完全性脊髓损伤:研究方案首次人体临床试验:移植诱导多能干细胞来源的神经干细胞/祖细胞治疗亚急性完全性脊髓损伤:研究方案
2025年,全球首个异体通用型”现货型”iPSC衍生亚型神经细胞新药注册临床试验正式通过中国国家药品监督管理局(NMPA)与美国食品药品监督管理局(FDA)的中美双报审批,且均获一次性无发补完全批准,用于脊髓损伤的治疗。这一里程碑事件标志着我国在再生医学领域的创新实力和国际领先地位。
该临床试验由中山大学附属第三医院戎利民教授和大连医科大学附属第一医院刘晶教授共同牵头,于2025年7月正式启动。这款iPSC衍生亚型神经细胞药物具有三大创新特点:
- 一是”现货型“供应,利用iPSC技术将普通体细胞重编程为具有胚胎干细胞特性的细胞,再定向分化为特定神经前体细胞,标准化制备的细胞制剂可随时调用,不必为患者单独定制;
- 二是精准神经修复,与传统干细胞疗法不同,该药物靶向再生脊髓区的亚型特化神经细胞,能更精准地整合到损伤部位,重建神经信号传导通路;
- 三是中美双认证质控,依托全流程质控体系,细胞产品同时满足中、美药品生产规范,为全球应用铺平道路。
2025年7月,这一全球首款iPSC再生脊髓神经细胞新药(XS228细胞注射液)治疗脊髓损伤的注册临床I期研究成功完成全球首例受试者给药。据报道,首例受试者接受临床级iPS再生脊髓神经细胞移植后,无手术及围术期的并发症或其他不良安全事件,各项检测指标正常,平稳度过观察期并进入正式随访期。这一成功案例为全球中枢神经损伤修复领域树立了重要里程碑。
除了iPSC来源的细胞产品,其他类型的干细胞也在脊髓损伤治疗中展现出潜力。例如,美国Lineage Cell Therapeutics公司开发的人胚胎干细胞来源的少突胶质前体细胞产品(LCT-OPC1)在颈髓损伤患者中进行的I/II期剂量递增试验显示,大多数患者(96%)恢复了至少一侧身体的一个或多个神经节段功能,32%恢复了两个或以上功能水平,且安全性良好。
3 干细胞治疗癫痫:调控神经环路的新策略
癫痫是一种常见的慢性神经系统疾病,全球患者约6500万,其中约38%的患者使用传统抗癫痫药物仍无法有效控制发作,发展为药物难治性癫痫。这些患者不仅面临反复癫痫发作的困扰,还常伴有记忆衰退等认知功能障碍,迫切需要新的治疗策略。
3.1 病理基础与治疗新思路
癫痫发作的核心机制是大脑神经元兴奋性与抑制性平衡失调,导致异常同步放电。特别是在颞叶癫痫中,海马区抑制性中间神经元(如GABA能神经元)的丢失或功能异常是导致网络兴奋性增高的重要因素。
基于这一认识,干细胞治疗癫痫的策略主要集中在修复受损的抑制性神经环路上,即通过移植抑制性中间神经元或能够分泌抗癫痫因子的细胞,重建正常的兴奋-抑制平衡。
3.2 临床前研究与临床探索
近年来,干细胞治疗癫痫领域取得了多项突破性进展。2025年1月,梅奥诊所宣布参与首个再生疗法治疗耐药性癫痫的人体研究。这项多中心研究测试的是将中间神经元移植到癫痫患者的海马体中,旨在恢复正常的兴奋-抑制平衡。
梅奥诊所的Jonathon J. Parker博士解释道:”这项工作有潜力重写癫痫的治疗路径。从基础层面看,反复癫痫发作后,海马区中间神经元常常丢失。我们希望通过替换这些抑制性细胞来恢复正常的兴奋平衡,减少甚至消除癫痫发作。”
另一项值得关注的进展是间充质干细胞外泌体的经鼻给药策略。2025年4月,美国得克萨斯农工大学团队在《PNAS》上发表的研究表明,通过鼻腔滴注干细胞外泌体,可实现对癫痫病灶的多维度修复。研究采用毛果芸香碱诱导的癫痫小鼠模型,发现经鼻滴注的干细胞外泌体可在6小时内跨越血脑屏障,精准抵达海马区病灶,并持续释放活性成分72小时。
这种靶向递送方式绕过了首过效应,显着提高了生物利用度,并通过三重机制发挥治疗作用:一是炎症调控,通过抑制NF-κB通路,使关键促炎因子TNF-α水平降低58%,同时激活IL-10等保护性因子;二是神经元保护,海马CA1区锥体细胞死亡率降低30%,抑制性中间神经元保留率提高47%;三是神经再生,慢性期(6周后)海马齿状回新生神经元数量增加2.8倍,异常迁移减少62%,同时改善空间记忆和认知能力。
目前,间充质干细胞外泌体治疗癫痫的Ⅰ/Ⅱ期临床试验已开展(NCT04388982),初步结果显示其安全性良好。类似的鼻内给药策略在阿尔茨海默病等中枢神经系统疾病中也展现出潜力,为药物难治性癫痫患者提供了新的希望。
4.多能干细胞治疗其它中枢神经系统疾病的临床研究进展
其他针对CNS的临床研究还包括:
-
以色列KadimaStem公司于2018年启动的ALS(肌萎缩侧索硬化症)试验,将hESC来源星形胶质细胞(AstroRx)鞘内注射至患者脊髓。 10名患者接受两种剂量治疗,术后3个月病程进展减缓,但12个月时未见显着改善。
-
斯坦福大学于2021年开展的缺血性皮质下中风研究,使用H9系hESC来源NSCs产品;2023年公布的中期数据表明,在首批6例患者中,6个月时耐受性良好。
-
加州大学欧文分校(UCI)的Leslie Thompson团队开发的亨廷顿病NSC疗法已于2024年获得FDA批准进入临床(L. Thompson个人通信)。虽然临床尚未开始,但动物实验显示,该细胞可减少突变型亨廷顿蛋白积聚并增强神经营养因子分泌,有助于支持内源性神经元的存活与修复。
5. 挑战与未来方向
尽管多能干细胞治疗中枢神经系统疾病取得了令人鼓舞的进展,但从实验室走向广泛的临床应用仍面临诸多挑战。
5.1 科学挑战
细胞存活与整合效率:是影响治疗效果的关键因素。移植后的细胞需要在损伤环境中存活,并有效地整合到宿主神经网络中,才能发挥功能。研究表明,在PD动物模型中,只有约5-20%的移植多巴胺能神经元能够存活,这提示我们需要进一步优化细胞制备和移植策略。
肿瘤形成风险:是hPSCs衍生细胞治疗必须面对的安全问题。未分化的多能干细胞或增殖能力强的前体细胞可能在移植后形成肿瘤。因此,开发高效的分化方案和细胞纯化策略,确保细胞产品的均一性和稳定性,是降低肿瘤风险的关键。
免疫排斥反应:同样不容忽视。尽管大脑被认为是免疫豁免器官,但移植的异体细胞仍可能引发免疫反应,影响细胞存活和功能。目前,大多数临床试验使用免疫抑制剂来控制排斥反应,但长期免疫抑制可能带来感染和肿瘤等风险。使用患者特异性iPSCs(自体移植)或建立HLA配型的干细胞库是解决免疫排斥的潜在策略。
5.2 技术与监管瓶颈
在生产工艺方面,从科研级走向临床级的细胞产品生产需要建立稳定、可控、可扩展的制造工艺。细胞产品的质量属性必须得到精确鉴定和控制,确保不同批次间的一致性和稳定性。
移植策略的标准化也至关重要。包括细胞剂量、移植轨迹、注射速度等多个参数都需要系统优化,以最大程度提高细胞存活并减少手术相关损伤。
在监管层面,干细胞产品作为活的药物,其监管框架相较于传统药物更为复杂。监管机构需要制定适应细胞产品特点的审评标准,平衡创新产品的加速审批和风险控制。
5.3 未来展望
面对这些挑战,多能干细胞治疗中枢神经系统疾病的未来发展可能呈现以下趋势:
- 一是走向精准医疗与个体化治疗。随着iPSC技术和基因编辑技术的发展,未来可能实现基于患者特定遗传背景的个体化细胞治疗,特别是对于遗传性神经系统疾病。
- 二是联合治疗策略的应用。干细胞可能与基因治疗、生物材料、物理治疗等多种策略相结合,协同促进神经修复。例如,将干细胞与支架材料结合,为细胞提供更适合存活和分化的微环境。
- 三是疾病修饰与早期干预。随着对疾病早期标志物认识的深入,干细胞治疗可能逐步从晚期患者前移到疾病早期阶段,真正实现疾病修饰而不仅仅是症状缓解。
复旦大学研究人员在建立纹状体中型多棘神经元分化新技术方面的突破,不仅为亨廷顿病的细胞治疗提供了理论基础及细胞来源,也为其他神经系统疾病的细胞治疗研发提供了可借鉴的技术路径。
多能干细胞治疗帕金森病、脊髓损伤和癫痫等中枢神经系统疾病的研究已进入一个快速发展阶段。随着科学技术的进步和临床经验的积累,这种创新治疗策略有望为众多神经系统疾病患者带来实质性的临床获益,最终实现从基础研究到临床应用的转化。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


اترك تعليقاً