在再生医学领域,诱导多能干细胞(iPS 细胞)的出现堪称革命性突破 ,这种能自我更新、并分化为人体各类功能细胞的 “万能细胞”,为重大疾病的个性化治疗开辟了新路径。
目前,基于 iPS 细胞的细胞疗法已在多项临床试验中展现出良好前景,但传统技术长期受限于成本高、流程复杂、安全风险等问题,难以实现广泛临床应用。

利用化学重编程技术从外周血中高效生成具有临床应用价值的人类多能干细胞
近日,北京大学邓宏魁团队等联合研究机构在《Cell Discovery》上发表的一项重磅研究,成功破解了这一难题:他们建立了一套无血清、临床适用的化学重编程系统,可直接从人体外周血中高效生成高质量的人类化学诱导多能干细胞(hCiPS 细胞),为干细胞疗法的规模化临床转化奠定了关键基础。
01、现状:干细胞疗法的曙光与瓶颈
再生医学领域曾因诱导多能干细胞(iPS细胞)的发现而迎来革命。这种细胞能够无限增殖,并能分化成人体内几乎任何类型的细胞,为治疗帕金森病、糖尿病、心肌梗死等重大疾病带来了前所未有的希望。
基于患者自身细胞制备的iPS细胞,理论上可以避免免疫排斥,实现“私人订制”的细胞修复。然而,理想很丰满,现实却充满挑战。目前主流的iPS细胞制备方法依赖向细胞内导入特定的“重编程基因”(转录因子),如OCT4、SOX2等。这种方法存在成本高昂、耗时漫长、效率低下,且病毒载体或外源基因可能随机插入基因组,带来潜在的致癌风险。临床应用要求细胞产品必须安全、纯净、可标准化生产,传统方法在这些方面短板明显。
2013年,中国科学家团队另辟蹊径,在国际上率先建立了完全使用小分子化合物的“化学重编程”技术,成功将小鼠体细胞“变回”多能干细胞。2022年,该团队又将这一技术成功应用于人类体细胞,诞生了人类化学诱导多能干细胞(hCiPS细胞)。重要的是,我们后续的临床结果表明,将自体hCiPS细胞衍生的胰岛移植到1型糖尿病患者体内可使其持续摆脱胰岛素依赖,这凸显了患者特异性hCiPS细胞在治疗重大疾病方面的治疗潜力。这些进展表明,化学重编程是一种极具前景的干细胞生产策略,也是个性化细胞临床应用的强大平台。
而此次研究,正是该团队在化学重编程技术上的又一重大突破,聚焦于解决临床适用的血液细胞重编程难题。
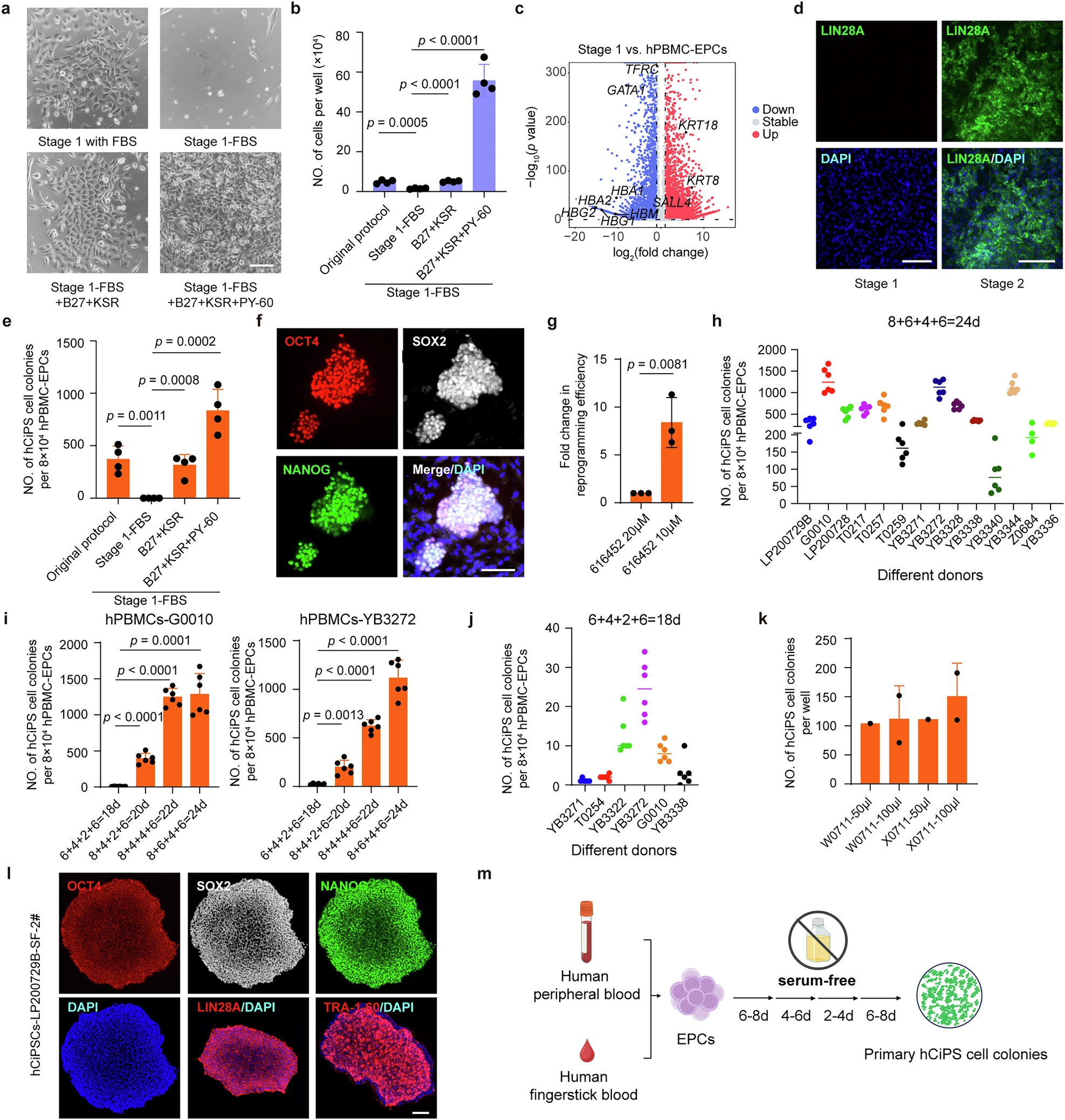
图1:建立符合临床规范的血细胞重编程方案。
02、诱导多能干细胞技术的突破:从“微量血液”到“无限潜能”
尽管取得了初步成功,但早期的hCiPS细胞多来源于脂肪或皮肤组织,获取过程有创,限制了其广泛应用。
相比之下,血液,尤其是外周血,因其易获取、微创、来源丰富,成为制备患者特异性干细胞的最理想起点。全球海量的血液样本库,更是为这项技术提供了巨大的资源宝库。
然而,如何用无化学成分明确的无血清体系,高效地将血液细胞重编程,是一个悬而未决的难题。
研究团队首先面临一个关键障碍:去除临床禁用的动物血清(如胎牛血清)后,血液细胞完全失去了启动重编程的能力。
他们通过系统性筛选,找到了B27与KSR这两种成分的组合,成功替代了血清功能。
紧接着,团队通过高通量筛选,发现了一个名为 “PY-60”的小分子化合物,它能显著促进血液细胞在重编程早期向上皮样细胞转变,这是启动整个程序的关键“开关”。
经过对培养基成分和小分子“鸡尾酒”配方的反复优化,一套成分完全明确、高效稳定的无血清化学重编程方案终于诞生。
这套方案有多强大?
-
高效率:从单孔血样中能获得超过100个高质量hCiPS细胞集落。
-
速度快:最快仅需18-24天即可完成重编程。
-
材料微创:不仅可用常规静脉血,甚至50-100微升的微量静脉血或简单的指尖采血,就足以成功制备出干细胞。
-
普适性强:在来自14位不同供者的血液样本中均获成功,证明了其卓越的稳定性和可重复性。
经严格检测,这些由血液“变身”而来的hCiPS细胞染色体正常,高表达多能性核心蛋白,在基因表达谱上与人类胚胎干细胞高度相似,并具备分化为人体所有三大胚层组织的能力,完全符合多能干细胞的所有标准。
03、严格验证:细胞质量符合临床标准
一项技术能否用于临床,关键在于其生成细胞的安全性和功能性。研究团队对无血清系统生成的 hCiPS 细胞进行了全面的表征验证,结果显示这些细胞完全符合临床级干细胞的标准:
在形态和遗传稳定性上,hCiPS 细胞形成了边界清晰、核仁明显的细胞集落,与人类胚胎干细胞(hESCs)高度相似;染色体核型分析证实细胞无染色体异常,遗传指纹图谱也验证了这些细胞确实来源于捐赠者自身的血液细胞,排除了交叉污染的可能。
在多能性方面,免疫荧光染色显示 hCiPS 细胞同时表达 OCT4、SOX2、NANOG 等核心多能性转录因子,以及多能干细胞特异性表面标志物;基因表达分析表明,其多能性相关基因的表达水平与人类胚胎干细胞相当,全局基因表达图谱也高度相似,证实这些细胞成功获得并维持了多能性状态。
在分化能力上,hCiPS 细胞表现出强大的三胚层分化潜能:体外实验中,通过类胚体介导的分化,细胞可分化为外胚层(SOX1/TUJ1 阳性)、中胚层(SOX9/GATA4 阳性)和内胚层(SOX17/FOXA2 阳性)细胞;体内畸胎瘤形成实验进一步证实,这些细胞能在动物体内形成包含三种胚层来源组织的畸胎瘤,证明其具备分化为人体各类细胞的潜力。
04、临床前景:个性化细胞治疗迈入实用化阶段
这项研究的突破之处,不仅在于建立了高效、安全的血液细胞重编程系统,更在于其为干细胞疗法的临床转化扫清了关键障碍,展现出广阔的应用前景。
与传统技术相比,该无血清化学重编程系统具有三大核心优势:一是安全性更高,无需整合外源基因,避免了插入突变风险,同时彻底移除动物来源成分,消除了病原体污染和免疫反应隐患;二是操作更简便,仅需通过分步更换培养基即可完成重编程,无需复杂的病毒感染或质粒递送流程,便于标准化生产;三是成本更低,小分子化合物易于合成和规模化制备,适合开发成商用试剂盒,大幅降低临床应用成本。
在临床应用方面,该技术已具备明确的转化价值。此前,邓宏魁团队已通过临床研究证实,将 hCiPS 细胞衍生的胰岛细胞移植到 1 型糖尿病患者体内,可实现持续的胰岛素独立,证明了 hCiPS 细胞的治疗潜力。而此次血液来源的 hCiPS 细胞,相比之前使用的脂肪或皮肤组织来源,采集过程更微创、更易被患者接受,能显著加速个性化细胞治疗的临床推广。
未来,这项技术可广泛应用于多种重大疾病的治疗:通过患者自身血液生成 hCiPS 细胞,再分化为心肌细胞治疗心力衰竭、分化为神经细胞治疗帕金森病、分化为肝细胞治疗肝硬化等。同时,基于该技术的高效率和便捷性,可建立大规模的 hCiPS 细胞库,为需要紧急治疗的患者提供匹配的干细胞资源,进一步扩大细胞疗法的受益人群。
05、未来:通往个性化细胞治疗的“高速公路”
这项研究的深远意义,远不止于实验室的技术突破。
首先,它建立了一条符合临床级细胞产品标准的“生产线”。 无动物源成分、无非基因整合、操作流程标准化,使得大规模制备临床适用的患者特异性干细胞成为可能。
其次,它极大地降低了细胞治疗的“入门”门槛。 未来,患者可能只需在诊所提供几滴血液,几周后就能获得属于自己的“万能”干细胞。这些细胞可以被定向分化为胰岛细胞治疗糖尿病、神经元治疗帕金森病、心肌细胞修复心脏等。
研究团队此前已取得令人振奋的临床进展:将一名1型糖尿病患者自身hCiPS细胞分化成的胰岛细胞移植回其体内后,该患者成功实现了长期的“胰岛素脱离”,血糖恢复自主控制。
当时使用的干细胞来源于患者脂肪组织。如今,结合这项全新的血液重编程技术,未来同样的治疗将变得更加便捷、微创且可大规模推广。
从一小管血液开始,到制备出能修复器官的特定细胞——这条路径正变得前所未有的清晰和通畅。
这项技术不仅是一个高效的细胞制备平台,更是一座连接前沿基础研究与广大患者需求的桥梁,它预示着个性化再生医学的时代,正加速向我们驶来。
在实验室里,血液细胞经历了一场精密设计的“时空穿越”,重返生命最初的全能状态。这项中国科学家引领的突破,正将科幻般的“器官再生”场景,一点点写进现实的医疗手册。当个体化细胞治疗像抽血检验一样便捷时,人类对抗疾病的图景将被彻底改写。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

اترك تعليقاً