在这一背景下,再生细胞疗法应运而生,它旨在通过干细胞或祖细胞修复受损的肺组织,为治愈此类疾病带来了新的希望。本文将对再生细胞疗法治疗慢性肺病这一领域的研究现状与未来展望进行系统概述。(相关文献发表在期刊杂志《Advanced Drug Delivery Reviews》上[1]。

再生细胞疗法治疗慢性肺病:机制、进展与未来方向全解答
一、慢性肺病的治疗困境与再生疗法新希望
慢性肺病(CLD)是一组影响呼吸道及其支撑结构的疾病,其中以哮喘和慢性阻塞性肺病(COPD)最为常见,后者又包含慢性支气管炎和肺气肿。此外,肺纤维化和肺动脉高压也属于此类疾病。CLD不仅是全球主要死因之一,且发病率持续攀升。诸如肺气肿和肺纤维化等疾病,其特征是功能肺组织进行性、不可逆的丧失,目前尚无治愈方法,严重危及生命。
因此,临床治疗重点在于缓解症状与延缓疾病进展,主要手段包括使用吸入性药物(如ICS、LABA、LAMA)以及针对特定患者的抗纤维化药物。当病情进入晚期,外科手术(如肺减容或肺移植)成为最后的选择,但这些方法均存在显著局限性。开发更有效乃至治愈性的疗法迫在眉睫,这不仅能减轻全球约12%的COPD患病率所带来的巨大患者痛苦,也能缓解其造成的沉重经济负担——例如,2019年欧盟27国在慢性呼吸系统疾病上的花费就高达约3800亿欧元。
二、核心病理特征:从组织损伤到再生失效
在病理层面,COPD与肺纤维化均以肺泡腔的进行性损伤为核心特征,导致气体交换功能严重下降。然而,二者的发病机制有所不同:COPD通常源于长期暴露于有害刺激物(如烟草烟雾)所引发的慢性炎症及组织修复失常;而肺纤维化则多由未知因素触发,表现为肺泡结构的异常重塑,其修复过程失控,伴随着大量细胞外基质沉积、免疫细胞浸润及上皮-间质转化,最终导致功能性肺泡丧失。
目前,对于这些疾病中组织损失与异常重塑的确切细胞来源、事件顺序和因果关系仍不完全清楚。幸运的是,近期研究开始揭示损伤状态下特定细胞亚群的作用过程,这些新见解为在疾病早期阻断组织破坏带来了希望。同时,对于已发生广泛肺组织损伤的患者,开发能够促进组织再生的创新疗法已成为一项紧迫的医学需求,这也将下文将探讨的再生细胞疗法推向了研究前沿。
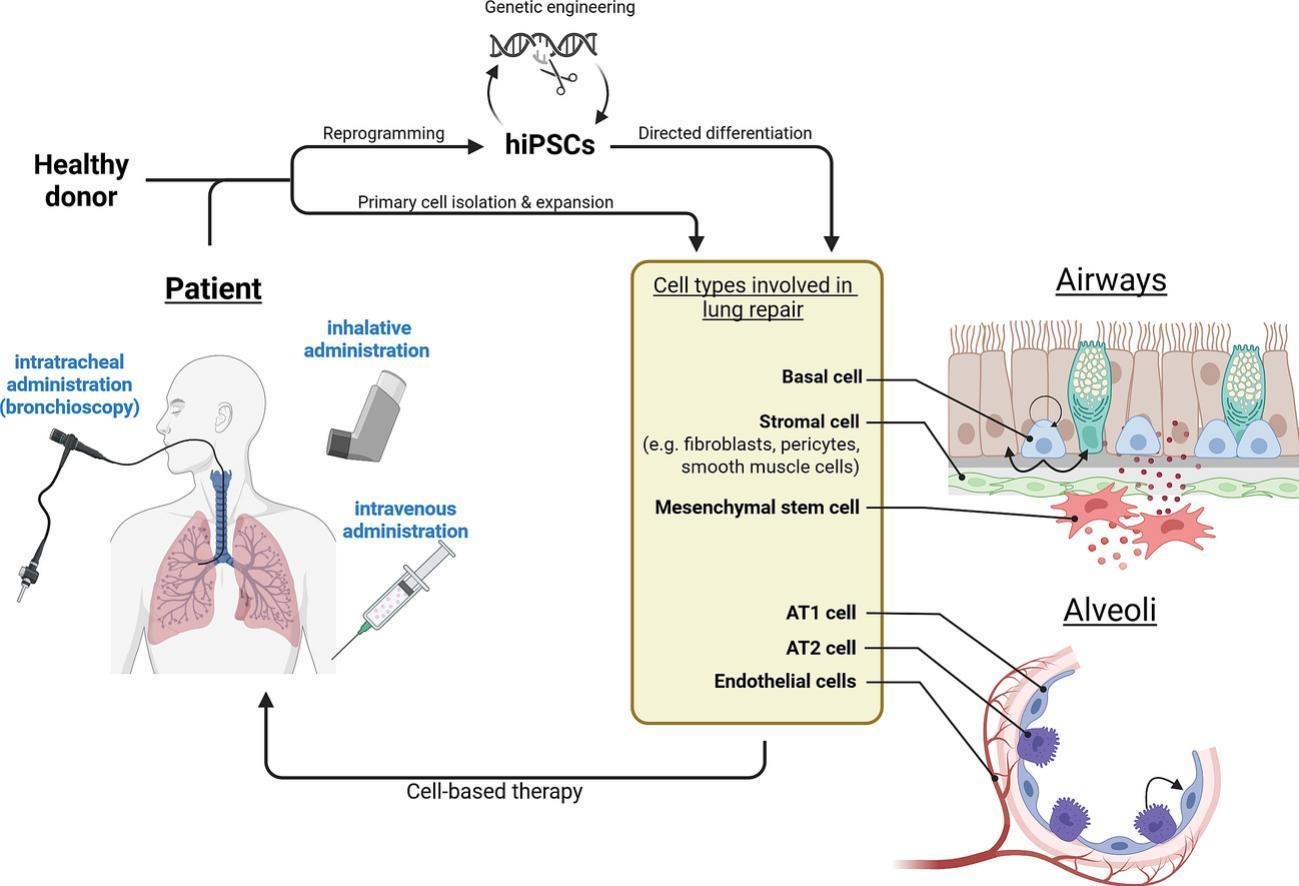
三、肺组织修复和再生的关键细胞类型有哪些?
肺组织修复与再生是一个涉及多种细胞与分子协同作用的复杂过程。其中,上皮细胞、基质细胞和内皮细胞构成了修复的核心网络。
上皮细胞:直接的修复执行者与核心祖细胞
肺上皮细胞是组织修复和再生的直接执行者,其中包含多种位于不同区域的祖细胞群。在近端气道,基底细胞是关键的祖细胞,它们能够自我更新并分化为分泌细胞和纤毛细胞以维持稳态。
研究发现,基底细胞在慢性肺病中会出现功能异常或转化为促纤维化的“异常基底细胞”,但其特定亚群也展现出向肺泡细胞分化的潜力,从而抑制纤维化。在远端肺泡,2型肺泡上皮细胞 被公认为主要的祖细胞,它们在损伤后被激活、增殖并分化为负责气体交换的1型肺泡上皮细胞。一个特定的WNT反应性肺泡上皮祖细胞 亚群在损伤修复中尤为关键。
此外,在呼吸性细支气管处新发现的分泌细胞群,也具有显著的可塑性,能够分化为肺泡或气道上皮细胞。然而,在特发性肺纤维化和慢性阻塞性肺病等疾病中,这些关键的祖细胞群会出现功能障碍、大量丢失或异常转分化,导致再生失败,这凸显了它们在修复过程中的核心地位。
基质细胞:组织微环境的构建者与调控者
基质细胞,特别是间充质基质细胞和成纤维细胞,在肺组织修复中扮演着至关重要的支持与调控角色。它们通过分泌生长因子、调控细胞外基质沉积和进行免疫调节,为上皮细胞的再生提供必要的结构支撑和分子信号,共同构成一个支持性的微环境。然而,在疾病状态下,基质区室会发生显著失调,从修复的“助手”转变为破坏的“推手”。
研究发现,特定的致病性成纤维细胞亚群能够通过异常的信号传导,直接导致肺泡结构的破坏:例如,Gli1+成纤维细胞被发现既能通过招募免疫细胞导致特定AT2细胞亚群丢失而引发肺气肿,也能驱动基底细胞的异常增生促进纤维化。
此外,损伤相关成纤维细胞的出现,也直接关联于纤维化或肺气肿的病理环境,这表明基质细胞的表型和功能状态是决定修复走向康复还是疾病的关键因素。
内皮细胞:不可或缺的协同修复伙伴
肺泡区域的内皮细胞近年来被证实是肺泡修复过程中一个不可或缺的协同伙伴。它们不仅在肺发育过程中起关键作用,在成年期的损伤修复中也展现出祖细胞功能,能够参与微血管床的再生。更重要的是,内皮细胞通过旁分泌信号直接支持上皮细胞的稳态与再生,例如通过产生特定因子来促进上皮细胞的增殖。
临床观察发现,在慢性阻塞性肺病患者中,即使是在看似未受影响的组织区域,也已出现明显的微血管损伤,这提示内皮功能障碍可能是组织损伤的早期事件。而香烟烟雾等致病因素会损害内皮细胞的增殖能力及其支持功能。这些证据共同表明,一个功能健全的微血管系统对于成功实现肺泡上皮的修复与再生至关重要。
总而言之,肺组织的修复和再生依赖于上皮细胞、基质细胞和内皮细胞这三大关键细胞类型之间精密而复杂的协作。任何一方的功能失常都会破坏这一协同网络,导致再生失败和疾病进展,因此它们都是未来再生疗法需要重点关注的靶点。
四、肺再生治疗的细胞来源
基于上述对修复机制的理解,研究人员正在探索多种细胞来源,以期将其转化为治疗手段。
1、间充质干细胞
首先是间充质基质/干细胞,这是目前研究最广泛的细胞类型。它们主要从脐带、脂肪组织或骨髓中获取,因其能分泌大量支持再生的生物活性分子而备受关注。
在动物模型中,MSCs展现出巨大的治疗潜力,但人体临床试验结果却差异显著。虽然多次研究证实了其临床应用的安全性,但在肺气肿等疾病中未能实现预期的组织修复效果。2022年,有研究表明脐带来源的MSCs对COVID-19相关肺损伤具有长期益处,且COPD患者自身的MSCs在功能上与健康供体相当,这为自体移植提供了可能性。

人间充质干细胞治疗重症新冠肺炎:一项随机、双盲、安慰剂对照试验的1年随访结果
2、肺泡上皮细胞
其次是肺泡上皮细胞,特别是AT2细胞。在肺纤维化动物模型中,移植AT2细胞能够降低纤维化程度并提高表面活性物质水平。
2016年,一项针对特发性肺纤维化患者的初步研究使用了自体的肺球体干细胞,结果显示在12个月内疾病没有恶化,证明了该方法的可行性,但未能显示明确的功能改善。

肺泡Ⅱ型细胞移植治疗特发性肺纤维化的安全性和耐受性
在急性呼吸窘迫综合征模型中,AT2细胞移植也显示出抗炎和减轻水肿的效果。然而,原代AT2细胞的分离困难、扩增能力有限,限制了其大规模临床应用。
3、其它原代细胞来源
第三类是其他原代细胞来源,包括肺源性的内皮细胞和基底细胞。研究表明,在肺气肿动物模型中,移植肺组织来源的内皮细胞可以减轻组织损伤并改善肺功能。
2024年,一项I期临床试验报道,通过支气管镜应用自体的P63+祖细胞后,患者的肺气体交换能力和运动耐量得到改善,且未出现严重不良反应,为这类细胞的治疗应用提供了初步临床证据。
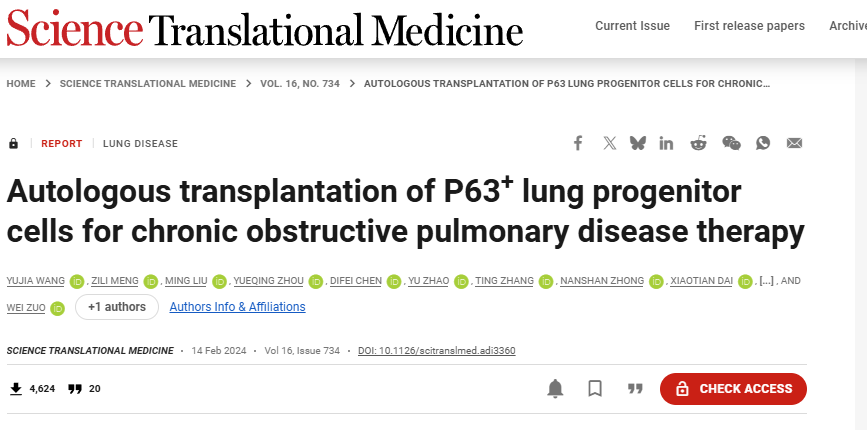
P63+肺祖细胞自体移植治疗慢性阻塞性肺疾病
4、胚胎干细胞
第四类是胚胎干细胞。hESC具有无限增殖和多向分化的能力,能够分化为AT2细胞等肺细胞类型。在动物模型中,hESC衍生的AT2细胞和一种特殊的免疫与基质调节细胞均显示出治疗潜力,能够改善肺损伤和纤维化。
最后,还报告了两例hESC衍生细胞给药的临床病例,其中一例来自之前的一项研究,其中将IMRC给药于两名出现急性肺损伤的重症COVID-19患者,两名患者均康复,但这不是一项有说服力的研究,没有对照组,而且目前也没有后续研究。
此外,2015期间的一份病例报告讨论了使用内部GMP/GLP/GTP培养系用hESC治疗肺气肿性COPD患者。患者每天接受两次肌肉注射和两次静脉注射细胞,持续七天,并雾化hESC以及气管内雾化hESC。每4-6个月重复一次治疗。患者在100天内出现好转迹象,治疗两年后,患者能够远距离行走,全职工作,并且没有咳嗽和痰。

人类胚胎干细胞(hESCs)治疗肺气肿性慢性阻塞性肺病:病例报告
虽然以上有个别病例报告描述了hESC治疗COPD患者的积极结果,但这些结果缺乏严格对照,且hESC使用涉及的伦理问题限制了其进一步研究和应用。
5、诱导多能干细胞
最后,诱导多能干细胞被认为是最有前景的细胞来源。iPSC不仅避免了hESC的伦理问题,还能从患者自身细胞获得,降低免疫排斥风险。研究人员已建立了将iPSC高效分化为多种肺细胞类型的方法,包括远端肺泡上皮细胞、近端气道上皮细胞,以及间充质基质细胞和内皮细胞。
更重要的是,iPcc的扩增和分化过程已能在生物反应器中实现规模化生产。最近的动物研究证实,iPSC衍生的肺泡祖细胞和基底细胞能够成功植入受损肺部并长期存活,参与组织修复,展示了其真正的再生潜力。尽管如此,iPSC临床应用仍需解决细胞类型选择、纯度和递送方法等关键问题。
五、细胞治疗的递送途径:将疗法精准送达
细胞疗法的成功很大程度上取决于细胞输送至靶组织的安全性和有效性。在肺部疾病领域,两种主要的给药途径已被广泛研究:静脉注射和支气管内/气管内给药。每种途径都有其独特的优势和挑战,会影响细胞的分布、滞留和治疗效果。
1、静脉注射
静脉注射是一种全身性给药方式,其核心优势在于微创、操作简便且易于重复治疗。它利用了“肺首过效应”,使细胞在首次循环时滞留于肺部微血管。
I期临床研究表明,在6个月至2年的观察期内,静脉注射BM-MCs、BM-MSCs、胎盘MSCs和脂肪MSCs治疗不同肺部疾病总体安全性良好,且无不良反应。给药后,临床症状,特别是COPD和IPF,并未恶化,部分病例出现轻度但不显著的改善。
然而,其显著缺点是肺部滞留率低且停留时间短,大部分细胞会迅速转移至肝脏等器官,因此需要注入大量细胞,潜在地增加了血栓形成风险。
2、支气管内给药
支气管内给药是一种局部给药途径,通过气管内滴注(动物模型)或纤维支气管镜(临床)将细胞悬液直接输送到目标支气管或肺泡区域。其最大优势在于定位精准,能够实现局部高浓度给药,并且细胞在肺内的滞留率显著高于静脉注射(临床前研究显示可达1%-10%)。
首次I期临床试验表明,经支气管镜注射基底细胞和AT2细胞分别对COPD患者和IPF患者具有普遍可行性、耐受性,且无严重不良反应。
该途径的主要挑战在于,它依赖于支气管镜检查,通常需要麻醉,因此操作相对复杂,不便于像静脉注射那样频繁进行。
3、吸入给药
吸入给药旨在通过雾化装置(如气雾器)将细胞以气溶胶形式送入肺部,这是患者友好度最高的途径。它极大地简化了给药过程,便于患者自行或由护理人员操作,非常适合重复和长期治疗。临床前研究证实了这种方法的可行性和初步安全性。
当前面临的核心技术挑战在于,雾化过程可能对脆弱的细胞造成机械损伤,影响其活力,同时如何确保细胞气溶胶能够有效且均匀地分布到气道深处,尤其是远端肺泡区域,仍是需要攻克的技术难题。因此,该途径的相关研究仍处于早期阶段。
总结与展望
尽管临床前研究显示出细胞疗法在修复受损肺组织和改善肺功能方面的巨大潜力,但其临床转化仍面临诸多挑战。当前的核心问题在于如何确定特定疾病情境下的最佳细胞类型,并深入探究病变微环境对治疗细胞的影响。研究发现,不同来源的细胞(如肺源性与脂肪源性的内皮细胞)疗效存在显著差异,这表明细胞来源的选择至关重要。
为推进该领域发展,未来研究需聚焦于三大方向:
- 一是开发有效的细胞保护策略,例如利用水凝胶包裹、细胞预处理或直接使用细胞外囊泡等衍生制品;
- 二是优化细胞的靶向递送系统,提高其在病灶部位的归巢效率;
- 三是建立更具预测性的人类疾病模型,以更准确地评估治疗策略。
通过这些系统性努力,才能为细胞疗法在肺再生医学中的成功应用奠定坚实基础,最终为深受慢性肺病困扰的患者带来治愈的曙光。
参考资料:
[1]:https://www.sciencedirect.com/science/article/pii/S0169409X25001978?via%3Dihub #bb0
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


اترك تعليقاً