多巴胺细胞替代疗法是帕金森病的一种潜在治疗方法,旨在通过直接替换大脑中因病理过程而丢失的部分细胞来治疗该疾病。
近日,知名期刊杂志《帕金森病杂志》发表了一篇“Clinical trial highlights: Dopamine cell-replacement therapies”(治疗帕金森病的临床试验亮点:多巴胺能神经元替代疗法)的研究综述[1]。
这项综述讨论了历年来胚胎与诱导多能干细胞治疗帕金森病的临床试验现状(共计16项)。
16项临床试验揭示胚胎与诱导多能干细胞治疗帕金森病的前景:多巴胺细胞疗法正推进
疾病背景:多巴胺缺失与治疗瓶颈
帕金森病(PD)的核心病理在于中脑黑质多巴胺能神经元的变性丢失。当这类神经元减少约一半时,患者便会出现明显的运动障碍。虽然自20世纪60年代起,左旋多巴等药物治疗已成为临床标准,但长期使用往往会引发症状波动、运动障碍及神经精神副作用。这种传统药物疗法的局限性,促使医学界不断探索深部脑刺激(DBS)等新技术,以及更具针对性的多巴胺能细胞替代疗法。

早期探索:胎儿组织移植的初步尝试
20世纪80至90年代,以隆德大学为首的研究机构率先开展了细胞替代疗法实验。研究者尝试将发育中的人类胎儿腹侧中脑(hfVM)细胞植入患者纹状体。虽然早期的病例系列研究证实了移植细胞存活的安全性与可行性,但临床效果却呈现出巨大的个体差异:部分患者甚至可以多年停药,而另一些患者则毫无获益,这种不确定性为该疗法的后续发展埋下了伏笔。
临床挫折:双盲试验的失利与挑战
20世纪90年代后期,由美国国立卫生研究院资助的两项大规模双盲对照试验结果令人沮丧。这两项研究不仅未能达到主要疗效终点,还发现相当一部分患者出现了“移植诱发运动障碍(GIDs)”等副作用。这一沉重打击导致相关临床试验一度陷入停滞,也迫使学术界开始深入反思失败原因,包括移植细胞的均匀度、组织剂量、免疫抑制方案以及血清素神经元的潜在干扰。
未来曙光:标准化来源与干细胞技术
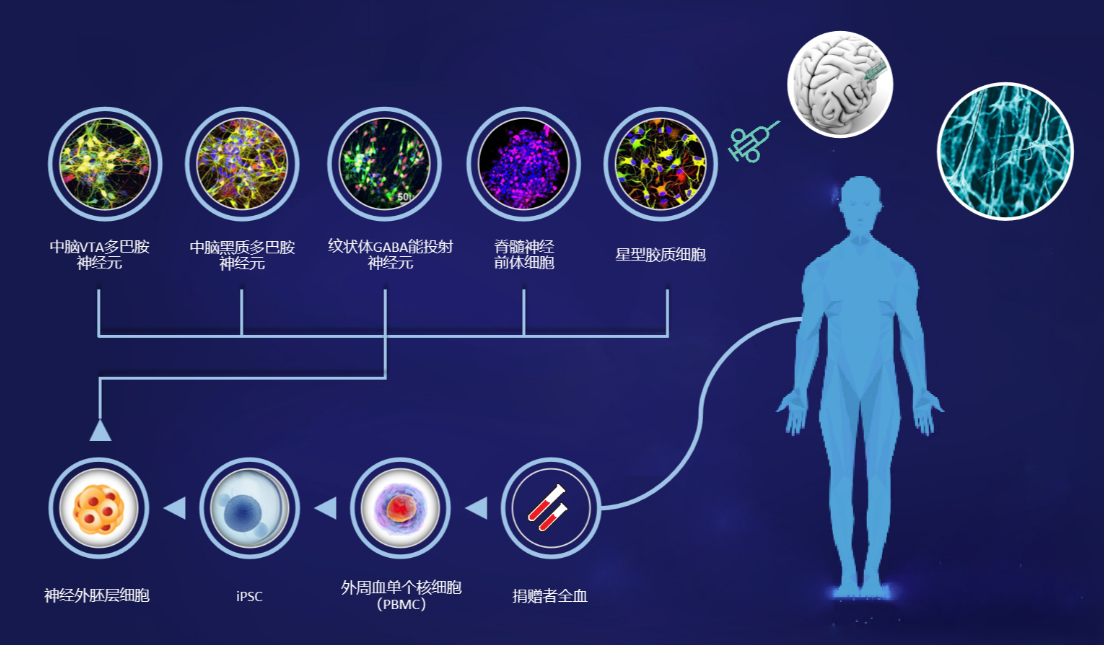
为了解决胎儿组织来源不稳定及临床效果不一的问题,欧盟资助的TransEuro试验尝试优化方案,却因组织供应短缺而进展缓慢。这一困境明确了临床应用的先决条件:必须拥有稳定且可靠的细胞来源。2011至2012年间,利用人类多能干细胞定向分化为中脑多巴胺细胞的技术取得突破,为实现标准化、规模化的帕金森病细胞治疗带来了全新的希望。
首个针对帕金森病患者的干细胞衍生多巴胺能细胞替代疗法试验于2015年启动,迄今为止已有16项试验开始——详见下文。我们检索了ClinicalTrials.gov和世界卫生组织临床试验注册库,查找任何使用干细胞衍生多巴胺细胞治疗帕金森病的试验。大多数试验仍在进行中,该领域尚处于早期发展阶段,因此其安全性和有效性尚未得到证实。
人类胚胎干细胞衍生多巴胺能细胞治疗帕金森病的试验(表1)
人类胚胎干细胞(hESC)衍生细胞以受精后第4/5天单个人类胚胎内细胞团中分离的多能干细胞为原始细胞来源。这些细胞可在体外扩增,目前已建立多种临床级hES细胞系。这些多能干细胞可在体外分化为多巴胺能前体细胞。
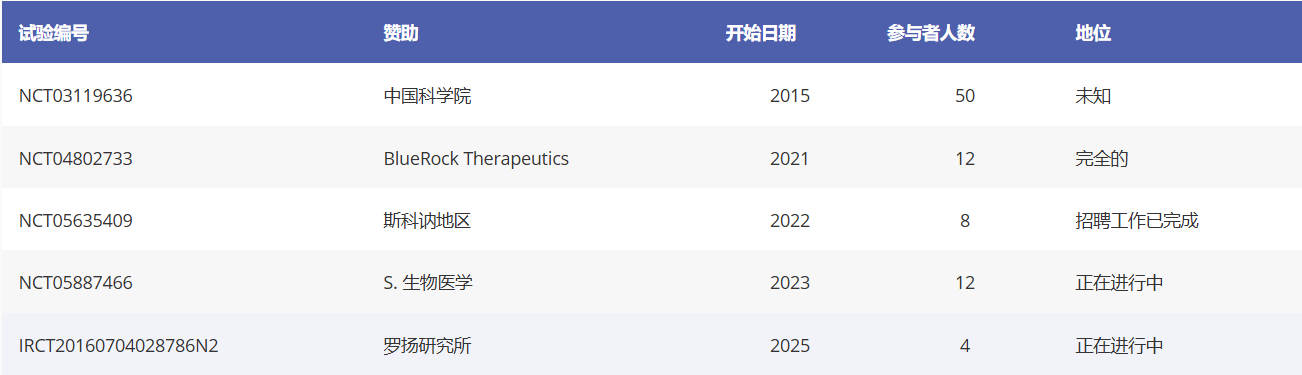
表1:胚胎干细胞衍生多巴胺能细胞治疗帕金森病的试验总结
这种方法可实现“即用型”治疗,细胞产品可冷冻保存并大规模生产,达到临床标准,且每批产品均可进行质量控制检测。该方法产生的是同种异体产品,多巴胺能细胞在植入后成熟,因此移植后需要某种形式的免疫抑制治疗。
01、标题:人胚胎干细胞衍生神经前体细胞治疗帕金森病的安全性和有效性研究
阶段:I/II
开始日期:2015年
状态:未知
临床试验编号:NCT03119636
赞助方:中国科学院
国家:中国

研究设计:一项开放标签试验,采用立体定向纹状体内注射单剂量多巴胺能神经前体细胞。本研究计划纳入50例年龄在50至80岁之间的晚期帕金森病(Hoehn和Yahr [HY]分级3期或4期)患者。主要终点为安全性,评估不良事件的数量和性质。
备注:这是首个尝试将干细胞衍生的多巴胺能移植应用于帕金森病患者的临床试验。目前尚未公布临床数据。
02、标题:评估人胚胎干细胞衍生中脑多巴胺神经元细胞疗法(MSK-DA01)治疗晚期帕金森病的安全性和耐受性的I期研究
阶段:I
开始日期:2021年
状态:已完成
临床试验编号:NCT04802733
赞助商:BlueRock Therapeutics
国家:美国/加拿大

研究设计:一项开放标签试验,通过壳核内注射给予胚胎干细胞来源的多巴胺能祖细胞产品(Bemdaneprocel)。试验招募了两组患者,分别测试180万和540万个细胞的剂量,共纳入12名患者。试验招募了年龄在50至78岁之间的晚期帕金森病患者。
主要终点是移植后12个月的安全性和耐受性,次要终点包括移植后1年和2年时通过18F-DOPA PET成像评估的细胞存活率以及通过统一帕金森病评定量表(UPDRS)评估的运动评分变化。
评论:该试验于2022年完成招募,并报告称,移植后24个月,高剂量组和低剂量组均对该产品耐受性良好。他们还报告称,在“关期”状态下,高剂量组的UPDRS第三部分评分平均降低了23分,而低剂量组仅降低了8.6分,这表明运动反应存在剂量依赖性,并于今年四月份公布了临床1期的临床结果。
基于该试验,BlueRock Therapeutics/Bayer近期宣布计划将Bemdaneprocel产品推进至III期注册试验,该试验采用安慰剂对照设计。
03、标题:一项旨在确定移植干细胞衍生多巴胺神经元对帕金森病患者大脑的安全性和耐受性的试验(STEM-PD)
阶段:I
开始日期:2022年
状态:进行中,招聘已完成
临床试验编号:NCT05635409
赞助商:斯堪纳地区
国家:瑞典/英国

研究设计:一项开放标签试验,通过壳核内注射给予胚胎干细胞来源的多巴胺能祖细胞产品(STEM-PD)。试验招募了两组各4名患者,分别测试两种剂量的700万和1400万个细胞(共8名患者)。受试者为50-75岁、中度帕金森病(Hoehn-Yahr分期2-3期,处于“关期”)的帕金森病患者。
主要终点是安全性,通过移植后12个月的不良事件数量和性质进行评估;次要终点包括临床特征的变化,例如通过统一帕金森病评定量表(UPDRS)第三部分记录的运动症状。
评论:该试验于2024年完成招募和移植,最新消息指出,开创性的STEM-PD临床试验已推进至更高剂量阶段。这标志着欧洲首次开展针对脑部疾病的多能干细胞疗法试验。
04、标题:评估胚胎干细胞衍生多巴胺祖细胞疗法在帕金森病患者中的安全性和有效性的研究
阶段:I/II
开始日期:2023年
状态:进行中
临床试验编号:NCT05887466
赞助商:S. Biomedics
国家:韩国

研究设计:一项开放标签试验,通过壳核内注射给予胚胎干细胞来源的多巴胺能祖细胞产品(A9-DPC)。已招募两组各6名患者,分别测试315万和630万两种剂量的细胞。该试验招募50-75岁、处于晚期帕金森病(HY3-4期,处于“关期”)的帕金森病患者。主要终点是24个月时的安全性,评估细胞产品给药后治疗相关不良事件的发生情况和性质。
2025年4月,该试验报告称,12个月时安全性良好。且低剂量和高剂量治疗组患者的运动功能评分较植入前均提高了高达28.9%。低剂量和高剂量组患者的精神和情绪症状以及自主神经症状也均得到显著改善The
05、标题:帕金森病患者纹状体内移植人胚胎干细胞来源的多巴胺能祖细胞(DopaCell)的安全性和可行性评估:一项多中心I期临床试验
开始日期:2025年
状态:进行中
临床试验编号:IRCT20160704028786N2
赞助方:罗扬研究所
国家:伊朗
研究设计:开放标签试验,通过纹状体内注射给药干细胞来源的多巴胺能前体细胞产品(DopaCell)。本试验计划招募4名患者,测试单次1000万细胞剂量。招募对象为30-70岁、处于OFF状态且病程达帕金氏病III期的患者。主要终点为安全性与可行性,通过移植后12个月内不良事件的发生率及性质进行评估。
人类诱导多能干细胞衍生多巴胺能细胞治疗帕金森病的试验(表2)
人类诱导多能干细胞(iPSCs)是直接来源于体细胞的多能干细胞。体外实验中,通过引入转录因子混合物,可将体细胞诱导为多能干细胞。这些多能干细胞随后可在体外进一步分化为多巴胺能神经元。
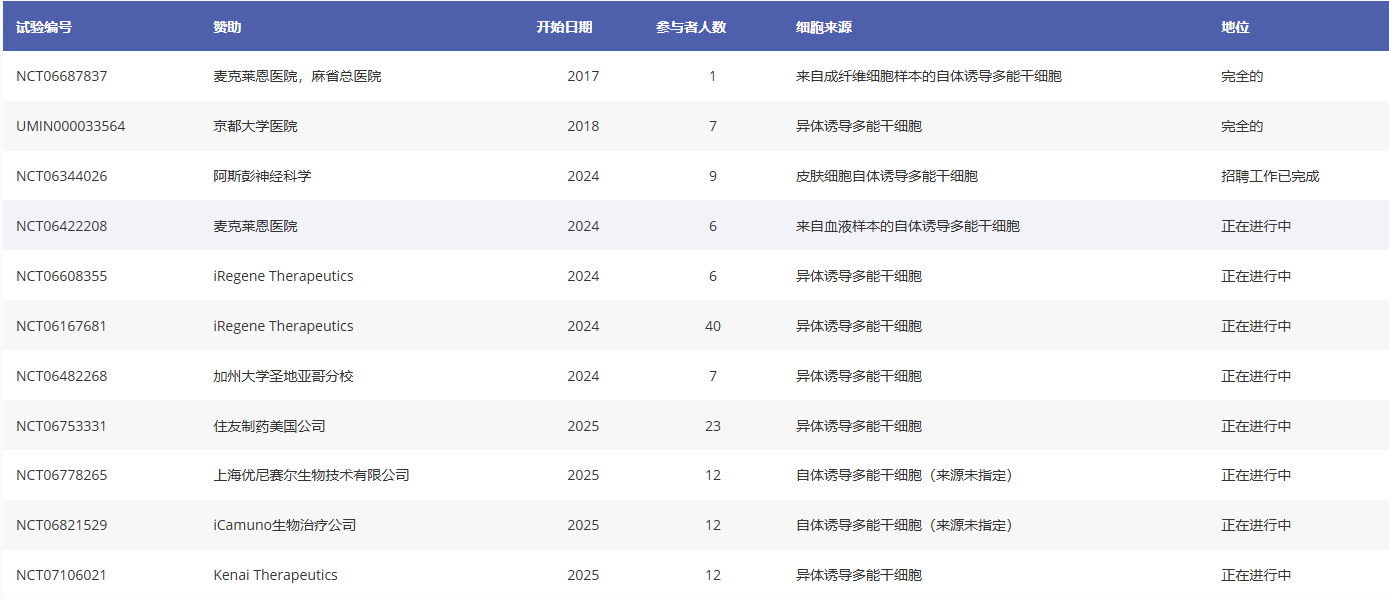
表1:诱导多能干细胞衍生多巴胺能细胞治疗帕金森病的试验总结
由于iPSCs可以直接来源于患者自身的细胞(例如,皮肤活检中的成纤维细胞或循环血细胞),这使得自体细胞移植成为可能,理论上可以避免使用免疫抑制疗法。然而,这种高度个性化的自体治疗方法并非没有风险,例如其生产成本较高,以及由于细胞来源于帕金森病患者自身,其疗效可能较差。目前,已建立并保存了多个临床级iPSC细胞系,因此,异体iPSC衍生多巴胺能细胞以及自体移植的临床试验正在进行中。
06、标题:通过自体干细胞衍生多巴胺能神经元移植治疗帕金森病
阶段:I/II
开始日期:2017年(n=1),2024年
状态:进行中
临床试验编号:NCT06687837
赞助方:麦克莱恩医院、麻省总医院
国家:美国

研究设计:一项开放标签试验,将自体诱导多能干细胞(iPSCs)衍生的多巴胺能祖细胞(由患者成纤维细胞样本制备)移植到患者体内。细胞将通过壳核内注射进行移植。试验将招募8名患者,并测试两种剂量(800万和1600万个细胞)。受试者为45至80岁、处于帕金森病晚期(HY3-4期)且处于“关期”的帕金森病患者。主要终点是安全性,通过记录移植后2年不良事件的发生率和严重程度来评估。
评论:这项于2024年开始的临床试验建立在2020年发表的采用相同方法的一个病例的结果之上。在该病例中,24个月内没有发生严重不良事件,并且使用PDQ-39患者问卷调查显示,术后18至24个月,帕金森病症状的临床指标稳定或有所改善The

07、标题:京都试验评估iPSC衍生多巴胺能祖细胞治疗帕金森病的安全性和有效性
阶段:I/II
开始日期:2018年
状态:已完成
临床试验编号:UMIN000033564
赞助方:京都大学医院
国家:日本
研究设计:一项开放标签试验,采用壳核内注射的方式,将异体诱导多能干细胞(iPSC)来源的多巴胺能前体细胞移植到患者体内。共招募了7名患者,分别接受4.2–5.2M(n=3)和10.6–11M(n=4)两种剂量的细胞。受试者为50–70岁、处于晚期帕金森病(HY3–4期,处于“关期”)的帕金森病患者。主要终点为移植后24个月的安全性以及移植物是否扩增。
评论:该试验已完成,未报告严重不良事件,UPDRS第三部分评分平均降低9.5 分。值得注意的是,该试验使用了来自供体的异基因诱导多能干细胞 (iPSC),该供体的HLA基因型与17%的日本人口相匹配,但受试者并未在试验中进行特定的HLA匹配,且移植后使用了免疫抑制剂。
该试验中的细胞产品(也称为CT1-DAP001或DSP-1083)已由住友制药公司用于两项后续研究,这两项研究均采用开放标签和假对照设计(见下文)。
08、标题:ANPD001治疗帕金森病的1/2a期研究(ASPIRO)
阶段:I/II
开始日期:2024年
状态:进行中
临床试验编号:NCT06344026
赞助商:阿斯彭神经科学
国家:美国

研究设计:一项开放标签试验,旨在评估自体诱导多能干细胞(iPSCs)衍生的多巴胺能祖细胞在治疗中的应用效果。该iPSCs由患者自身的皮肤细胞制备而成。试验计划招募9名患者,分为两组,分别接受1000万或1500万至2000万个细胞的壳核内注射。受试者为45至80岁、处于晚期帕金森病(HY3-4期,处于“关期”)的帕金森病患者。
主要终点为移植后2年的安全性,通过不良事件的发生率和严重程度进行评估。
评论:该试验已于2025年1月完成招募和移植,迄今为止未报告任何严重不良事件The
09、标题:自体iPSC衍生多巴胺神经元移植治疗帕金森病
阶段:I
开始日期:2024年
预计结束日期:2027-12-31
状态:进行中
临床试验编号:NCT06422208
赞助商:麦克莱恩医院
国家:美国

研究设计:一项开放标签试验,将患者自体来源的诱导多能干细胞(iPSCs)衍生的多巴胺能祖细胞(由患者自身血细胞生成)移植到患者体内。试验将招募6名患者,所有患者均接受相同数量的细胞(剂量未公开),通过壳核内注射的方式进行移植。试验对象为年龄在55至80岁之间、确诊帕金森病至少5年的帕金森病患者。
主要终点是移植后2年的安全性,通过不良事件的发生率和严重程度来评估。
10、标题:NouvNeu001治疗早发性帕金森病的安全性、耐受性和初步疗效
阶段:I
开始日期:2024年
状态:进行中
临床试验编号:NCT06608355
赞助商:iRegene Therapeutics
国家:中国

研究设计:一项开放标签试验,旨在评估异基因诱导多能干细胞(iPSCs)来源的多巴胺能祖细胞移植疗效。将招募6名患者,通过纹状体内注射单次给药(剂量未公开)。试验将招募年龄在18至70岁之间、发病年龄小于50岁且处于“关期”(OFF状态)的帕金森病患者(PwP)。主要终点是移植后96周的安全性,通过不良事件的发生率和严重程度进行评估。
2025年7月,睿健毅联医药科技(成都)有限公司宣布其自主研发的NouvNeu001 注射液疗中重度帕金森的II期临床试验在北京医院已成功完成首例入组给药。

NouvNeu001注射液针对帕金森病,提供了细胞替代疗法的新思路,于2023年8月获得中国 NMPA 批准进入临床阶段,成为全球首个进入临床的化学诱导iPSC衍生治疗产品,并于2024年6月获得美国FDA批准开展海外临床研究,实现了中美IND「双报双批」The
11、标题:NouvNeu001治疗帕金森病的安全性、耐受性和有效性
阶段:I/II
开始日期:2024年
状态:进行中
临床试验编号:NCT06167681
赞助商:iRegene Therapeutics
国家:中国

研究设计:一项开放标签试验,旨在评估异基因诱导多能干细胞(iPSCs)来源的多巴胺能祖细胞移植疗效。将招募40名患者,通过纹状体内注射单次给药(剂量未公开)。试验对象为50-75岁、处于“关期”(OFF状态)的帕金森病患者(PwP)。主要终点为移植后24周和48周的安全性,以及移植后24周的运动功能(以UPDRS第三部分评分的变化衡量)。
备注:NovNeu001异体iPSC衍生多巴胺能产品正与上述I期研究并行进行测试。此外,两项研究招募的患者群体也存在差异:I期研究招募的是早发型帕金森病患者,而I/II期研究则招募的是发病年龄更为典型的帕金森病患者。
12、标题:移植人类iPS细胞衍生的多巴胺能祖细胞(CT1-DAP001)治疗帕金森病(I/II期)
阶段:I/II
开始日期:2024年
状态:进行中
完成日期:(估计的)临床试验编号:NCT06482268
赞助方:加州大学圣地亚哥分校
国家:美国

研究设计:一项开放标签试验,旨在评估异基因诱导多能干细胞(iPSCs)来源的多巴胺能祖细胞的疗效。将招募7名患者,通过壳核内注射单次剂量840万至1080万个细胞。试验将招募40至75岁、处于“关期”(OFF状态)且HY分期≥2的帕金森病患者(PwP)。
主要终点为安全性,通过治疗期间出现的不良事件的发生率和严重程度,以及移植后24个月F-DOPA显像上是否存在移植物扩增来评估。
13、标题:一项评估DSP-1083在帕金森病患者中安全性、耐受性和临床反应的多中心研究
阶段:I
开始日期:2025年
状态:进行中
临床试验编号:NCT06753331
赞助商:住友制药美国公司
国家:美国

研究设计:一项双队列研究,通过壳核内注射给予源自同种异体诱导多能干细胞(iPSCs)的多巴胺能祖细胞。先导队列(n=3)将接受540万个细胞,第二队列(n = 20)将以1:1的比例随机分组,分别接受540万个细胞或假手术(双侧部分厚度颅骨钻孔术)。
该试验将招募40-70岁、处于“关期”且Hoehn-Yahr分期≥3的帕金森病患者。先导队列的参与者必须为亚裔,而第二队列的参与者将来自任何种族。
主要终点是安全性(通过不良事件的数量和性质进行评估)和临床反应(通过神经精神评估和移植后104周PET成像中F-DOPA摄取的变化进行评估)。
2025年8月,日本住友制药(Sumitomo Pharma)与 Racthera 联合宣布,已向监管机构提交同种异体iPS细胞衍生多巴胺能神经祖细胞(通用名:raguneprocel)的生产与上市许可申请,用于改善中晚期帕金森病患者「关期」运动功能。

这一里程碑事件标志着干细胞再生医学疗法在神经系统疾病治疗领域的临床转化进入关键阶段,有望为全球约1000万帕金森病患者带来首个从病理机制层面解决问题的根治性疗法。
14、标题:UX-DA001治疗特发性帕金森病患者的探索性临床研究
阶段:I
开始日期:2025年
状态:进行中
临床试验编号:NCT06778265
赞助商:上海优尼赛尔生物技术有限公司
国家:中国

研究设计:一项开放标签试验,旨在通过壳核内注射的方式,将多巴胺能祖细胞(源自自体诱导多能干细胞)导入患者体内。试验将招募12名患者,分为两个剂量组(剂量未公开)。受试者为年龄在50至75岁之间、处于“关期”的帕金森病患者(PwP),其Hoehn-Yahr分期为3至4期。
主要终点为安全性,通过移植后4周和2年时不良事件的发生率和严重程度进行评估。
在2025年10月5日至9日于美国夏威夷檀香山举行的国际帕金森病和运动障碍大会(MDS 2025)的“最新突破”报告环节,该项I期试验首例患者接受UX-DA001后6个月的积极数据正式公布The
据报告,首例患者的6个月随访数据显示,UX-DA001具有良好安全性和显著疗效。
15、标题:立体定向脑内注射IPSC-DAP治疗帕金森病
阶段:1
开始日期:2025年
状态:进行中
临床试验编号:NCT06821529
赞助商:iCamuno Biotherapeutics
国家:中国

研究设计:一项开放标签试验,旨在研究自体诱导多能干细胞(iPSCs)来源的多巴胺能祖细胞的移植。将招募12名患者,通过壳核内注射给予800万个细胞。试验对象为年龄在39至75岁之间、处于“关期”(OFF状态)的帕金森病患者(PwP)。主要终点是安全性,通过移植后12个月的不良事件发生率和严重程度来评估。
16、标题:评估RNDP-001外科植入治疗特发性帕金森病患者的安全性和有效性的研究
阶段:1b/2a
开始日期:2025年
状态:进行中
临床试验编号:NCT07106021
赞助商:Kenai Therapeutics
国家:美国

研究设计:一项开放标签试验,旨在通过壳核内注射的方式,将源自同种异体诱导多能干细胞(iPSCs)的多巴胺能祖细胞移植给帕金森病患者。试验将招募12名患者,接受三种剂量(未具体说明)的治疗。受试者为45至75岁的帕金森病患者。主要终点是安全性,通过移植后15个月时不良事件的发生率和严重程度来评估。
2025年12月16日,Kenai公司在帕金森病细胞疗法I期临床试验中为首位患者给药。预计2026年将公布参与者的耐受性、安全性和脑成像方面的初步数据。

胚胎与诱导多能干细胞治疗帕金森病的总结与展望
01、现状与前景:干细胞疗法开启新纪元
多巴胺细胞替代疗法正从实验室走向临床应用的新阶段,首批基于干细胞衍生的神经元前体细胞试验已展示出初步成果。相比于现有的多巴胺泵疗法或深部脑刺激(DBS),细胞疗法的核心优势在于其“单次治疗”的潜力,有望摆脱长期的侵入性随访。
尽管细胞疗法无法像DBS那样随时调节剂量,但随着分化方案的标准化和规模化,其成本竞争力正逐渐显现,甚至可能通过改善患者的功能水平来降低长期的社会经济负担。
02、策略与考量:寻找移植的“最佳时机”
目前的临床试验主要聚焦于中度帕金森病患者。这一选择平衡了伦理安全与疗效检测的需求:早期患者尚无必要接受此类干预,而晚期患者风险过高。
然而,精准筛选患者面临挑战,因为移植细胞需要数年时间才能生长、支配神经并发挥功能。因此,理想的受试者必须能够耐受数年的“窗口期”,这要求医生在患者病情恶化到必须接受其他高级疗法之前,精准把握移植的介入节点。
03、试验设计:安慰剂对照与监管争议
在未来的临床试验设计中,是否设置“假手术”对照组成为争议焦点。虽然安慰剂效应在神经外科干预中普遍存在,但由于细胞疗法的预期疗效远超安慰剂,且可以通过18F-DOPA PET影像客观观察纹状体多巴胺的恢复情况,许多研究者认为不再需要设置假手术组。
此外,在信息高度透明的今天,维持长期双盲手术的难度也显著增加,这使得试验设计更多地取决于各国监管机构(如FDA)的审查意向。
04、未来路径:个体化筛选与大数据支持
尽管多巴胺细胞疗法展现了改变疾病自然病程的巨大潜力,但哪些患者获益最大、免疫抑制应持续多久等关键问题仍无定论。
未来需要建立全球性的中央登记系统,通过对大规模临床数据的荟萃分析,识别出最适合移植的患者亚群。虽然这种疗法不能彻底治愈帕金森病(无法阻断变性进程),但它有望通过减少口服药物需求及其副作用,显著提升患者的生活质量,使“细胞替代”成为具竞争力的治疗方案。
主要参考资料:
[1]: 1. Kayhanian S, Barker RA. 临床试验亮点:多巴胺细胞替代疗法。 帕金森病杂志。2025;0(0). doi:10.1177/1877718X251397277。
Disclaimer: This article is intended only to disseminate scientific knowledge and share industry perspectives, and does not constitute any clinical diagnostic advice! The information published by Hangi Stem Cells is not a substitute for the professional advice of a physician or pharmacist. If you have any questions about copyright or other issues, please feel free to contact me.
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有错误,请第一时间联系我们修改或删除,多谢。



Leave a Reply