中风仍是导致全球残疾的主要原因,其根源在于不可逆的神经元丢失以及中枢神经系统有限的再生能力。尽管溶栓和机械取栓等再灌注治疗可恢复血流,但严格的适用标准使许多患者缺乏有效治疗选择。近年来研究表明,针对免疫反应的干预策略作为一种中风后康复新方法,其涉及脑内固有免疫细胞与外周免疫细胞的复杂相互作用,在中风恢复中发挥关键作用。
基于干细胞的疗法,尤其是神经干细胞和间充质干细胞相关疗法,展现出重塑中风后炎症微环境、减轻继发性损伤并促进组织修复的潜力。然而,驱动这些效应的精确机制尚未完全明确,阻碍了其临床转化。
中风后康复新方法:干细胞作为“指挥官”调控微环境,免疫细胞作为“实干家”执行修复
在此背景下,哈佛医学院麻省总医院布莱根医院神经内科在《Nature Reviews Neuroscience》上发表题为“Stem cell-mediated recovery in stroke: partnering with the immune system”的研究综述。

系统阐述干细胞与免疫细胞之间的双向串扰,重点分析这些相互作用如何影响神经炎症、神经可塑性及神经环路重构,为开发靶向免疫调节策略提供新见解。
中风后炎症微环境是怎样的,会触发哪些炎症反应?
中风后炎症微环境迅速启动,形成一个高度动态的神经免疫反应网络。小胶质细胞作为中枢神经系统的主要固有免疫细胞,是最早应答者。在缺血后数分钟至数小时内即被激活,从静息的分枝状形态转变为活化形态,开始分泌TNF-α、IL-6和IL-1β等促炎细胞因子,这些细胞因子会加剧神经元损伤(图1),并成为炎症反应的起点(图1)。
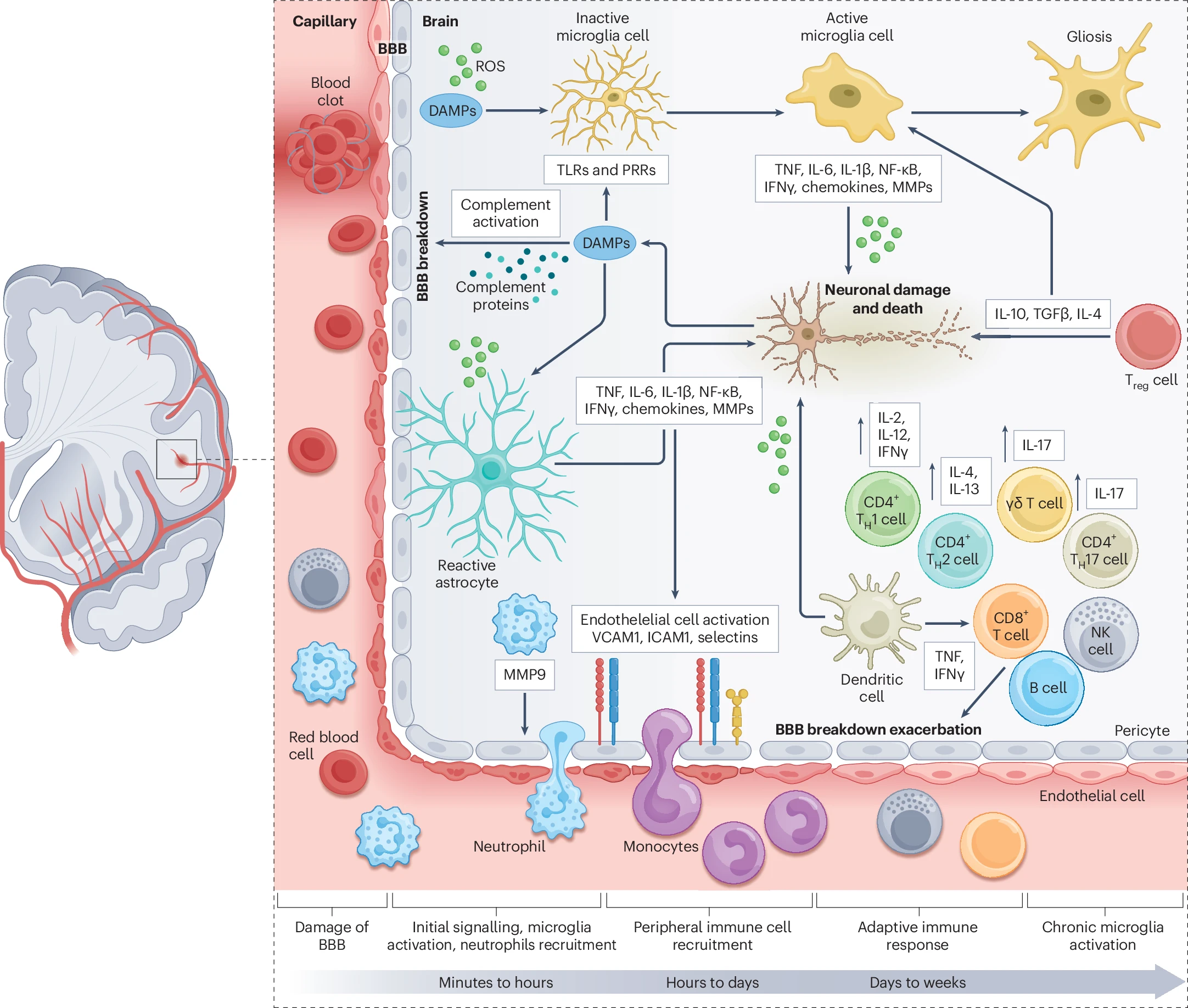
图1:中风后缺血性炎症反应的示意图。
炎症微环境触发的关键炎症反应包括NLRP3炎症小体的激活,导致IL-1β和IL-18的大量分泌,进一步加剧炎症级联反应。同时,损伤相关分子模式激活补体系统,增强血脑屏障通透性,促使外周免疫细胞如单核细胞趋化蛋白1(MCP1)和巨噬细胞炎症蛋白1α(MIP1α)的产生,形成外周免疫细胞向脑内迁移的信号通路。
外周免疫细胞的浸润是炎症微环境的重要特征,中性粒细胞作为最早进入脑内的细胞,释放基质金属蛋白酶(MMP9)破坏血脑屏障;单核细胞进入后分化为巨噬细胞,既吞噬碎片又分泌细胞因子促进炎症扩散;T淋巴细胞浸润缺血脑组织,释放干扰素-γ(IFNγ)和TNF,进一步破坏血脑屏障并加重神经元损伤。
星形胶质细胞在缺血后发生反应性增生,细胞肥大且GFAP表达上调,释放促炎介质加剧神经炎症,并可能导致胶质瘢痕形成阻碍神经修复。同时,树突状细胞作为抗原呈递细胞,启动抗原特异性适应性免疫反应,激活T细胞,形成持续的炎症循环,使炎症反应在数周内持续维持。
值得注意的是,炎症微环境也包含保护性成分,如调节性T细胞(Treg)在中风后24小时即开始浸润缺血脑组织,分泌IL-10、IL-4和TGFβ等抗炎因子,调节免疫反应并促进组织修复。这种促炎与抗炎反应的动态平衡,决定了中风后神经损伤的进展与修复潜力,为开发靶向炎症的治疗策略提供了重要依据。
深入理解中风后免疫细胞的动态作用,对于开发靶向疗法至关重要——这类疗法旨在减轻有害炎症,同时增强大脑的内在修复机制。未来,全面解析浸润中风病灶的各类免疫细胞及其复杂相互作用尤为关键。图1及补充表1展示了这些浸润免疫细胞的时间线,阐明了它们在中风后的动态变化(相关内容已在其他文献中被广泛综述)。
在后续章节中,我们将探讨中风干细胞治疗中涉及的关键免疫细胞群和信号通路,重点阐述干细胞与固有免疫及适应性免疫反应之间的相互作用如何影响中风恢复。
干细胞治疗中风研究的五大考量因素
第一,动物模型的选择是研究的基础和关键。合适的动物模型能更准确地模拟人类中风的病理生理过程,从而有效评估干细胞疗法的潜力。常用的模型包括大脑中动脉闭塞(MCAO)模型、光血栓模型等,它们各具特点:
- MCAO模型能引发快速且强烈的炎症反应,适用于研究急性期免疫调节;而光血栓或内皮素-1模型则呈现更延迟的免疫激活,利于观察修复的动态过程;
- 出血性模型则能模拟血脑屏障严重破坏后的剧烈炎症。
研究者必须根据研究目标(如侧重抗炎或再生)来选择模型,以确保研究成果具有临床转化价值。
第二,年龄、性别和合并症等宿主因素显著影响治疗效果。临床前研究必须考虑这些个体差异,因为它们会深刻改变免疫微环境和修复能力。老年大脑存在慢性炎症和修复机制受损,会阻碍干细胞的存活与整合;合并症如糖尿病和高血压,会通过加剧氧化应激、破坏血脑屏障来削弱干细胞的疗效。
此外,性激素(如雌激素)也能调节免疫反应。因此,使用能反映临床患者异质性的动物模型,对于开发出对老年及伴有合并症人群有效的干细胞疗法至关重要。
第三,干细胞本身的选择是核心决策。不同类型的干细胞,如神经干细胞(NSCs)、间充质干细胞(MSCs)和诱导多能干细胞(iPSCs),各有优劣。选择时需综合考量细胞来源、大小、免疫原性、分化潜能及致瘤风险(表1)。
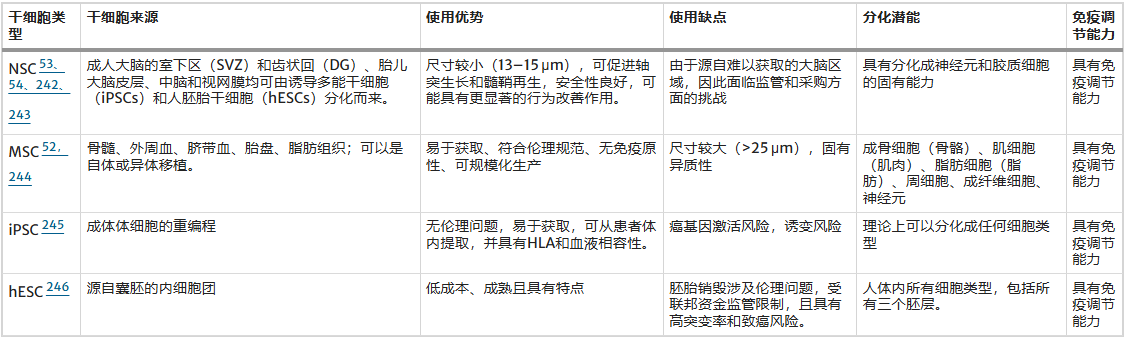
例如,NSCs有直接分化为神经细胞的潜力但来源有限;MSCs具有强大的免疫调节功能和良好的安全性,但细胞体积较大可能影响输送;iPSCs虽能自体移植但存在成瘤风险。同时,联合使用不同细胞(如MSCs与NSCs)可能通过协同作用增强疗效,但同时也需密切关注其安全性。
第四,治疗时机是决定疗效的重要因素。移植的时间窗口对干细胞发挥神经保护或促进修复的作用至关重要。研究表明,在急性期(如中风后24-72小时内)移植,可能通过稳定血脑屏障、调节炎症来获得最佳疗效;而过早(超急性期)的恶劣环境或过晚(慢性期)的瘢痕形成都会使治疗效果下降。确定最佳时机不仅能最大化干细胞存活与整合,也有望将治疗窗口延长至远超当前溶栓取栓的时间限制,具有重要的临床意义。
第五,干细胞的输送途径直接影响细胞分布和治疗效果。不同的给药方式,如静脉内、动脉内或颅内注射,各有特点。
- 动脉内注射能将细胞更直接地输送到病灶,分布更广;
- 静脉注射虽操作简便,但大量细胞会滞留于外周器官;
- 颅内注射虽定位精准但属有创操作。选择途径需权衡靶向性、细胞滞留率、侵入性和风险(如微血管阻塞)。
目前尚无公认的最佳途径,需要更多研究来阐明不同输送方法如何影响干细胞与免疫系统的相互作用及最终的功能恢复,图2展示了静脉注射、动脉注射和颅内注射三种给药途径的比较。
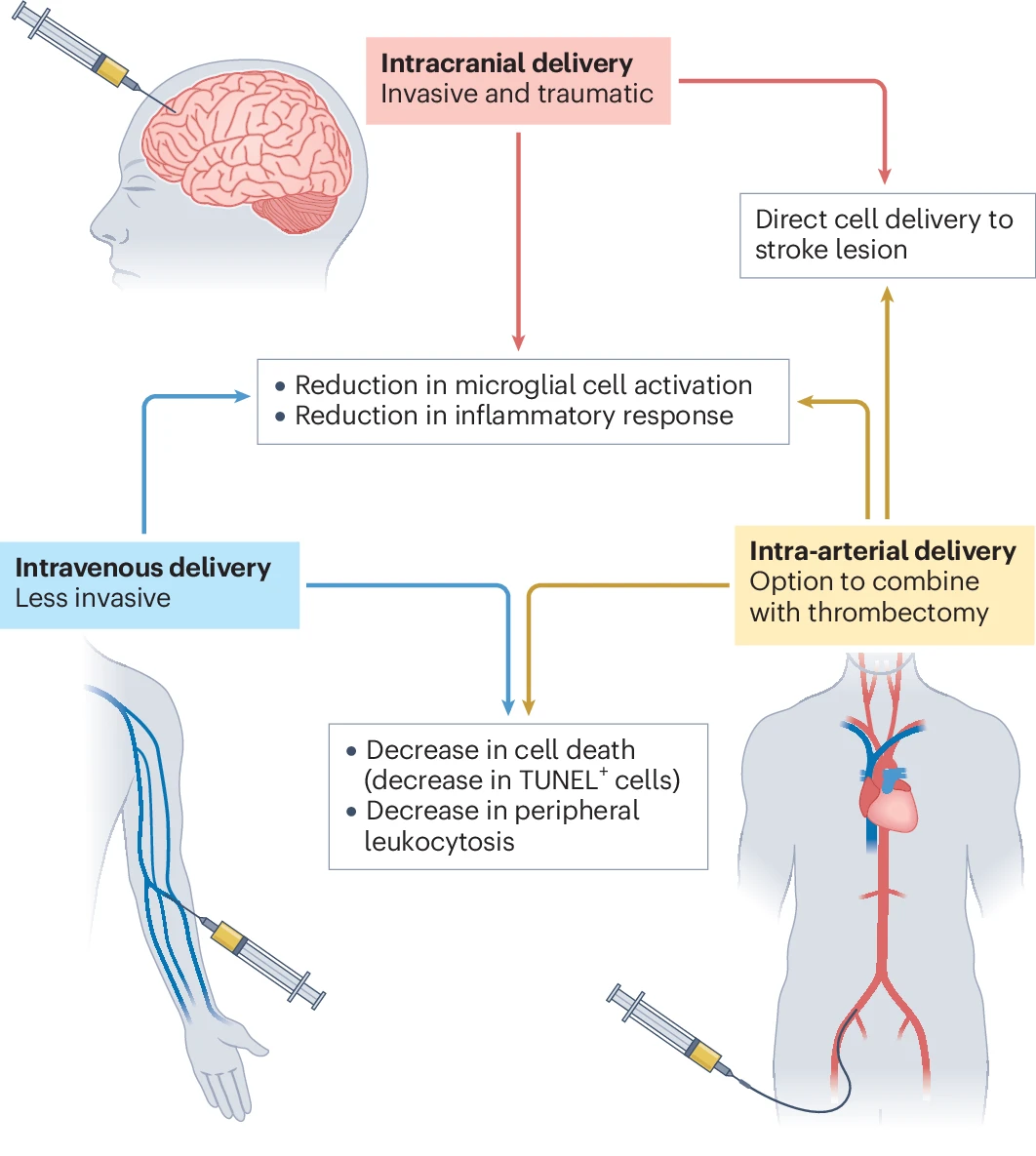
图2:几种干细胞输送方法的比较。示意图突出了脑卒中干细胞治疗中颅内、静脉和动脉内给药途径的益处和效果。
干细胞调节中风后炎症的机制及过程
干细胞通过多种复杂的机制,精确地调节中风后的炎症微环境,其过程可概括为以下几个关键方面:
1. 双向调节细胞因子,重塑炎症平衡
干细胞(包括NSCs和MSCs)最核心的作用之一是改变细胞因子的表达谱。它们通过自分泌信号以及调节局部和外周的免疫细胞,显著降低促炎细胞因子(如TNF、IL-6、IL-1β和IFN-γ)的水平,同时增加抗炎细胞因子(如TGF-β和IL-10)的表达。这种从促炎环境向抗炎环境的转变,是减轻神经损伤和启动修复过程的基础。
2. 抑制关键炎症通路与免疫细胞活化
干细胞能直接作用于炎症信号通路和免疫细胞。它们通过下调小胶质细胞和巨噬细胞中关键的促炎转录因子NF-κB以及酶(如诱导型一氧化氮合酶) 的表达,从源头上遏制炎症反应的放大。此外,源自MSCs的细胞外囊泡还能抑制巨噬细胞中NLRP3炎症小体的激活,从而阻断IL-1β等强效促炎因子的产生。
3. 减少外周免疫细胞的中枢浸润
为了遏制炎症细胞的“援军”,干细胞通过降低内皮细胞和炎症细胞表面的黏附分子(如ICAM1和VCAM1)以及趋化因子(如MCP1和MIP1α)的表达。这一行动削弱了白细胞与血管壁的粘附及向脑内迁移的信号,有效减少了中性粒细胞、淋巴细胞等外周免疫细胞穿越血脑屏障浸润至脑实质,减轻了继发性炎症损伤。
4. 提供神经营养支持与激活依赖性
除了直接的免疫调节,干细胞还通过分泌多种神经营养因子(如VEGF、BDNF、GDNF、IGF1等)来提供营养支持,促进神经元存活、血管生成和神经发生,这与其抗炎效应协同作用,共同改善功能恢复。值得注意的是,干细胞的免疫调节功能并非固有,而是一种“激活依赖性”行为。它们需要达到特定的炎症阈值(如高浓度的TNF和IFN-γ)才能被完全激活,转化为有效的抗炎状态。否则,在某些情况下甚至可能暂时加剧炎症。
5. 通过“旁观者效应”实现远程与局部微环境重塑
干细胞并不完全依赖于直接分化为神经元来发挥作用。更重要的是,它们通过分泌上述各种因子,在不直接替代丢失细胞的情况下,对其所处的局部及全身环境施加影响,这被称为“旁观者效应”。即干细胞在不直接替代丢失细胞的情况下影响其局部环境(图3)。表2总结了卒中后不同时间点神经干细胞(NSCs)和间充质干细胞(MSCs)的作用。
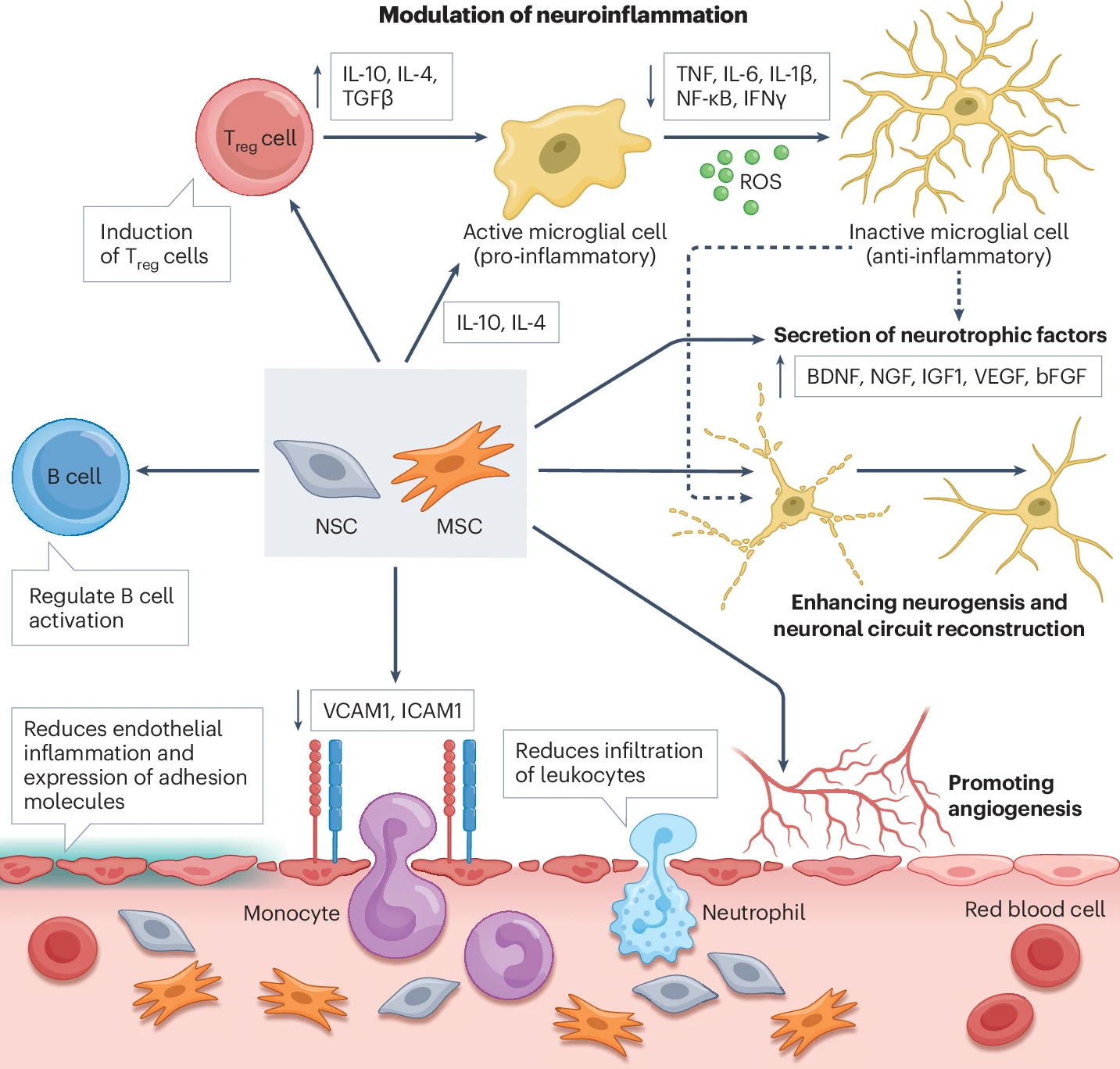
图3:干细胞治疗缺血性中风的潜在免疫机制概述。图示为神经干细胞 (NSC) 和间充质干细胞 (MSC) 治疗缺血性卒中的潜在机制。
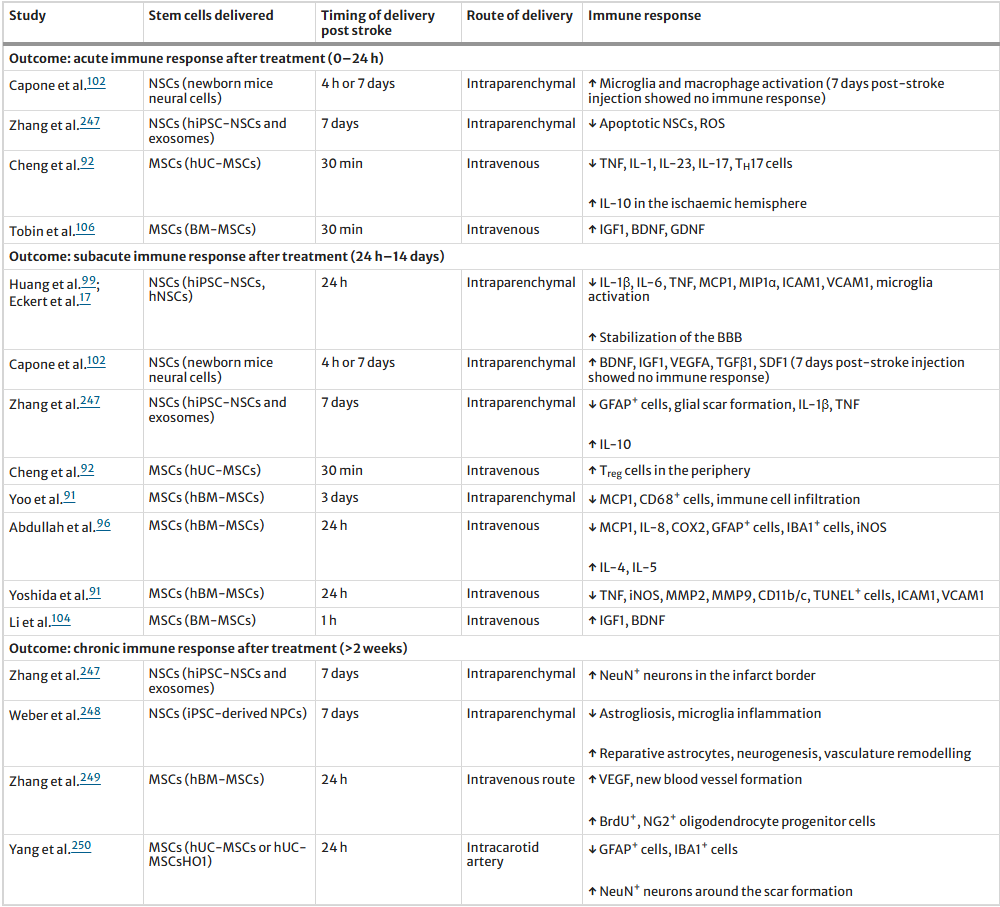
表2:干细胞移植的免疫反应
这一过程包括改变浸润免疫细胞的平衡、促使小胶质细胞从促炎的M1型向抗炎的M2型极化,甚至影响脾脏等外周免疫器官,从而实现对整个神经炎症网络的系统性调节,最终达到减少卒中体积和促进功能恢复的目的。
干细胞与免疫细胞在中风后炎症微环境中相互作用的机制与过程
一、干细胞与小胶质细胞/巨噬细胞:双向调节与表型重塑
干细胞疗法的一个核心作用是调节中枢神经系统的固有免疫细胞——小胶质细胞和浸润的巨噬细胞。
干细胞对小胶质细胞的调节:移植的干细胞(包括NSCs和MSCs)能够抑制小胶质细胞的过度活化,并促进其从促炎的“M1”表型向抗炎的“M2”表型转变。这一过程通过多种机制实现:
- 分泌可溶性因子:干细胞释放IL-10、TGF-β、前列腺素E2 (PGE2) 等信号分子,直接作用于小胶质细胞,下调其促炎因子(TNF, IL-6, IL-1β)的表达,并上调抗炎因子(IL-10, TGF-β)的水平。
- 直接接触:研究观察到干细胞与小胶质细胞之间存在直接接触,表明细胞间接触也可能介导这种调节作用。
- 抑制关键通路:干细胞及其细胞外囊泡能抑制小胶质细胞中NF-κB和NLRP3炎症小体等关键促炎信号通路的激活。
最终效果是减少白细胞浸润、稳定血脑屏障、减轻继发性损伤,并改善功能恢复。
小胶质细胞对干细胞的影响:这种相互作用是双向的。炎症性的小胶质细胞会通过释放促炎细胞因子来抑制内源性和移植干细胞的增殖与分化;而抗炎性的小胶质细胞则通过创造有利的微环境来支持干细胞的存活与神经发生。
二、干细胞与T淋巴细胞:调控适应性免疫反应
干细胞,尤其是MSCs,对中风后激活的适应性免疫系统,特别是T细胞,具有强大的调节能力。
- 调节T细胞功能与平衡:MSCs能够抑制T细胞的增殖和迁移,并影响其分化。在炎症环境下,MSCs可以促进免疫反应从促炎状态向抗炎状态转变,例如上调调节性T细胞 (Treg细胞) 的比例,并下调促炎的Th17细胞。它们还能诱导活化T细胞凋亡,从而精确控制炎症规模。
- 环境依赖性:MSCs对T细胞的调节作用高度依赖于发炎微环境。在没有炎症的情况下,MSCs甚至可能促进淋巴细胞存活,这凸显了其功能的复杂性。
- 对其他淋巴细胞的影响:MSCs还能通过调节B细胞的功能和树突状细胞的抗原呈递能力,间接抑制适应性免疫反应。
三、小胶质细胞:连接干细胞与T细胞的桥梁
小胶质细胞在干细胞和T细胞的相互作用中扮演着关键的“桥梁”角色。
- T细胞激活小胶质细胞:研究表明,缺乏T细胞的小鼠在中风后小胶质细胞的激活受损,梗死更大,这证明T细胞对于小胶质细胞发挥正常功能至关重要。
- T细胞指导小胶质细胞支持修复:特定的T细胞(如被IL-4或低水平IFN-γ激活的T细胞)可以“教育”小胶质细胞,使其转变为支持神经发生和少突胶质细胞生成的状态。
- 调节性T细胞 (Treg) 的核心作用:Treg细胞不仅能直接抑制小胶质细胞产生炎症因子,还能促进其向抗炎表型极化,从而创造一个有利于神经发生的微环境。
四、干细胞与调节性T细胞 (Treg) 的协同作用
干细胞和Treg细胞通过相互促进,产生强大的协同效应,被认为是极具前景的治疗策略。
相互激活,正反馈循环:
- Treg细胞激活干细胞:Treg细胞分泌的IL-10等因子可以诱导MSCs表达具有免疫抑制功能的吲哚胺2,3-双加氧酶 (IDO),从而增强其疗效。
- 干细胞扩增Treg细胞:MSCs可以通过接触依赖等方式,诱导常规T细胞表达FOXP3成为Treg细胞,或促进现有Treg细胞的存活与增殖。
联合治疗的卓越效果:在创伤性脑损伤模型中,MSCs和Treg细胞联合治疗比单一疗法效果更佳。它能更有效地降低促炎细胞因子(IFN-γ, TNF),同时上调多种抗炎介质(PGE2, AREG),形成协同效应,更强地抑制小胶质细胞活化和整体炎症。
五、脾脏:全身性干细胞治疗的关键作用靶点
脾脏作为外周免疫细胞储存库,在卒中后炎症中起核心作用,也是全身给药干细胞的重要作用位点。
- 脾脏的炎症放大器作用:中风后,脾脏会迅速收缩,将大量NK细胞、T细胞和单核细胞释放入血,进而浸润大脑,加剧神经炎症。
- 干细胞的“脾脏靶向”效应:静脉或动脉注射的干细胞(尤其是MSCs)大部分会短暂滞留于脾脏。这些细胞在脾脏凋亡或被吞噬后,可系统性调节免疫反应,例如降低脾脏和大脑中的促炎细胞因子水平。这种远程调控解释了为何全身性干细胞给药虽脑内定居率低,却能产生显著抗炎和治疗效果。
总结:干细胞通过一个复杂的网络调节中风后的炎症微环境。它们不仅直接与固有免疫细胞(小胶质细胞/巨噬细胞)和适应性免疫细胞(T细胞,尤其是Treg细胞)进行双向通信,还通过作用于脾脏等外周免疫器官来实施系统性调节。其中,干细胞与Treg细胞的协同作用,以及小胶质细胞作为连接各方的桥梁,是驱动炎症消退和组织修复的关键机制。深入理解这些相互作用对于优化联合治疗策略至关重要。
干细胞治疗中风的临床试验数据
已有超过50项临床试验研究了干细胞疗法在卒中治疗中的应用,其中一小部分(但数量正在增长)评估了炎症反应。
值得注意的是,2017年,一项II期MASTERS试验(Multistem在急性卒中治疗中促进康复)采用静脉注射多能成体祖细胞,结果显示免疫调节作用显著:与安慰剂组相比,治疗组患者在第7天时循环CD3⁺T细胞和血清促炎细胞因子(TNF、IL-6和IL-1β)水平降低,支持其具有全身抗炎作用。
多能成体祖细胞治疗急性缺血性卒中的安全性和有效性(MASTERS):一项随机、双盲、安慰剂对照的II期试验
相比之下,两项针对急性缺血性卒中患者的早期I期研究——2025年,一项采用静脉注射人脐带血来源细胞,结果表明静脉注射人脐带血对AIS患者安全且耐受性良好,初步疗效结果证明了其治疗潜力,支持未来开展随机、安慰剂对照的II期临床试验。
2023年,另一项采用同种异体人羊膜上皮细胞——并未报告细胞因子水平的变化;然而,这两项研究均缺乏安慰剂对照,且存在方法学上的局限性,无法进行可靠的免疫评估。
最近,2025年,一项针对急性缺血性卒中患者的脐带间充质干细胞(MSCs)静脉注射试验报告称,体外培养中TH17/Treg细胞平衡得到恢复,推测是通过MSCs的线粒体转移实现的。

脐带间充质干细胞通过线粒体转移减轻急性缺血性卒中中的T细胞区室转移和Th17/Treg失衡
这些研究强调了MSCs的免疫调节能力;然而,对神经干细胞(NSC)驱动的免疫效应的临床评估仍然有限。
目前的临床数据表明,干细胞疗法可以调节卒中后的免疫功能,但其全面的临床结果和机制仍有待证实。未来试验需采用随机、安慰剂对照设计,进行系统免疫分析,以阐明免疫调节机制并优化治疗策略。正在进行的研究如AMASCIS-02和RESSTORE均计划进行免疫监测,有望提供更可靠证据。
结论与未来方向
结论:本综述阐明了干细胞疗法通过与小胶质细胞、T细胞等免疫细胞进行双向通讯,来调节中风后免疫反应、促进神经修复的核心机制。
简而言之,如果将中风后的修复过程比作一场重建城市的战役:
- 干细胞是运筹帷幄的 “总指挥” 和 “首席建筑师” ,它不直接搬砖砌墙,而是制定蓝图、派发指令、调和矛盾,引导整个重建工作走向正轨。
- 免疫细胞则是前线的一线 “工人”和“士兵” ,它们既可以是被煽动的“暴徒”进行破坏,也可以在正确指挥下转变为辛勤的“建筑师”和“警察”,执行具体的清理、建设和维稳任务。
因此,干细胞治疗中风的精髓,在于利用干细胞卓越的免疫调节能力,去“教化”和“驾驭”体内的免疫细胞,将它们从疾病进展的“帮凶”转变为组织修复的“功臣”。
尽管干细胞疗法展现出广阔前景,但其临床转化面临四大挑战:对干细胞在动态免疫微环境中行为的理解有限、缺乏可靠疗效生物标志物、需要更优模型评估不同输送途径的影响、在现实人群中的剂量时机和免疫原性难题。
未来研究正迈向精准化和工程化:利用病毒条形码、空间转录组学和PET成像等高分辨率解析细胞相互作用;通过基因工程改造免疫细胞、开发工程化外泌体与生物材料、利用脑类器官与3D生物打印等前沿模型精确操控免疫反应;探索预处理策略增强干细胞功能。这些策略共同致力于克服转化障碍,最终实现靶向炎症、时间窗灵活且疗效确切的卒中干细胞治疗。
主要参考资料:[1]McMillan, N., McMillan, A., Kiliaan, P. et al. Stem cell-mediated recovery in stroke: partnering with the immune system. Nat. Rev. Neurosci. (2025). https://doi.org/10.1038/s41583-025-00985-4
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复