脊髓损伤 (SCI) 会导致局部神经元死亡,以及连接大脑和脊髓的上行和下行轴突的断裂。自一个多世纪前Ramon y Cajal的开创性研究以来,人们已认识到成人中枢神经系统 (CNS) 严重损伤的轴突无法自发再生,这常常导致永久性功能障碍,包括损伤平面以下的运动、感觉和自主神经功能。
目前尚无获批的临床治疗方法,可用于急性保护脊髓损伤后的神经元和轴突或促进其再生,这是一个巨大的未满足的医疗需求。
神经干细胞研究领域的最新进展为脊髓损伤(SCI)的潜在治疗方法开辟了新的途径。通常,神经干细胞疗法为脊髓损伤(SCI)的治疗提供了三种潜在机制:
- (1) 通过移植分化为中间神经元的神经干细胞(NSC)来“重新连接”受损的轴突通路,这些中间神经元可在损伤部位充当神经元的中继;
- (2) 通过移植NSC衍生的少突胶质细胞前体细胞(OPC),使损伤部位周围剩余的宿主轴突进行髓鞘再生;
- (3) 如果在损伤后足够早地注射NSC,则可以提供神经保护。
神经干细胞移植治疗脊髓损伤:2025修复机制解析、临床试验突破与转化前景
2025年7月2号,美国加州大学圣地亚哥分校神经科学系在国际权威期刊杂志《Translational Neuroscience》发表了一篇“神经干细胞治疗脊髓损伤”的文献综述。[1]

该综述研究表明:神经干细胞或神经祖细胞 (NPC) 移植到严重脊髓损伤 (SCI) 部位后能够存活,分化为神经元和神经胶质细胞,并延伸出大量轴突,延伸至相当长的距离,以便与损伤部位下方的宿主神经元建立连接。反过来,宿主的轴突会再生到NSC/NPC移植物中,并与移植物来源的神经元形成突触连接。
因此,NSC/NPC移植物来源的神经元可以作为神经元中继,重建损伤部位的神经传递,即使在严重SCI后也能改善功能结局。
神经干细胞(NSC)的分离和特性
神经干细胞的定义、起源与基本特性:神经干细胞 (NSC) 是神经系统的早期干细胞,具有自我更新能力,可分化为神经元和神经胶质细胞(图1)。它们主要来源于胚胎干细胞(存在于囊胚内细胞团),在特定转录因子作用下,外胚层的一部分胚胎干细胞会分化为多能神经干细胞,定位于神经管。NSC在发育过程中存在时间因物种而异,会快速扩增并构建原始神经系统。
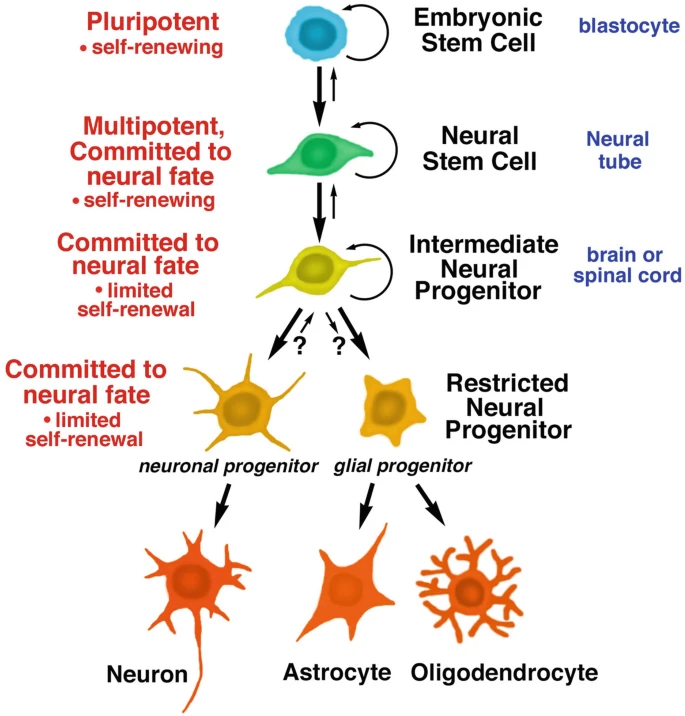
图1:胚胎干细胞和神经干细胞的发育阶段。所有干细胞都具有分裂和自我更新的能力;子细胞可以分化成特定的谱系,包括神经干细胞、神经祖细胞,进而分化成神经元和神经胶质细胞。
神经干细胞的分化路径与特殊类型:经历多次分裂后,NSC进入中间阶段成为神经祖细胞,其自我更新能力受限。这些祖细胞分化为两种限制性前体:神经元限制性祖细胞(只产生神经元)和神经胶质细胞限制性祖细胞(只产生星形胶质细胞和少突胶质细胞)。
最终,这些前体细胞停止分裂,成熟为特定细胞类型。此外,胚胎尾部存在一种独特的双能祖细胞——神经中胚层祖细胞(NMP),可同时分化为神经谱系(如脊髓祖细胞、神经嵴细胞)和中胚层谱系。
神经干细胞在疾病治疗中的应用潜力:目前已有成熟方案可诱导培养的NSC分化为特定功能的成熟细胞类型用于细胞替代治疗。例如,可诱导产生多巴胺能神经元治疗帕金森病、纹状体中间神经元治疗亨廷顿舞蹈症、皮层神经元治疗中风。
NSC也可被诱导分化为少突胶质细胞,用于治疗髓鞘形成障碍性疾病。一些基于NSC的治疗策略(如多巴胺能神经元治疗帕金森病)已进入临床试验阶段。
针对脊髓损伤的神经干细胞治疗策略:在脊髓损伤(SCI)治疗中,主要探索两种NSC策略:
- 一是移植多能NSC,期望其在损伤部位分化并替代神经元、星形胶质细胞和少突胶质细胞,形成新的神经连接;
- 二是移植已定向分化的少突胶质细胞祖细胞,旨在为残留的宿主轴突重新形成髓鞘以恢复部分功能。
第三种潜在机制是移植细胞分泌神经保护因子(如生长因子),在损伤早期起保护作用。
治疗脊髓损伤的神经干细胞从哪里来?
神经干细胞的多样化来源:早期研究主要使用来自发育中脊髓或脑的NSC或组织。如今,NSC及其衍生物有了更广泛的替代来源:
- (1) 直接从胚胎干细胞分化而来;
- (2) 来自诱导多能干细胞(iPSC,由成熟体细胞经重编程获得);
- (3) 使用特定转录因子组合将体细胞直接重编程为NSC。
这些不同来源为研究和治疗提供了更多选择,下文将对这些细胞来源进行更详细的介绍。

表1:神经干细胞和神经祖细胞的来源
01、从发育中脊髓直接分离的神经干细胞
在啮齿动物胚胎发育的第11至18天或人类胚胎发育的第8至10周,可以直接从发育中的脊髓分离出神经干细胞(NSC)和正在向神经元或胶质细胞定向分化的祖细胞。
这类细胞的关键优势在于其具有脊髓特异性的细胞命运,即倾向于分化为适合脊髓环境的细胞类型(如脊髓兴奋性中间神经元),这对于在脊髓损伤(SCI)部位重建功能性神经突触中继至关重要。基于此优势,这类源自发育中脊髓的NSC已在临床试验中用于治疗肌萎缩侧索硬化症(ALS)和脊髓损伤。
02、胚胎干细胞(ESC)向神经干细胞的转化
胚胎干细胞(源自囊胚内细胞团)具有分化为包括神经干细胞在内几乎所有细胞类型的潜力。虽然人类和小鼠ESC系丰富,但常用SCI模型大鼠的ESC系却相对稀少。
利用ESC可以生成用于治疗的神经干细胞及其衍生物:早期研究曾生成少突胶质细胞祖细胞(OPC)用于轴突髓鞘再生,现在也能生成NSC用于神经元和胶质细胞的替代治疗。特别是,近期技术已能稳定地从人类ESC生成并在体外长期维持具有脊髓特性的NSC。
03、诱导性多能干细胞(iPSC)向神经干细胞的转化
2006年,山中伸弥团队首次通过特定转录因子重编程将成体细胞(如成纤维细胞)转化为诱导性多能干细胞(iPSC)。随后证实iPSC也能分化为神经干细胞,这为利用患者自体细胞来源的神经元和胶质细胞修复神经系统损伤带来了巨大希望。
目前,将iPSC诱导为NSC进行自体移植的策略已在日本进入针对脊髓损伤和肌萎缩侧索硬化症(ALS)的临床试验阶段。
04、体细胞直接分化为神经干细胞
近期,已开发出可直接驱动成熟(甚至“有丝分裂后”)体细胞类型分化为其他细胞类型的技术。
直接重编程的核心技术与过程:体细胞(如成纤维细胞、造血细胞)无需先逆转为多能干细胞状态,可通过特定转录因子组合(如Sox2、Klf4、c-Myc、Brn2、Brn4、E47/Tcf3、FoxG1)进行直接重编程,转化为神经干细胞 (NSC) 甚至成熟神经元。该过程通常从易于获取的体细胞(如皮肤活检来源的成纤维细胞)开始,在体外培养体系中诱导其表达这些关键转录因子。通过精确优化细胞培养基质、添加必要的生长因子和小分子化合物,并经过一段时间的体外培养(通常为1至2个月),最终可获得具有神经干细胞特性的细胞群体。
优势、应用与前景:这种直接重编程技术产生的神经干细胞(有时称为诱导性神经干细胞,iNSC),与胚胎干细胞 (ESC) 或诱导多能干细胞 (iPSC) 衍生的NSC以及源自发育中脊髓的神经祖细胞一样,都是脊髓损伤等疾病细胞治疗的潜在来源。其显著优势在于避免了多能干细胞阶段,可能缩短时间并降低致瘤风险,同时具备自体移植潜力(尤其当使用患者自身体细胞时)。
虽然这些不同来源的NSC在特性、表观遗传印记、安全性(如染色体稳定性)和最终分化潜能上仍需深入研究,但该技术为获得患者特异性神经干细胞用于修复(如分化为少突胶质细胞前体以促进髓鞘再生)提供了新的重要途径,相关临床应用正在探索中。
体内研究发现神经干细胞治疗脊髓损伤的三大作用机制
1.神经保护机制:神经干细胞(NSC)移植后可通过分泌神经营养因子(如VEGF、FGF-2)和调节免疫微环境发挥神经保护作用。研究表明,移植的NSC能在损伤早期(如伤后10天内)调节免疫细胞因子(如IL-1α、IL-6、IL-10),降低炎症反应和细胞死亡,促进血管生成,从而保护残留的脊髓组织并缩小损伤范围。这种保护作用为后续修复创造了更有利的微环境。
2.轴突髓鞘再生策略:针对脊髓损伤后残留轴突的功能恢复,研究重点聚焦于移植少突胶质细胞前体细胞(OPC)实现髓鞘再生。胚胎干细胞(ESC)或诱导多能干细胞(iPSC)分化的OPC被植入损伤区周边(而非损伤腔),可包裹宿主轴突形成髓鞘,减少空洞并改善神经传导。
例如,Tsuji团队在小鼠实验中证实iPSC来源的NSC能促进髓鞘再生和轴突生长,并已启动全球首个相关临床试验(jRCTa031190228),在患者伤后24天内移植人iPSC-NSC。
3.功能性神经中继重建:NSC的核心潜力在于分化为神经元后形成跨损伤区的”神经中继”。移植的NSC可分化成兴奋性中间神经元,替代丢失的神经元并充当”桥梁”,重新连接断裂的上下行神经通路。
同时,其分化的胶质细胞(如星形胶质细胞)可支持宿主轴突再生。这种结合神经元替代与回路重建的策略,旨在恢复运动感觉传导功能,是当前研究的重点方向。
神经干细胞移植治疗脊髓损伤的临床试验
NSC/NPC的临床试验始于20世纪90年代末,将人类胎儿脊髓组织移植到患有脊髓空洞症的SCI患者体内,主要目的是防止囊肿进一步扩大。该试验并未得出结论,也未报告功能恢复情况。此后,人们使用不同来源的神经干细胞进行了多项I/II期临床试验。
所有这些研究的主要目的是使初次损伤后保留的轴突重新髓鞘化,并可能保护剩余的脊髓组织免于继发性退化。这些试验的基础是三大细胞来源。
1. 胚胎干细胞衍生的少突胶质细胞祖细胞(OPC)的临床试验
2011年,源自人类胚胎干细胞(ESC)的少突胶质细胞祖细胞(OPC)是首个治疗脊髓损伤人体试验的ESC衍生细胞产品。
2012年,Geron公司赞助了一项评估人类胚胎干细胞疗法的首次人体临床试验。该实验是针对5名胸椎SCI患者的初始I期研究,并证明了其安全性。
2022年,在一项少突胶质细胞祖细胞治疗亚急性颈脊髓损伤患者的1/2a期剂量递增研究中(NCT02302157,25名颈椎损伤患者)。

结果清晰地证明了其安全性,同时表明几乎所有患者都能恢复一个节段的神经功能,三分之一的患者至少能恢复一侧的两个节段的神经功能。该研究提供了宝贵的信息,可用于评估干细胞治疗亚急性SCI的后续步骤。
2. 胎儿脑神经干细胞(HuCNS-SC®)的研究与终止
Stem Cells Inc.公司基于胎儿脑神经干细胞(NSCs)开展了两项临床试验:首项针对12例胸椎损伤(NCT01321333),第二项计划纳入31例慢性颈椎损伤患者(NCT02163876)。研究显示移植细胞总体安全,但功能改善效果未达到预设阈值,导致项目提前终止,公司最终停止了脊髓损伤研究计划。这一结果凸显了胎儿源干细胞在促进显著功能恢复方面的局限性。
3. 胎儿脊髓神经干细胞(NSI-566)及其他进行中试验
2018年,进行了一项神经干细胞移植治疗慢性脊髓损伤的首次人体I期研究,测试了人脊髓源性神经干细胞 (NSI-566) 移植治疗慢性脊髓损伤 (SCI) 的可行性和安全性。

神经干细胞移植治疗慢性脊髓损伤的首次人体I期研究
在本临床试验中,四名T2-T12脊髓损伤 (SCI) 患者接受了治疗,包括移除脊柱内固定物、椎板切除术和硬脊膜切开术,随后进行六次中线双侧立体定向注射 NSI-566 细胞。所有受试者均对手术耐受良好,迄今为止(移植后18-27个月)未出现严重不良事件。
在两名受试者中,使用ISNCSCI运动和感觉评分检测到一至两个级别的神经功能改善。我们的研究结果支持 NSI-566 移植至脊髓损伤部位的安全性,并且其中三名受试者的早期潜在疗效迹象值得在剂量递增研究中进一步探索NSI-566细胞。
- 神经干细胞移植治疗脊髓损伤的长期临床疗效如何?安全性怎么样?
2025年1月,来自加利福尼亚大学等研究机构的科学家们,经过五年的临床跟踪研究,在《Cell Reports Medicine》期刊上发布了题为《Long-term clinical and safety outcomes from a single-site phase 1 study of neural stem cell transplantation for chronic thoracic spinal cord injury》的研究报告,研究者取得了一些令人鼓舞的成果:

神经干细胞移植治疗慢性胸椎脊髓损伤的单中心 I 期临床研究的长期临床和安全性结果
移植安全性得到验证:四名患者在手术后均耐受良好,没有出现严重的不良反应(SAEs)。尽管其中一名患者因术后并发感染去世,但整体来看,神经干细胞移植在短期和长期内都表现出较高的安全性。
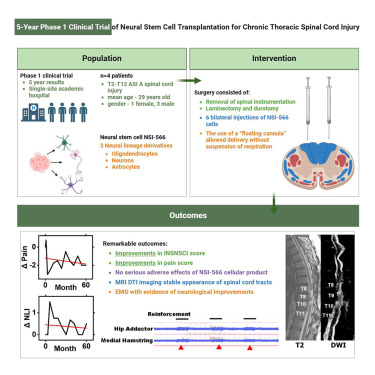
神经运动功能和感觉功能得到改善:研究报告显示,4例受试者均能良好地耐受干细胞移植手术,其中2例受试者在移植后5年内,获得了持久的肌电图量化神经功能改善证据,且神经运动和感觉评分有所提高。另外两项尚未公布结果,韩国一项研究使用ESC衍生的PSA-NCAM阳性神经前体细胞(NCT04812431),以及日本一项研究将iPSC衍生的神经干细胞移植至亚急性患者,目前尚未公布结果。
4. 共同挑战与未来方向
上述试验均采用在损伤区周边(或部分侵入损伤腔)注射细胞的策略,且均未联合生长因子支持移植细胞存活。研究表明,缺乏生长因子可能导致移植物在损伤核心难以长期存活。尽管所有试验因样本量小无法验证疗效,但一致证实了干细胞/祖细胞移植的基本安全性。未来需优化细胞递送策略、结合神经营养因子或生物材料,并在更大规模试验中验证功能恢复效果。
神经干细胞治疗脊髓损伤的未来展望
移植神经干细胞 (NSC) 的轴突生长及其与宿主神经元的重新连接为脊髓损伤 (SCI) 的治疗带来了希望。我们的方法旨在在损伤部位形成修复性神经中继。我们相信,我们的方法已经成熟,值得进行临床试验。
核心策略与临床转化潜力:神经干细胞(NSC)移植的核心目标是通过在损伤部位构建功能性神经中继,促进新生轴突生长并与宿主神经元重新连接。这一策略已从临床前研究发展到成熟阶段,具备开展人体临床试验的条件。
未来工作将聚焦于优化移植方案,例如将NSC与生物工程支架结合,以引导轴突定向延伸并形成更精确的神经回路连接;同时,通过递送神经营养因子或轴突导向分子(如Netrin、Slit等),可特异性引导移植物轴突靶向宿主的运动控制区域,提升神经中继的精准性和功能效率。
增效技术与协同挑战:进一步增效策略包括:
①在移植物中富集兴奋性神经元(如脊髓V2a中间神经元),增强下行运动信号传导能力;
②通过抑制宿主PTEN基因等途径,激活成年轴突的再生潜能,促进其与移植神经元的整合;
③结合定制化康复训练与硬膜外电刺激,强化新回路的可塑性和功能适应性。
然而,需警惕轴突”过度生长”可能导致异常神经连接的风险。当前领域已突破”能否再生”的瓶颈,正迈向”如何精准引导再生”的新阶段——优化神经生长的方向性、安全性与功能整合,是未来临床试验的核心挑战。
参考资料:[1]:Lu, P., Sinopoulou, E., Rosenzweig, E.S., Blesch, A., Tuszynski, M.H. (2025). Neural Stem Cells for Spinal Cord Injury. In: Tuszynski, M.H. (eds) Translational Neuroscience. Springer, Cham. https://doi.org/10.1007/978-3-031-89307-0_14
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复