渐冻症(ALS)是一种进行性神经元疾病,患者的运动神经元逐渐受损甚至死亡,导致肌肉萎缩、行动受限、言语和吞咽困难,最终可能影响呼吸。确诊后,目前还没有根治的方法,患者多数只能依靠康复训练和对症支持来维持生活质量,病程发展快,生活压力极大。
近年来,随着干细胞技术的发展,科学家们看到了新的希望。不过,从全球来看,这一领域的发展并不均衡。不同国家在技术成熟度、临床试验规模和应用落地方面存在差距,这直接影响患者能否尽快获益。
那么,同样是研究干细胞治疗渐冻症,2025国内外干细胞治疗渐冻症的临床进展对比,国内外技术到底谁更靠谱?截止今日咱们是跟国外差一大截?还是偷偷弯道超车了变成我们领先了?接下来我们就从双方的最新的临床研究进展和突破,来看看各方的现状和潜力。

全球视角:2025国内外干细胞治疗渐冻症的临床进展对比
一、国际前沿:2025全球ALS干细胞治疗技术进展
1.1 美国:NurOwn® 3b期临床试验,延长ALS患者生存期的突破性探索
2025年5月19日,美国BrainStorm Cell Therapeutics Inc. 公司宣布,美国食品药品监督管理局 (FDA) 已批准该公司启动NurOwn®(自体MSC-NTF细胞)治疗肌萎缩侧索硬化症 (ALS) 的3b期临床试验。 [1]

之前纳入的10名患者均已完成公司III期临床试验数据显示:
干细胞治疗后90%的参与者(9/10)在出现ALS症状后存活超过五年,而现在已发表的传统治疗方法数据,只有约有10%的ALS患者存活超过五年。
该队列的中位生存期从症状出现起达6.8年(范围6-7年),该队列中唯一一例死亡病例发生在选择性安乐死之后。
若以已发表的传统治疗数据估计约10%的 ALS 患者可存活超过五年,那么在独立随机抽样的假设下,观察到9/10这类结果的概率非常极小——约为9.1×10⁻⁹(约 0.00000091%),这说明单纯由随机波动导致如此高比例的可能性几乎可以忽略不计。
BrainStorm Cell Therapeutics 总裁兼首席执行官Chaim Lebovits表示:“这些生存数据为接受NurOwn扩大可及性治疗的ALS患者的长期疗效提供了令人鼓舞的真实洞察。我们相信,这些发现为开展的NurOwn 3b期临床试验提供了进一步的证据,该试验将根据FDA特殊方案评估 (SPA) 进行。我们的目标仍然是生成高质量、确凿的数据,以证明NurOwn对ALS患者的益处。”
作为BrainStorm公司的核心项目,NurOwn®已获得FDA与EMA的孤儿药资格,若启动的3b期试验数据理想,有望通过加速审批通道提前上市。
1.2 韩国:Neuronata-R® Ⅲ期试验,剂量依赖性疗效显著改善ALS功能与呼吸能力
2025年5月29日,韩国Corestemchemon公司宣布其研发的干细胞疗法Neuronata-R(lenzumestrocel)在Ⅲ期治疗渐冻症的临床试验中取得关键进展。[2]

Neuronata-R®(商品名:lenzumestrocel)是韩国生物科技公司CorestemChemon研发的自体骨髓间充质干细胞(MSC)疗法,专为治疗肌萎缩侧索硬化症(ALS)(俗称“渐冻症”)设计,旨在利用自体MSC的治疗潜力来解决该疾病复杂的病理机制。
该疗法通过提取患者自身骨髓中的MSCs,在实验室中扩增并诱导其分泌神经营养因子,最终通过鞘内注射回输至患者体内,旨在修复受损运动神经元、延缓疾病进展并改善患者生活质量。
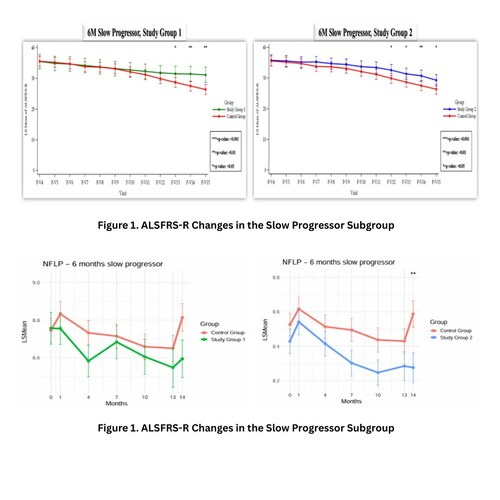
Neuronata-R®在Ⅲ期临床试验中对疾病进展缓慢的ALS患者展现出显著疗效。根据最终临床研究报告(CSR):
1.关键疗效指标改善
CAFS(功能与生存综合评估):
- 两剂量组(第1组)在治疗第6个月时CAFS评分显著优于安慰剂(20.95vs13.66);
- 五剂量组(第2组)改善更显著(24.78vs17.92)。
ALSFRS-R功能评分:五剂量组在第9个月即实现统计学显著改善,较两剂量组(第10个月)提前一个月。
2.呼吸功能(SVC)显著提升:五剂量组在治疗第8个月起SVC评分显著优于对照组,提示可能延缓呼吸功能衰退。
3.剂量依赖性效应:五剂量组的NfL水平(神经丝轻链)在第4个月和第10个月均显著低于安慰剂组,进一步支持其剂量依赖性疗效。
4.首次披露的深度分析:CSR首次全面解析了CAFS和SVC数据,其中SVC作为ALS呼吸功能衰退的临床关键指标,其改善意义重大。
总结:Neuronata-R®在进展缓慢型ALS患者中展现出明确的剂量依赖性疗效,核心指标(CAFS、SVC、NfL)均支持其通过生物标志物驱动的加速审批路径。
1.3 沙特阿拉伯:脐血干细胞疗法,可规模化生产的创新ALS治疗模式
2025年5月,德克萨斯A&M大学的一位教授与沙特阿拉伯签署了美国首个医学临床试验协议,推进了治疗再生障碍性贫血、肌萎缩侧索硬化症和其他疾病的潜在突破性细胞疗法的研究。[3]

德克萨斯农工大学系统官员上周宣布,Cellenkos将在利雅得的医疗中心开展两项针对再生障碍性贫血和移植物抗宿主病的临床试验。随后,该技术还将开展针对肌萎缩侧索硬化症 (ALS) 和心血管疾病的试验。
该技术利用从脐带血中提取的特殊细胞来治疗炎症,而且这种疗法可以大规模生产,无需个体化供体匹配。
临床数据方面,该团队已用该技术治疗80余名患者,涵盖ALS、再生障碍性贫血、骨髓纤维化等疾病,证实疗法安全有效。其中,FDA通过 “同情用药” 批准治疗6名ALS患者,部分患者已接受22次每月输液;后续又批准对另外6名患者开展试验。
2025年4月,《新英格兰医学杂志证据》(NEJM Evidence)刊发文章,记录患者病情在稳定方面的改善;另有期刊文章提及,再生障碍性贫血患者经一次输液后,最长3.5年无需输血和血小板。
德克萨斯A&M大学创新顾问委员会主席乔・坎宁安评价:“这是前景光明的技术,早期迹象显示对ALS等疾病患者疗效良好,我们期待深入研究。”
1.4 格鲁吉亚:MSC移植病例研究,功能改善与病情稳定的新证据
2025年3月29日,格鲁吉亚第比利斯解剖学研究与技能中心在《PREMIER JOURNAL OF CASE REPORTS》杂志上发表了一篇名为《自体间充质干细胞移植治疗肌萎缩侧索硬化症:一例病例报告》的研究成果。[4]
本研究评估了MSC移植对一名52岁ALS患者的安全性和治疗潜力,并评估了患者功能变化和病情进展。患者接受了两次 MSC移植,分别通过鞘内和静脉给药。治疗后5个月内进行了临床评估、肌电图 (EMG) 和ALS功能评定量表修订版 (ALSFRS-R) 评估。
移植后患者运动功能得到改善,肢体活动能力增强,吞咽功能改善。ALSFRS-R评分(ALS患者通常会下降)显示
提高了15%,提示病情可能稳定。肌电图显示,尽管运动神经元持续退化,但感觉纤维仍得以保留。未观察到严重的不良反应。
这些发现表明,间充质干细胞(MSC)可能对ALS患者具有疾病修饰作用,带来功能和情绪方面的益处。
二、国内前沿:2025年国内干细胞治疗技术进展
2.1 iPSC-MNP干细胞药物获中美双重认可:迈入ALS临床研究新阶段
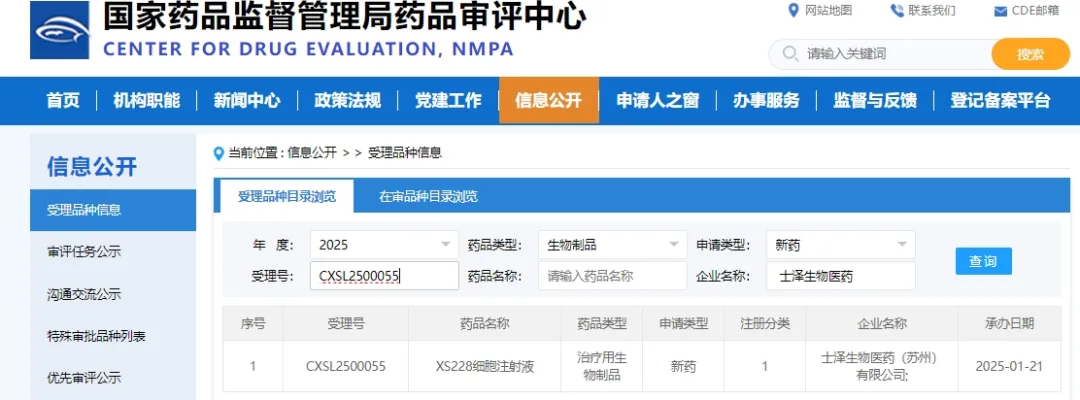
2025年2月,来自中国的生物制药公司士泽生物自主研发的干细胞治疗药物获得了美国食品药品监督管理局(FDA)的正式批准,将在美国开展针对肌萎缩侧索硬化症(ALS),即渐冻症的注册临床试验。
并且该药物已经同步获得我国国家药品监督管理局(NMPA)的正式受理,意味着国内患者未来也有望受益于这一前沿疗法。(中国注册临床I/II期及美国注册临床I期)
3月,该产品我国临床试验患者已成功入组,为后续大规模研究奠定基础。[5]
此次获批的干细胞新药,核心技术来源于诱导多能干细胞(iPSC)。iPSC技术可以将普通体细胞(如皮肤细胞)“逆转”为具有多能性的干细胞,再定向诱导其分化为神经前体细胞,用于修复受损神经元。
iPSC治疗渐冻症的核心原理:1.修复受损神经元,帮助恢复运动功能;2.延缓疾病进展,提高患者生存质量;3.从根源上改善病情,而非仅仅缓解症状。
该款药物的临床前研究和初步试验显示,安全性和有效性方面取得了令人鼓舞的结果,在超过12个月的临床随访表明在延缓病情发展上展现出了巨大潜力。
2.2 第三届细胞治疗临床研究研讨会:ALS临床数据首次披露,疗效可期
2025年9月5日至7日,由中国医药生物技术协会主办,再生医学专委会、临床研究专委会和医药生物技术临床应用专委会承办的第三届细胞治疗临床研究研讨会在北戴河新区顺利召开。[6]
来自全国三甲医院、科研院所及生物医药企业的50多位顶尖专家带来了30余项首次披露的人体临床数据,绕细胞治疗政策环境、临床研究进展、技术创新与转化应用等前沿议题展开深入研讨。

在这次会议上,公布的干细胞成果涵盖了从糖尿病、心脏病到帕金森、渐冻症,甚至膝关节炎、溃疡性结肠炎、慢性肾病、缺血性脑卒中等多个难治性疾病的最新临床数据。
其中关于渐冻症方面的,士泽生物XS228注射液(iPSC-MNP)的早期随访(7.5个月)显示3例患者呼吸功能下降率得到逆转,无严重毒性并获孤儿药资格认定,提示潜在疗效与可耐受性。
2.3 干细胞衍生物ALT001获CDE受理:开创无细胞ALS治疗新范式
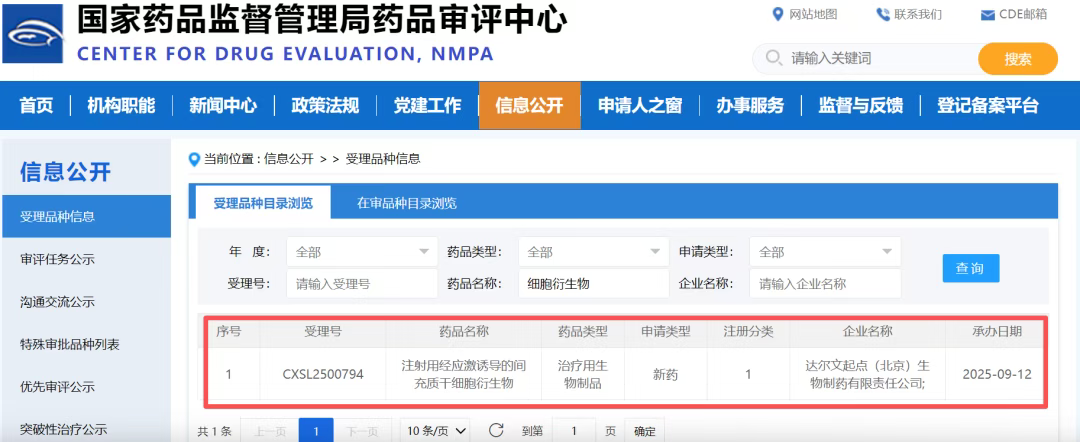
2025年9月12日,CDE官网显示,达尔文起点(北京)生物制药有限责任公司(达尔文细胞生物科技有限公司的全资子公司)自主研发的1类生物新药“注射用经应激诱导的间充质干细胞衍生物”(推测管线代号:ALT001)已正式获得国家药品监督管理局药品审评中心(CDE)的临床试验申请受理。[7]
该药物拟用于治疗肌萎缩侧索硬化(ALS,俗称“渐冻症”),标志着国内首款基于“应激间充质干细胞衍生物(PDSSCs)”技术平台的新药迈入临床开发阶段。
此次获批受理的ALT001依托达尔文生物自主创新的PDSSCs技术平台。该技术通过模拟特定生理或病理应激环境,激活间充质干细胞分泌多种具有神经修复功能的活性蛋白与外泌体,再经精密纯化工艺制备成“无细胞”的注射制剂。这一突破性路径摆脱了传统活细胞移植的局限,开创了“无细胞治疗”的新范式。
三大核心价值凸显创新优势:
填补临床治疗空白:目前针对ALS、阿尔茨海默病(AD)等神经退行性疾病尚无根治手段,现有疗法多以延缓疾病进展为主。ALT001凭借“多靶点协同修复神经网络”的作用机制,有望实现对已损伤神经功能的逆转,为患者带来全新希望。
推动无细胞疗法产业化落地:PDSSCs技术将干细胞治疗从“活细胞产品”升级为“标准化分泌型蛋白药物”,有效规避了细胞疗法在规模化生产、长期稳定储存、冷链运输以及潜在致瘤风险等方面的行业难题,显著提升了治疗产品的可及性与商业化潜力。
获资本与技术双重认可:从A轮到C轮,企业累计融资超5亿元,其中2025年,达尔文生物完成超2亿元C轮融资,由国家中小企业发展基金领投。此次融资不仅为ALT001的临床推进提供坚实支持,更反映出资本市场对“细胞衍生物药物”这一前沿赛道的高度认可与长期信心。
三、技术与产业的全方位对比
以下是基于当前公开信息和临床研究进展的干细胞治疗渐冻症(ALS)的国内外对比分析,主要聚焦于技术与产业层面的差距与特点:
| 对比维度 | 国际前沿 | 国内进展 |
|---|---|---|
| 技术路线 | 多元化探索:包括间充质干细胞、脐血干细胞、自体干细胞等方面。 | 快速跟进与聚焦创新:以异体通用型iPSC衍生亚型神经前体细胞为主,技术路径相对集中,但已在特定领域形成自身特色和优势。 |
| 临床进展阶段 | 领先且进入后期:如美国BrainStorm公司MSC疗法NurOwn已完成Ⅲ期试验(未达主要终点,已重启ⅢB期) | 突破与追赶:士泽生物全球首款iPSC衍生细胞药XS228注射液用于治疗渐冻症,于2025年相继获美国FDA和中国NMPA批准开展注册临床试验(I/II期),并已完成包括全球首例患者治疗在内的临床研究。 |
| 监管与审批体系 | 路径清晰成熟:美国FDA对细胞治疗产品有相对成熟的评审通道(如孤儿药资格认定、RMAT通道等),审批流程可预测性较强。 | 快速完善中:中国NMPA审批在加速,如士泽生物产品同期获NMPA受理乃至批准,但整体监管框架和审评经验仍在持续积累和探索阶段。 |
| 产业化与资本推动 | 资本强力驱动:由大型药企或获得充足风险投资的生物技术公司主导(如BrainStorm上市融资),投入巨大,目标明确指向全球市场上市。 | 科研与资本结合驱动:主要依靠顶尖高校、研究机构与企业协同推动,资本投入规模和产业链整合能力与国际巨头相比仍有差距,但近年来市场化融资活跃。 |
| 创新策略与解决方案 | 前瞻性布局:关注细胞替代和免疫豁免策略,旨在彻底解决免疫排斥问题。 | 聚焦细胞制备:创新主要集中在干细胞来源与分化技术,综合免疫调控方案布局较少。 |
| 国际合作与影响力 | 高度全球化:大型临床试验(如NurOwn、西达赛奈)多为全球多中心研究,数据具有全球代表性,并与各国监管机构密切沟通,旨在满足全球标准。 | 以国内研究为主,国际化步伐加快:重大进展目前主要基于国内团队和国内患者,但士泽生物产品获FDA孤儿药资格并获批在美临床,标志着国际化布局开启。 |
四、追赶与超越:我国的机遇与挑战
综上所述,虽然在干细胞治疗渐冻症领域,美国和韩国两项Ⅲ期临床试验进展上仍保持阶段性领先,但国内差距并不大。
技术方面,国内以iPSC及干细胞衍生物为代表的创新路线,能够规避传统干细胞技术的一些局限;政策方面,海南博鳌乐城先行先试经验正在逐步向全国推广,临床审批流程有望进一步提速。
因此,短期内我国更像是在“快速追赶并打好基础”。要实现真正的超越,需要把握三大关键环节:
- 技术标准化与放大生产:确保干细胞产品的质量稳定和可大规模应用。
- 全国临床网络建设:建立覆盖多中心、多患者群体的临床试验体系,以生成高质量、可对比的数据。
- 加强国际合作与数据互认:推动国内研究成果与国际标准接轨,提高全球认可度和影响力。
只要这些环节落实到位,我国在某些技术路径上有望实现“弯道超车”,并让研究成果更快、更安全地惠及ALS患者。
结语
对ALS患者而言,纠结国内外技术差距多大意义不大——重要的是全球科学家都在不断探索干细胞疗法的可能。无论美国、韩国先一步商业化,还是国内团队实现突破,最终受益的都是那些期待改善运动能力、延缓病程、提高生活质量的患者。每一次技术进步,都在将“改善ALS患者生存和生活”的梦想拉近现实一步。
参考资料:
[1]https://ir.brainstorm-cell.com/2025-05-19-BrainStorm-Receives-FDA-Clearance-to-Initiate-Phase-3b-Trial-of-NurOwn-R-for-ALS?utm_source=chatgpt.com
[2]https://www.prnewswire.com/news-releases/neuronata-r-stem-cell-therapy-shows-promise-in-als-phase-3-subgroup-analysis-moves-toward-fda-accelerated-approval-302468013.html
[3]https://www.houstonchronicle.com/news/houston-texas/education/article/texas-am-saudi-cell-therapy-20347290.php?utm_source=chatgpt.com
[4]https://premierscience.com/wp-content/uploads/2025/04/pjcr-25-812-1.pdf
[5]美国食品药品监督管理局
[6]https://www.sohu.com/a/933359460_121124527
[7]https://mp.weixin.qq.com/s/AmiMmEgnUoYYeNZQsiw3jQ
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复