腰椎小关节病(LFA)是与腰痛相关的最常见的特定疾病之一。然而,当前的常规治疗方法往往只能暂时缓解症状,长期疗效有限,这促使医学界将目光投向干细胞治疗椎间盘突出等退行性病变的再生医学领域。
在此背景下,美国梅奥诊所进行了一项题为“关节内注射异体骨髓间充质干细胞治疗疼痛性腰椎小关节病”的I期临床试验,其成果已在权威期刊《Stem Cell Research & Therapy》上发表[1]。该研究证实,关节内注射骨髓间充质干细胞治疗此类疾病具有良好的安全性。更令人鼓舞的是,初步疗效观察显示,该疗法能显著缓解背痛、改善身体功能,并延缓小关节的退行性病变。

这项里程碑研究不仅为腰椎小关节病患者带来了新希望,也进一步拓展了干细胞治疗椎间盘突出及相关脊柱退行性疾病的临床应用前景,为全球约5.4亿慢性腰痛患者开辟了全新的治疗方向。
一、 背景:未被满足的临床需求——腰痛困境与治疗局限
要理解此项研究的意义,首先需认识腰椎小关节病(LFA)带来的沉重疾病负担与当前的治疗困境。
腰痛的全球负担与腰椎小关节病:腰痛(LBP)是一种常见的慢性肌肉骨骼疾病,也是全球主要的致残原因之一,影响着约5.4亿人,并给社会经济和医疗保健系统带来沉重负担。尽管腰痛通常被归类为非特异性疼痛,但腰椎小关节病(LFA)是与腰痛相关的最常见的特异性疾病之一。
腰椎小关节病是一种退行性关节炎性肌肉骨骼疾病,会影响腰椎小关节(LFJs),这些关节是位于脊柱后方的成对滑膜关节。据估计,在因腰痛就诊的患者中,腰椎小关节病的患病率在15%至45%之间,凸显了其在临床上的重要性。
腰椎小关节病的病理生理机制:腰椎小关节病本质上是一种骨关节炎,涉及复杂的病理生理过程,不仅限于简单的软骨磨损。它还包括炎症反应、细胞信号传导改变以及整个关节和周围软组织(如滑膜和软骨下骨)的受累。
腰椎小关节由滑膜、透明软骨和纤维囊组成,共同维持脊柱稳定性和可控运动。然而,由于关节软骨缺乏血管、生物力学需求高且细胞活性有限,其自身修复能力较差,导致结构进行性退化,这给有效治疗带来了巨大挑战。
当前治疗的局限性与挑战:现行的标准治疗方案,如镇痛药、物理疗法乃至关节内注射和神经切断术,均侧重于短期症状管理,无法逆转关节的结构性损坏,长期疗效有限。这凸显了临床对能够从根本上修复组织、改变疾病进程的新疗法的迫切需求。
干细胞治疗腰椎间盘突出症,从对症处理到对因修复的新希望:间充质干细胞(MSCs)凭借其抗炎、免疫调节和促进组织再生的“药用信号细胞”特性,为治疗疼痛性腰椎间盘突出症提供了新思路。在膝骨关节炎等领域,MSCs疗法已展现出良好的安全性与疗效。
本研究旨在首次探索关节内注射异体骨髓间充质干细胞治疗疼痛性腰椎间盘突出症(LFA)的安全性与初步疗效。
二、 方法:严谨设计与精密操作——如何实施干细胞治疗
1、试验设计与监管框架:本研究是一项前瞻性、I期、单臂、开放标签、单剂量临床试验。试验方案已获得美国食品药品监督管理局(FDA)和梅奥诊所机构审查委员会的批准,并在ClinicalTrials.gov注册(NCT04410731)。所有参与患者在入组前均签署了书面知情同意书,整个试验过程严格遵循《赫尔辛基宣言》的伦理原则,并设立了独立的数据安全监察委员会(DSMB)以监控受试者安全。
2、受试者筛选与给药方案:试验招募了10名被临床诊断为慢性症状性腰椎小关节病(LFA)的患者。入选标准包括:年龄≥18岁、慢性轴性腰痛持续至少6个月、对至少3个月的保守治疗无效,并且通过腰椎小关节内侧支阻滞术确认疼痛缓解程度大于75%。
在给药策略上,前3名患者采用分批入组方式,每名患者注射后需经过两周的观察期,确认无严重不良事件后,再为下一名患者进行注射。所有患者均接受单次关节内注射,注射内容为1000万个同种异体BM-MSCs悬浮于1mL乳酸林格氏液,每个患者注射两个受累的小关节。
3、干细胞制备与注射操作:同种异体BM-MSCs来源于一名28岁健康女性捐赠者的骨髓,其生产过程在符合现行药品生产质量管理规范(cGMP)标准的人类细胞治疗实验室进行,并经过严格传染病筛查和质量控制。治疗当日,将冷冻的细胞解冻并重悬于乳酸林格氏液,制成指定浓度的细胞溶液,并在严格控制温度的条件下运送至手术室。
注射操作由主要研究者或其代表在透视引导下进行,采用标准技术。为确保BM-MSCs的活性和功能不受影响,研究团队采取了特殊措施:将局部麻醉剂(利多卡因)浅表注射至小关节而非关节腔内,并使用单独的注射器注射造影剂仅用于针头定位,避免其与BM-MSCs在关节腔内直接接触。
所有接受治疗的患者在注射后均观察60分钟,以评估即刻不良反应,随后出院。细胞的制备、处理和给药流程如图1所示。
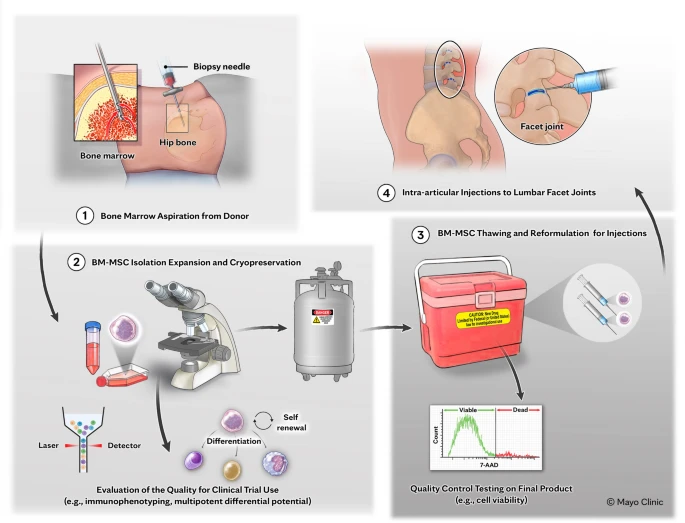
图1:骨髓间充质干细胞的生产、制备和管理
关节内注射异体骨髓间充质干细胞(BM-MSCs)治疗疼痛性腰椎小关节病的评估指标有哪些?
该临床试验的评估指标主要包括安全性和初步疗效两大方面。安全性是本研究的主要终点,通过严密监测不良事件(AE)和实验室检查来评估。
具体而言,研究人员记录了所有不良事件的性质、发生率和严重程度,并将其分为治疗后两周内发生的急性事件和两周后发生的延迟性事件。监测方式包括患者自发报告、医生访谈、病历审查及定期随访。同时,在治疗前的筛选期以及治疗后3、12、24个月时采集血样,进行全血细胞计数和基础生化指标检测,以全面评估治疗的安全性。
研究的次要终点侧重于疗效评估,涵盖患者主观感受、身体功能及影像学结构改变。患者报告结局是核心部分,采用视觉模拟评分法(VAS)评估腰痛程度,以PROMIS身体功能(PF)量表评估功能状态,并预设了最小临床重要差异。
此外,还综合评估了疼痛干扰、焦虑、抑郁、社会功能、疲劳、睡眠障碍、工作状态及阿片类药物使用情况。
在客观影像学方面,于治疗前及治疗后3、12、24个月进行腰椎MRI检查,由两位放射科医师独立评估关节积液、骨髓病变、水肿、骨赘及滑膜炎等关键结构变化,确保结果客观准确。
三、 结果:安全性与疗效的双重验证——数据驱动的积极成果
1. 安全性结果:治疗本身安全性良好
在10名患者中,共报告72例不良事件,绝大多数为轻微且与研究无关(如头痛、皮疹)。仅4例急性期事件与注射操作相关(局部疼痛、瘙痒)。所有3例严重不良事件(如膝关节置换术)均被评估为与研究无关。注射后血液检查均无异常,证实了治疗方案的良好安全性。
2. 疗效结果:疼痛、功能与结构的多维改善
疼痛与功能显著改善:根据研究结果,关节内注射异体BM-MSCs后,患者在疼痛和身体功能方面表现出显著且持久的改善。
在主要指标上,视觉模拟量表(VAS)评分显示疼痛大幅减轻:达到最小临床重要差异(即VAS评分降低≥50%)的患者比例,从治疗后3个月的33.3%迅速上升至6个月的75%,并在之后的12、18及24个月随访中稳定维持在66.7%的高水平。同时,身体功能也获得稳定恢复,在所有随访时间点中,均有55.6%的患者其PROMIS CAT身体功能(PF)评分达到并维持了具有临床意义的改善(图2)。
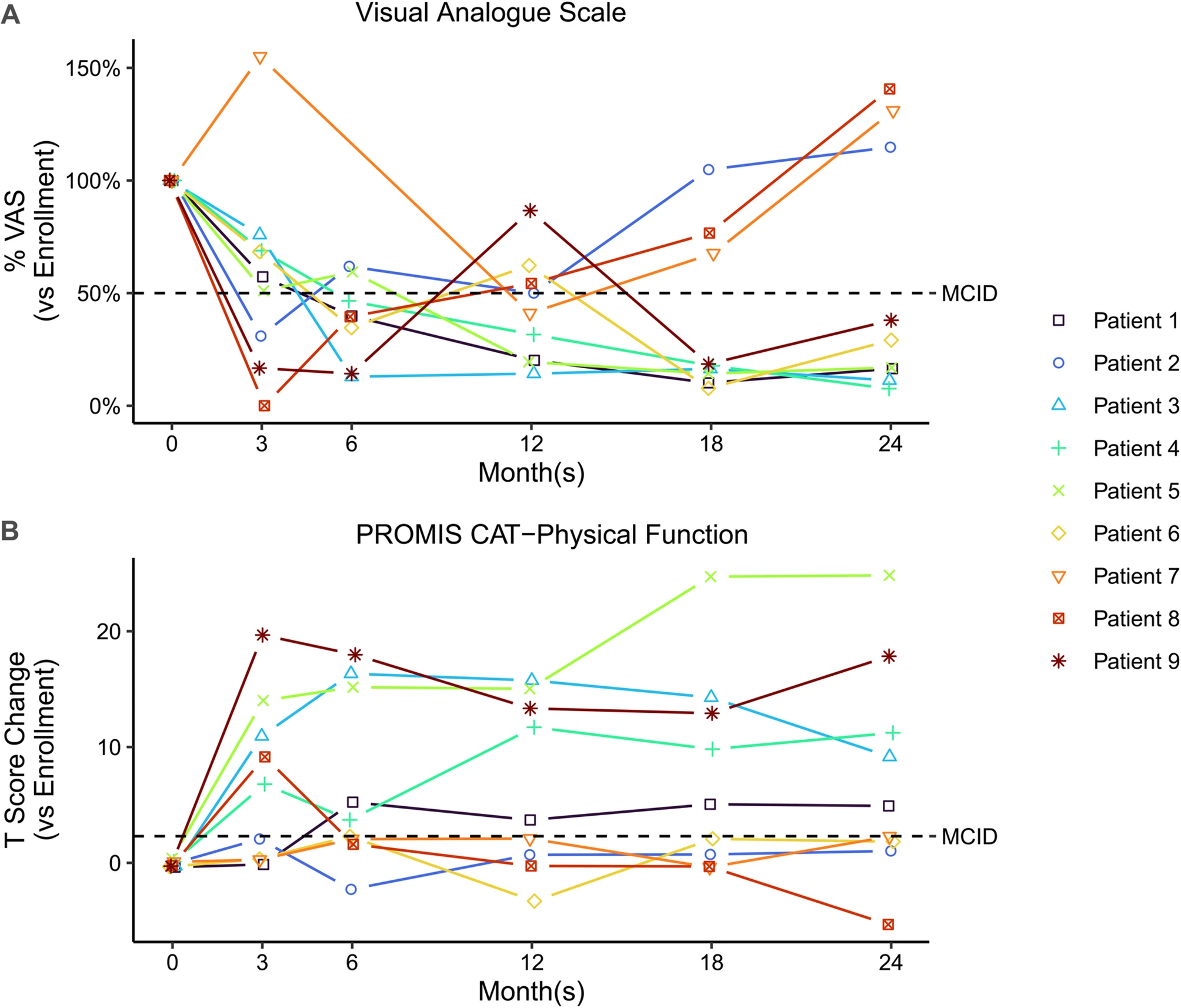
图2:VAS和PROMIS CAT身体功能应答者分析。
生活质量全面提升:此外,治疗在多个次要生活质量维度上也取得了积极效果。在所有随访中,心理困扰(以PROMIS抑郁和焦虑评分衡量)均持续改善,其中抑郁改善最为显著的是12个月(-6.5±5.9)和18个月(-6.5±9.32)。患者报告焦虑在6个月(-9.22±6.61)和18个月(-10.22±9.77)时均有显著改善(表1)。
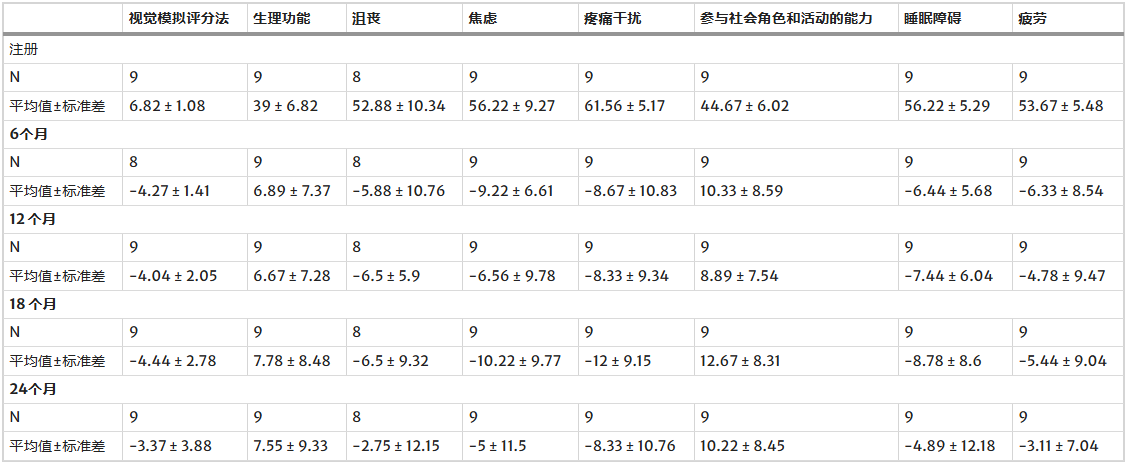
表1:治疗后6、12、18和24个月时VAS和PROMIS CAT评分的变化
*PROMIS CAT评分越高,表明所测量概念的水平越高。入组数值代表治疗前的基线测量值。VAS、ODI、睡眠障碍、疲劳、抑郁和焦虑的负值表示相对于基线有所改善,而身体功能和参与社会角色及活动的能力的正值则表示良好的治疗效果。
关节结构趋于稳定甚至逆转:令人振奋的是,MRI影像学评估显示,在完成2年随访的9名患者中,5名(55.6%)患者的小关节退变程度至少减轻了1级,3名病情稳定,仅1名出现进展。这表明治疗可能具有延缓甚至逆转关节退变的潜力。
工作功能恢复与阿片类药物零使用:入组时7名工作能力受损的患者中,6名在3个月内即获显著改善,其中4名维持至2年(图2)。更值得注意的是,所有患者在整个研究期间均未使用任何阿片类止痛药,证明了其强大的非成瘾性疼痛管理能力。
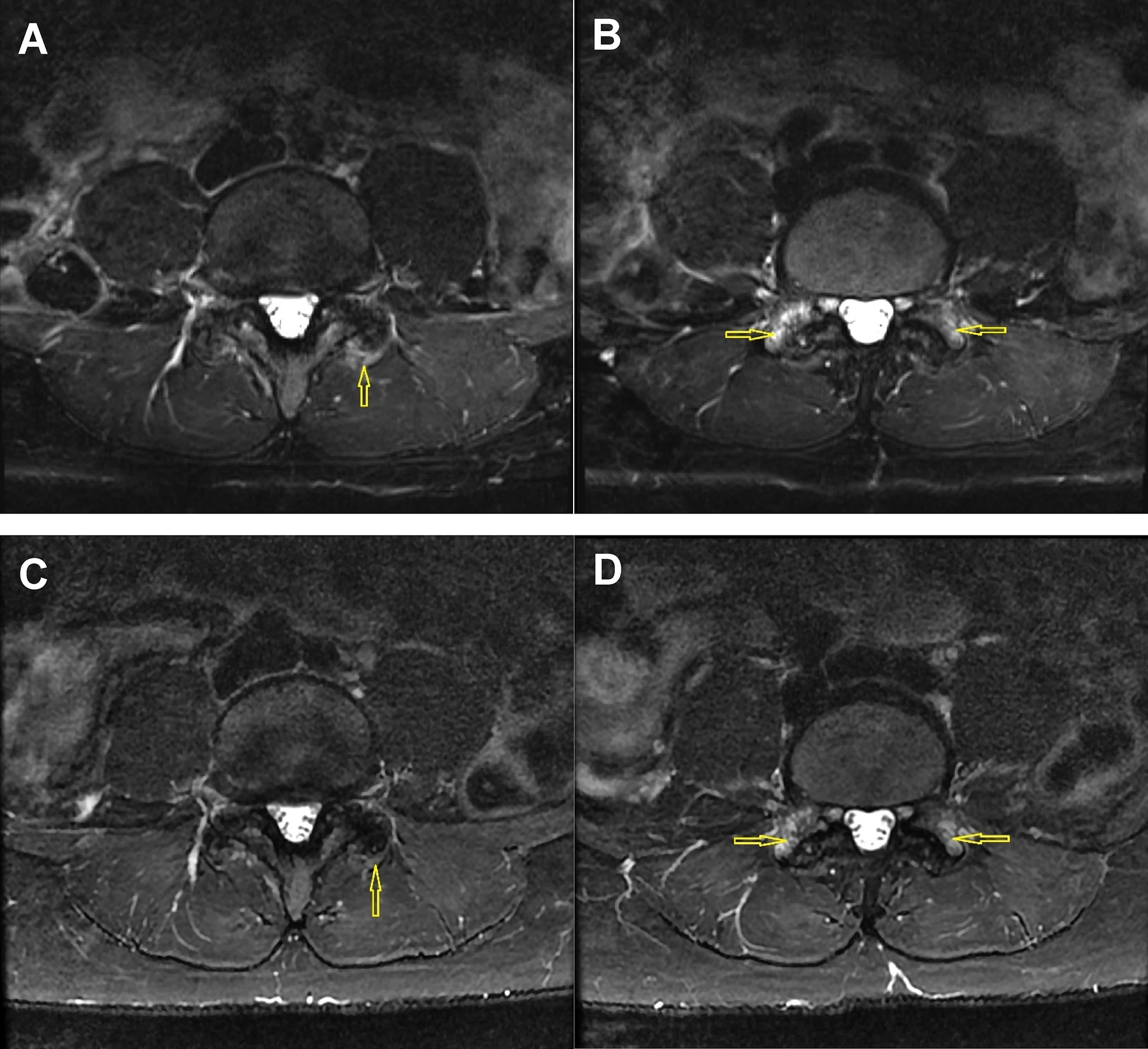
图2:图A和B为骨髓间充质干细胞(BM-MSC)注射前,图C和D为注射后24个月的L4-L5小关节脂肪抑制T2加权轴位Dixon图像。治疗前图像A显示左侧小关节周长50%以上出现水肿;图像B显示双侧L5上关节突广泛反应性骨髓水肿(3级滑膜炎)。治疗后24个月,图像C显示关节囊水肿明显减轻,关节周长50%以下;图像D显示双侧骨髓水肿略有减轻(2级滑膜炎)。
四、 结论与展望:开启腰痛再生治疗的新篇章
本研究作为全球首个评估异体BM-MSCs治疗LFA的I期临床试验,成功达到了其主要终点。
核心结论验证:研究证实,关节内注射异体BM-MSCs治疗LFA安全性良好,并在缓解疼痛、改善身体功能、提升生活质量以及延缓关节退变方面显示出显著的初步疗效。
作用机制与未来方向:研究者认为,干细胞的作用主要归功于其旁分泌效应(即分泌有益的活性因子),而非直接分化为软骨细胞。本研究的局限性在于未能收集生物样本进行深入的机制探索。未来的研究将借助组学等先进技术,深入揭示作用机制,并最终通过更大规模的随机对照试验,为这一革命性疗法的临床应用铺平道路。
这项研究不仅为腰椎小关节病患者带来了希望,也标志着慢性腰痛的治疗模式正从单纯的对症处理,迈向了旨在修复与再生的全新阶段。
参考资料:
[1]:Qu, W., Yan, D., Durand, N.C. et al. Intra-articular delivery of allogeneic bone marrow derived mesenchymal stromal cells (BM-MSCs) for painful lumbar facet arthropathy: a phase I clinical trial. Stem Cell Res Ther 16, 596 (2025). https://doi.org/10.1186/s13287-025-04674-y
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复