中风是全球主要死因之一。传统疗法存在局限性,而干细胞疗法为缺血性中风后的神经再生带来了新希望。
鞘内与静脉注射干细胞治疗中风后遗症:均能改善患者神经功能恢复和生活质量,但静脉注射安全性更优!
昨日,国际期刊杂志《Stem Cells Translational Medicine》发表了一篇关于“直接比较鞘内注射(IT)与静脉注射(IV)脐带间充质干细胞(UC-MSC)治疗缺血性卒中后遗症”的研究[1]。本研究旨在评估两种输注途径干细胞治疗中风后遗症的安全性与有效性。

最终研究结果表明:鞘内和静脉注射脐带间充质干细胞治疗中风后遗症均能显著改善患者的神经功能恢复和生活质量,且两种途径的疗效相当。然而,在安全性方面,静脉注射因其非侵入性而展现出更优的耐受性,其不良事件发生率显著低于鞘内注射组。
介绍:中风是由脑部供血中断引起的疾病,如果中断持续,会导致局部脑细胞死亡。中风是全球第二大死因,也是导致长期残疾的主要原因。尽管急性缺血性中风的治疗取得了进展(包括溶栓和机械取栓),但许多患者仍遭受持续性神经功能障碍,而传统疗法在促进神经功能恢复方面效果有限。
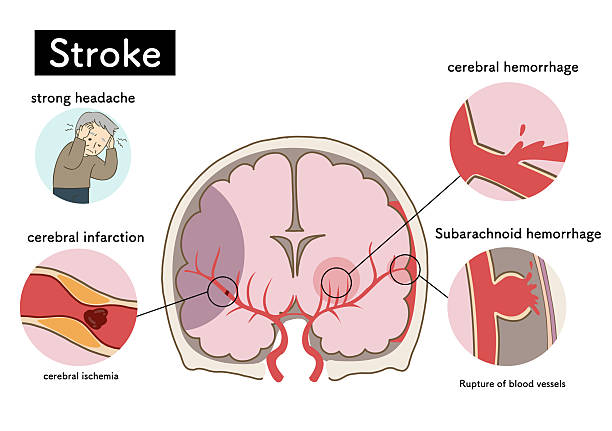
脐带间充质干细胞(UC-MSCs)在临床前研究中显示出神经保护和再生特性方面的巨大潜力。大量研究探索了MSCs在治疗各种疾病中的应用,近期研究也凸显了其在治疗卒中相关神经功能缺损方面的前景。
本研究旨在直接比较鞘内注射与静脉注射UC-MSC在改善缺血性卒中后遗症患者神经功能预后方面的安全性和有效性。
评估鞘内注射与静脉注射脐带间充质干细胞治疗缺血性卒中后遗症的方法
这项II期随机对照试验纳入了32例年龄在40至75岁之间、缺血性卒中后遗症患者。
患者被随机分为两组:一组16例接受两次鞘内注射脐带间充质干细胞(UC-MSC)联合康复治疗,另一组16例接受两次静脉注射UC-MSC联合康复治疗。此外,另设16例对照组,对照组患者与鞘内注射组在性别、年龄(±5岁)和美国国立卫生研究院卒中量表(NIHSS)评分方面相匹配,仅接受康复治疗。UC-MSC的给药剂量为1.5 × 10⁶个细胞/kg,分别在基线和治疗3个月时进行。
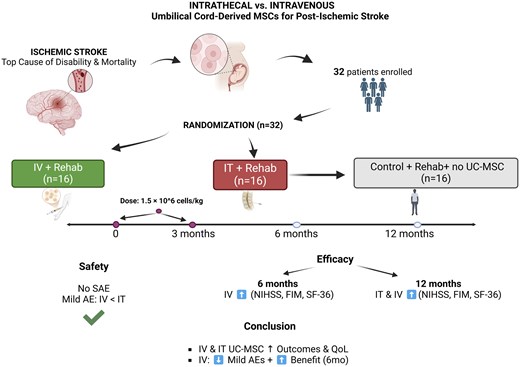
为全面评估治疗效果,研究采用了一系列国际公认量表,包括NIHSS(神经功能缺损)、功能独立性评定量表(FIM)、改良Ashworth量表(MAS)、功能性运动评分(FMS)和SF-36量表(生活质量),分别在基线、治疗3个月、6个月和12个月时对患者进行评估。
鞘内注射与静脉注射脐带间充质干细胞治疗中风后遗症的结果
32名患者接受了脐带间充质干细胞(UC-MSCs)治疗,并随机分为静脉注射组(n=16)和鞘内注射组(n=16)。另有16名患者作为对照组,并根据性别、年龄(±5岁)和基线NIHSS评分与鞘内注射组患者进行一对一匹配。
鞘内注射组和静脉注射组的患者均接受了两次干细胞输注,间隔三个月。在第二次输注时,鞘内注射组中有一名患者未接受治疗。尽管如此,所有患者(包括对照组患者)均在治疗后3个月、6个月和12个月接受了监测和评估)。
患者特征:表1列出了三组参与者在基线时的特征,包括性别、年龄、从发病到参与研究的时间、中风恢复阶段、NIHSS评分、FIM评分、MAS评分、FMS评分和SF-36评分。

表1:患者基线时的临床特征。注:IV,静脉注射;IT=鞘内注射;NIHSS=美国国立卫生研究院卒中量表;FIM=功能独立性评定量表;MAS=改良Ashworth量表;FMS=精细运动技能;SF-36=36项简表。
首次输注后,静脉注射组(n=16)的细胞存活率为87.7±4.8%,而鞘内注射组(n=16)的细胞存活率略高,为89.7±2.7%。第二次输注后,静脉注射组(n=16)的细胞存活率为91.1±3.3%,鞘内注射组(n=15)的细胞存活率为91.0±3.4%。所有样本均未检出细菌、真菌和支原体污染,且内毒素水平在可接受范围内。
安全评估
这些数据表明,鞘内注射给药方式因其侵入性操作而带来了更高的不良事件风险,但这些事件大多轻微;而静脉注射则展现了更优的安全性和耐受性。
疗效评估
NIHSS评分(神经功能缺损)的改善情况
- 在3个月时,IV组和IT组的NIHSS评分分别较对照组降低了1.7分和1.5分,但差异未达到统计学意义(p值均大于0.05)。
- 到6个月时,IV组的评分降低2.5分,与对照组相比具有统计学显著性(p=0.046),而IT组的评分降低2.3分,接近显著性(p=0.063)。
- 在12个月时,两组均表现出显著改善,IV组评分降低4.5分(p<0.001),IT组降低3.6分(p=0.003),表明长期随访中两组均能有效促进神经功能恢复。
尽管IV组和IT组与对照组相比均显示出NIHSS评分的显著改善,尤其是在12个月时,但两种治疗方法之间的直接比较在任何时间点(3个月、6个月和12个月)均未发现统计学上的显著差异(表2)。
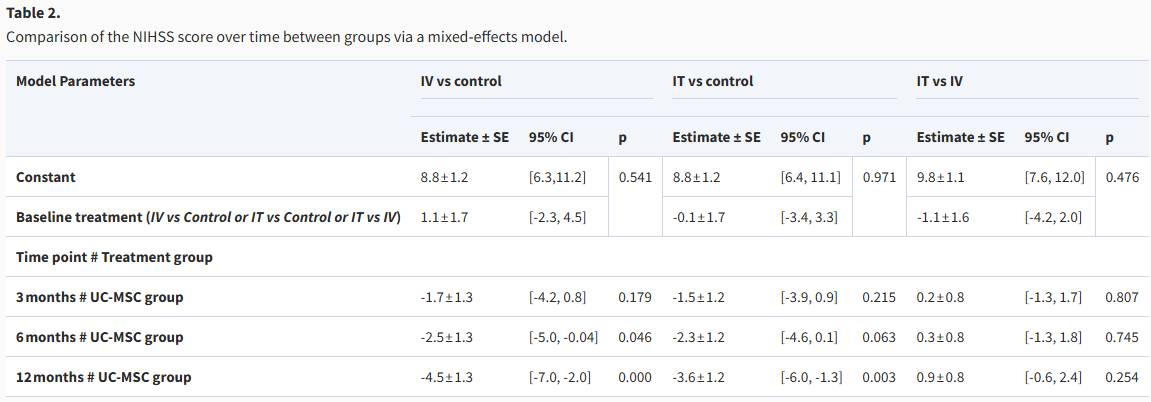
表2:通过混合效应模型比较各组NIHSS评分随时间的变化
这表明,虽然两种干预措施都能有效降低NIHSS评分,但它们在疗效上并无明显优劣之分,整体上支持了这两种治疗在长期随访中的有效性。
FIM评分(功能独立性)改善情况
首先,在总体FIM评分方面,静脉注射组(IV组)和免疫治疗组(IT组)均显示出随时间推移而持续改善的趋势。在3个月时,两组的改善与对照组相比均未达到统计学显著水平;到6个月时,IV组的改善变得显著(提高9.1分,p=0.028),而IT组仍不显著;至12个月时,两组均取得了非常显著的进步,IV组提高17.9分(p<0.001),IT组提高17.1分(p<0.001)。不过,两组治疗方式之间的直接比较在任何时间点均无显著差异(表3)。
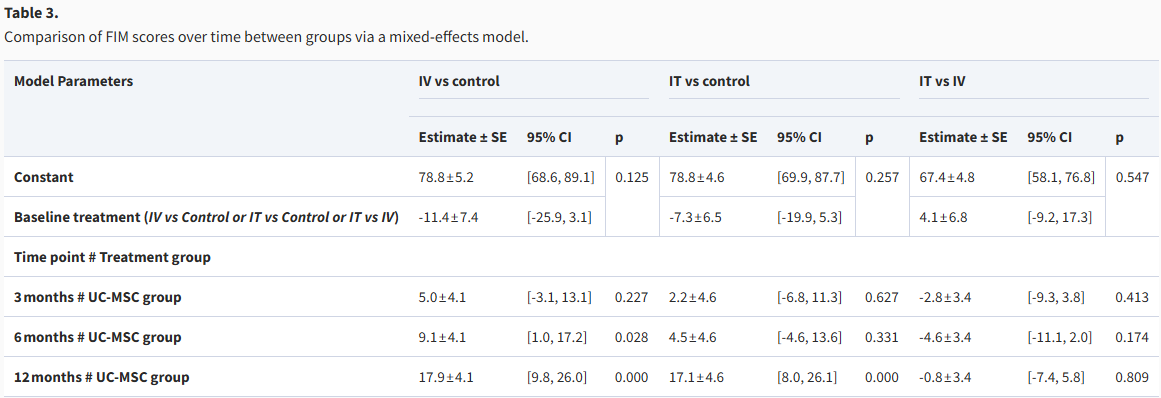
表3:通过混合效应模型比较各组间FIM评分随时间的变化。
其次,在运动功能FIM评分方面,改善模式与总体评分相似。早期(3个月)的改善不显著,但在6个月时,IV组的评分提升达到统计学显著水平(提高6.6分,p=0.04),而IT组此时仍不显著。到了12个月的终点,两组的运动功能评分均表现出显著增长,IV组增长12.1分(p<0.001),IT组增长11.9分(p=0.002),再次表明两种疗法在长期均有明确疗效,但组间差异不显著(表4)。
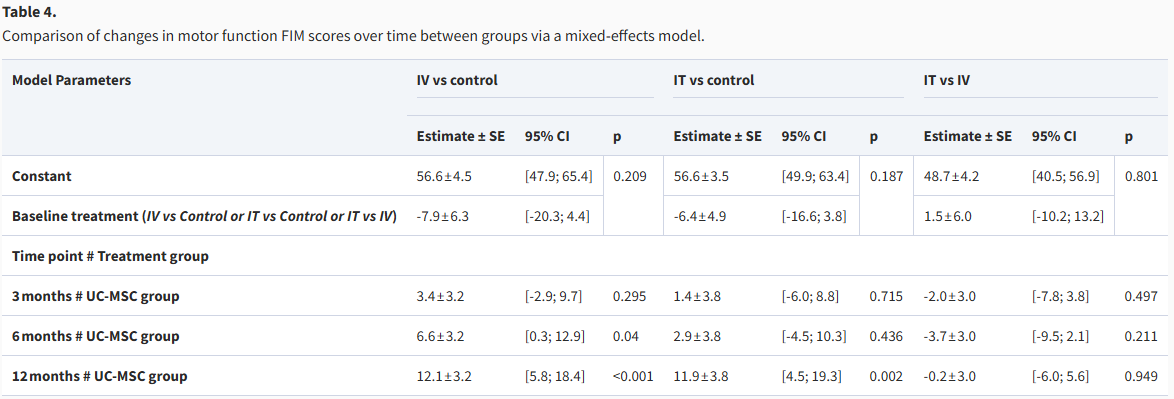
表4:通过混合效应模型比较各组运动功能 FIM 评分随时间的变化。
最后,在认知功能FIM评分方面,改善的显著性出现稍晚。3个月时两组改善均不显著;6个月时,IV组的认知评分提升已具有统计学意义(提高2.4分,p=0.029),而IT组到此时仍未见显著改善;直至12个月,两组的认知功能才均出现高度显著的改善,IV组提高5.8分(p<0.001),IT组提高5.1分(p<0.001)。同样,两种治疗方法在认知功能的改善上直接对比,也未显示出统计学差异(表5)。
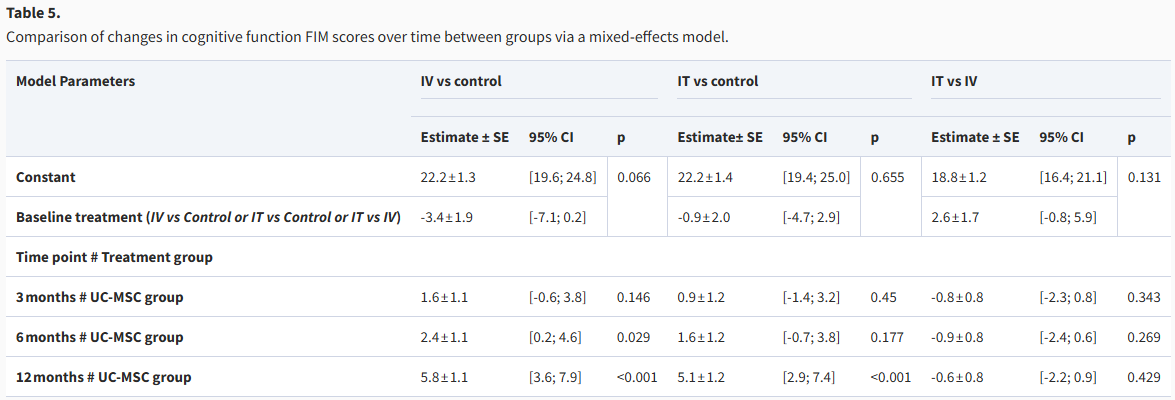
表5:通过混合效应模型比较各组认知功能FIM评分随时间的变化。
Ashworth量表(MAS)(肌张力)评分的改善情况
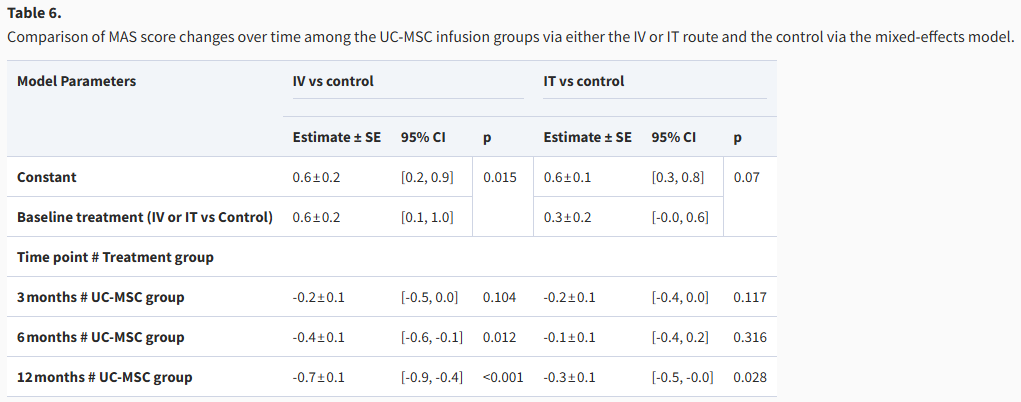
表6:通过混合效应模型比较 UC-MSC 输注组(静脉输注或鞘内输注)和对照组的 MAS 评分随时间的变化。
其次,从两组疗效的对比来看,IV组在改善肌张力方面表现出更优的潜力和一致性。这不仅体现在其改善效果更早(6个月时)达到显著水平,也体现在12个月时其评分降低的幅度(0.7分)明显大于IT组(0.3分)。数据表明,虽然两种疗法在长期随访中均能有效降低MAS评分,但静脉注射(IV)方案在减轻肌张力障碍方面可能是一种更有效的选择。
FMS评分(功能性运动)的改善情况
FMS(功能性运动评分)的改善情况可以从右手、左手以及特定患者亚组三个方面进行分析,具体如下:
首先,在FMS右手评分方面,静脉注射组(IV组)和免疫治疗组(IT组)均显示出持续的改善。在3个月时,两组的改善均不显著;到6个月时,IV组的改善率先达到统计学意义(提高13.3分,p=0.002),而IT组此时虽有提高(8.4分),但未达显著水平(p=0.068);至12个月时,两组的右手功能均表现出高度显著的改善,IV组提高17.1分(p<0.001),IT组提高16.8分(p<0.001)。不过,两种疗法之间的直接比较在任何时间点均无显著差异。
其次,在FMS左手评分方面,其改善模式和程度与右手不同,且改善速度相对较慢。在3个月和6个月时,IV组和IT组的评分提高均未显示出统计学意义。直到12个月的随访终点,左手功能的改善才变得明显,其中IT组的评分显著提高了11.4分(p=0.032),而IV组提高了10.1分,接近统计学显著性(p=0.055)。同样,两种治疗方法在左手功能的改善上直接对比,也未观察到显著差异。
最后,在一个特定的患者亚组——双侧大脑中动脉受累的患者中,分析显示其左手FMS评分的改善情况与整体人群截然不同。混合效应模型分析表明,在3个月、6个月或12个月时,无论是IV组与对照组相比,还是IT组与对照组相比,均未发现具有统计学意义的改善。这表明,对于这类病变范围较广的患者,两种疗法在改善其左手运动功能方面可能疗效有限。
SF-36健康调查问卷(SF36)(生活质量)改善情况
根据混合效应模型的分析,与对照组相比,静脉注射组(IV组)和免疫治疗组(IT组)的SF-36生活质量评分均随时间的推移实现了快速且持续的显著改善。在3个月的早期评估中,两组的改善就已达到统计学意义,其中IV组显著提高了22.5分(p<0.001),IT组也显著提高了17.8分(p=0.002)。这种改善趋势在6个月和12个月时得以保持并加强,两组在12个月时的评分提升幅度达到峰值,显示出治疗对生活质量的长期积极影响。
从两组改善幅度的对比来看,IV组在所有时间点上均表现出比IT组更大幅度的评分提升。在3个月、6个月和12个月时,IV组的提升分数(分别为22.5分、26.3分和32.1分)持续高于IT组(分别为17.8分、17.2分和21.0分),表明静脉注射方案在改善患者生活质量方面可能具有更优的潜力。尽管存在这一趋势,但需要后续分析来确认两组间的差异是否具有统计学显著性(表7)。
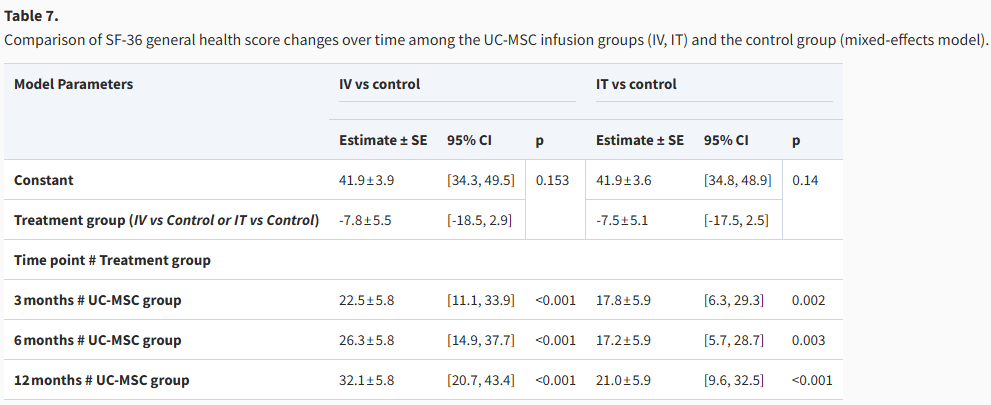
表7:比较UC-MSC输注组(静脉注射、鞘内注射)和对照组的 SF-36 一般健康评分随时间的变化(混合效应模型)。
脑部核磁共振成像(MRI)结果
采用脑部MRI评估基于基线ASL值的脑灌注改善情况。6个月时,静脉注射组16例患者中有3例(18.8%)脑灌注改善,而鞘内注射组和对照组各有2例(12.5%)脑灌注改善(p=0.846)。12个月时,静脉注射组16例患者中有4例(25%)脑灌注改善,而对照组和鞘内注射组分别为18.8%和12.5%。
鞘内注射与静脉注射脐带间充质干细胞治疗缺血性卒中后遗症的5大结果
一、治疗安全性得到证实
本研究首要证实了脐带间充质干细胞治疗的安全性。在整个研究期间,未发生任何与治疗相关的严重不良事件。虽然鞘内注射组的不良事件发生率高于静脉注射组,但这主要归因于腰椎穿刺本身引起的局部疼痛。
所有报告的不良事件均为轻微级别,能够自行消退或通过简单药物治疗缓解,这表明两种给药途径均具有可靠的安全性基础。因此,从临床操作便利性和患者耐受性角度综合考量,静脉注射是更优的安全选择。
二、神经功能与生活质量显著改善
研究结果表明,无论是静脉注射还是鞘内注射,细胞疗法均能显著且全面地改善卒中后遗症患者的神经功能、运动能力、肌张力和生活质量。在12个月的长期随访中,两种治疗组在多项关键评分量表上,均较对照组取得了具有统计学意义的显著改善。这些改善涵盖了神经功能缺损、生活独立性、手部运动功能、肌痉挛状态以及生活质量等多个核心维度,证明了UC-MSC治疗的有效性。
三、疗效呈现渐进式发展且与脑灌注无关
细胞治疗带来的功能改善是一个渐进的过程,而非一蹴而就。在治疗后三个月,多数评分并未立即显示出显著差异;直到六个月时,部分改善才开始显现统计学意义;而最显著的改善普遍出现在十二个月时,体现了疗效累积和延迟起效的特点。然而,通过磁共振成像评估发现,这种功能上的显著改善并非源于脑部灌注的增加,因为治疗组与对照组在脑灌注指标上并无显著差异,提示干细胞可能通过其他机制发挥作用。
四、静脉注射在疗效与安全的综合评估中胜出
根据研究结果,在疗效上,鞘内注射与静脉注射两种给药方式并无显著优劣之分。尽管先前假设更具侵入性的鞘内注射可能效果更佳,但数据显示,两组患者在神经功能、运动能力及生活质量等所有评估参数上的改善均无统计学差异。然而,在安全性方面,静脉注射展现出更优的。鞘内注射组的不良事件发生率更高,主要与腰椎穿刺操作本身相关。因此,综合疗效与安全性来看,静脉注射因其非侵入性、操作简便且不良事件更少,可能是一个更具吸引力的临床选择。
五、间充质干细胞治疗缺血性后遗症的核心作用机制
间充质干细胞治疗缺血性卒中并非通过单一的机制起作用,而是提供了一个多方面的修复性微环境。其核心机制并非直接替代受损神经元,而是通过强大的旁分泌作用来实现的。这包括:
- 1) 免疫调节:调节过度的炎症反应,减轻二次损伤;
- 2) 分泌神经营养因子:如BDNF、GDNF和NGF,以支持神经元存活、促进神经再生并增强突触可塑性;
- 3) 促进血管生成:为受损区域恢复血供;
- 4) 转移功能正常的线粒体给受损的脑细胞,帮助它们恢复能量代谢,从而共同协作促进神经回路重建和功能恢复。
写在最后:这项研究直接比较了静脉注射和鞘内注射UC-MSCs治疗卒中后遗症的效果。结果表明,两种方法均安全可行,并能显著且持久地改善神经功能与生活质量。
然而,综合疗效与安全性来看,静脉注射途径在提供相当临床获益的同时,具有更少的不良反应和更佳的耐受性,因此是更具临床应用前景的给药方式。这些发现为推进这种前景广阔的细胞疗法提供了坚实证据,并为未来优化卒中康复治疗方案指明了方向。
参考资料:
[1] Liem Thanh Nguyen、Thuy Thi Ngoc Nguyen、Kien Trung Nguyen、Lam Nam Phung、Van Thanh Hoang、Trang Thi Kieu Phan、Minh Van Pham、Anh Thi Phuong Nguyen、Doan Van Ngo、Anh Van Nguyen、Chi Van Nguyen,鞘内与静脉内脐带间充质干细胞治疗缺血性中风后遗症, 干细胞转化医学,第 14 卷,第 12 期,2025 年 12 月,szaf063,https://doi.org/10.1093/stcltm/szaf063
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复