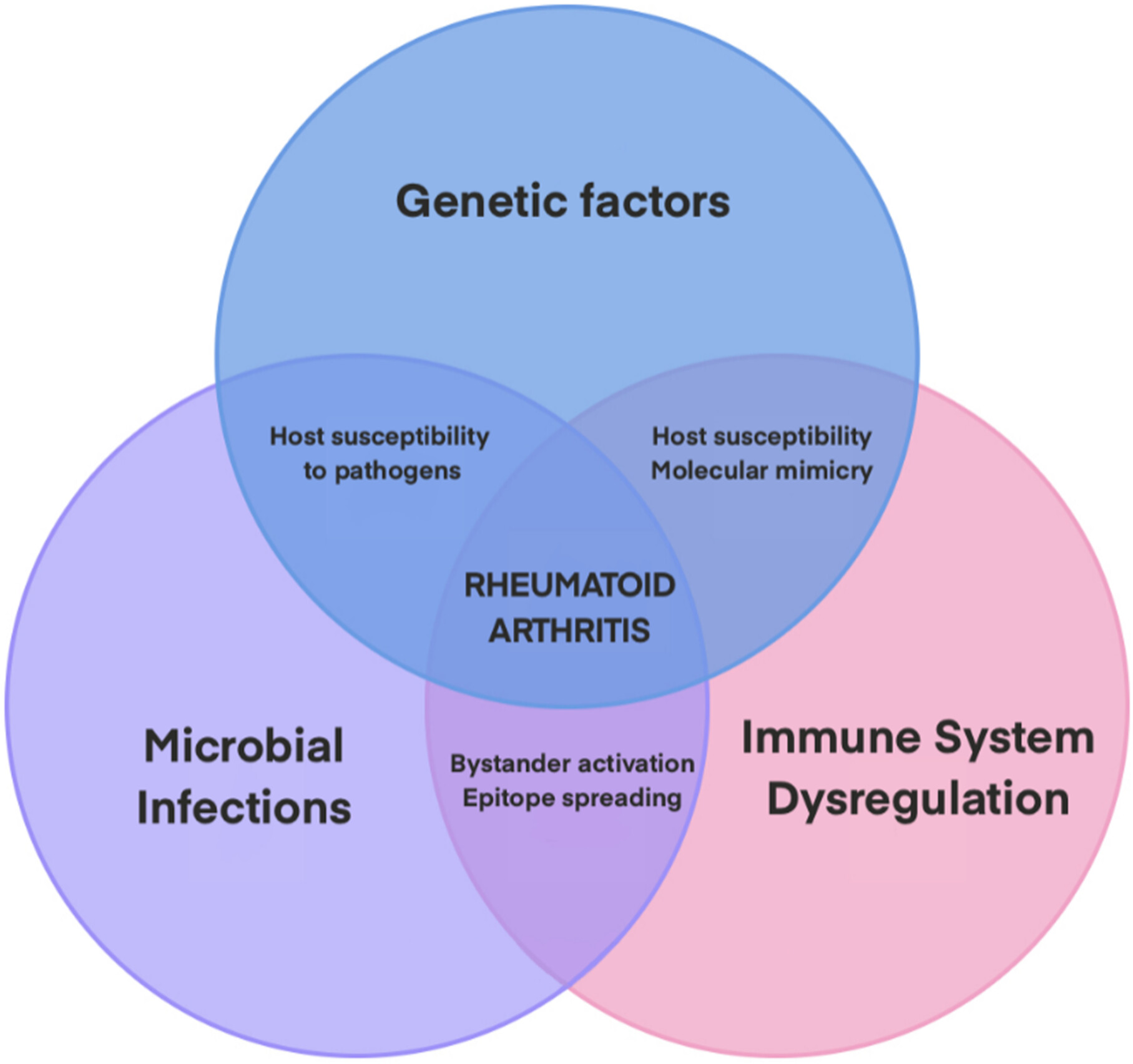
图1:类风湿性关节炎中不同因素之间的相互作用
目前,RA的常规治疗方案仍存在诸多局限。间充质干细胞(MSCs)疗法凭借其独特的生物学特性——包括多系分化潜能、免疫调节功能、低免疫原性以及强大的组织修复能力——在临床前与临床研究中均显示出良好的治疗前景。
在此背景下,系统评估间充质干细胞治疗类风湿关节炎的长期疗效与安全性显得尤为迫切。为此,南京大学医学院附属鼓楼医院风湿免疫科联合清华大学生命科学中心、清华大学免疫学研究所等机构,近日在期刊《风湿病与自身免疫学主页》上发表题为“间充质干细胞疗法治疗类风湿性关节炎:长期疗效、安全性及机制研究”的综述文章。

该综述全面阐述了MSCs治疗RA的长期疗效、安全性及其潜在作用机制,旨在为基于MSCs的治疗策略提供理论依据,以进一步优化临床疗效。
了解间充质干细胞的特性
如图2所示,间充质干细胞具备多种独特生物学特性,这些特性共同支撑其广泛的治疗功能。
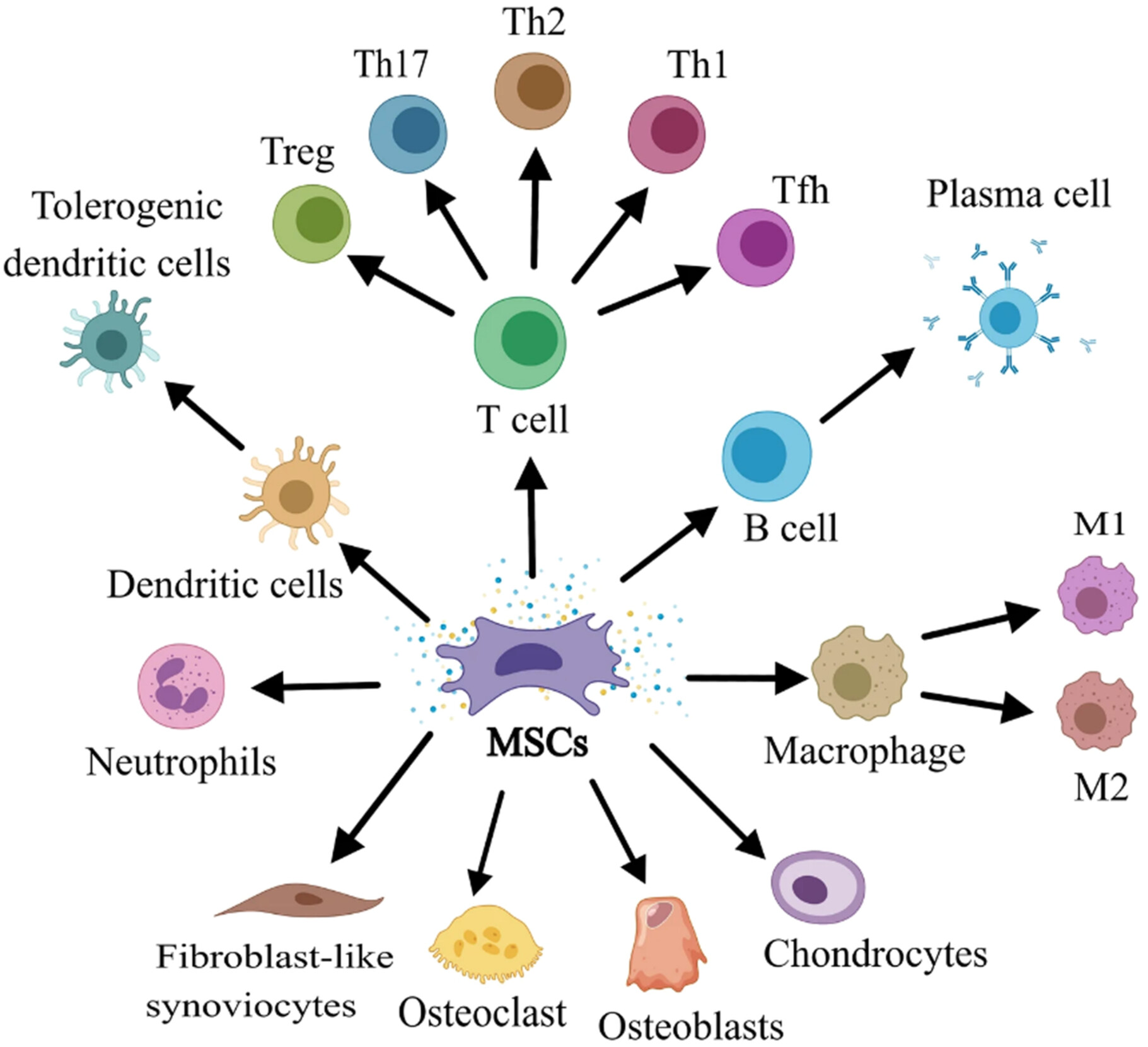
图2:间充质干细胞的特性及其在类风湿性关节炎中的治疗机制。
MSCs的核心定义是一种具有自我更新能力的成体基质细胞,广泛分布于骨髓、脂肪、脐带等多种组织中。根据国际细胞治疗学会(ISCT)更新后的标准,其鉴定重点已从传统的“三系分化”潜能转向特定的表面标志物(如表达CD73、CD90、CD105,而不表达CD34、CD45等造血标志物)以及明确的组织来源。在特定诱导条件下,MSCs仍能分化为成骨细胞、脂肪细胞和软骨细胞,这构成了其参与组织修复的基础能力。
MSCs最突出的特性在于其强大的免疫调节功能与旁分泌效应。它们可通过细胞直接接触或分泌转化生长因子-β(TGF-β)、吲哚胺2,3-双加氧酶(IDO)等因子,抑制T细胞、B细胞的异常增殖,阻碍树突状细胞成熟,并调节自然杀伤细胞的功能(图3)。这一特性使其在治疗自身免疫性疾病(如RA)及减轻移植排斥反应中具有重要价值。临床前及临床研究均证实,MSCs能够有效减轻炎症、促进组织修复并改善关节功能。
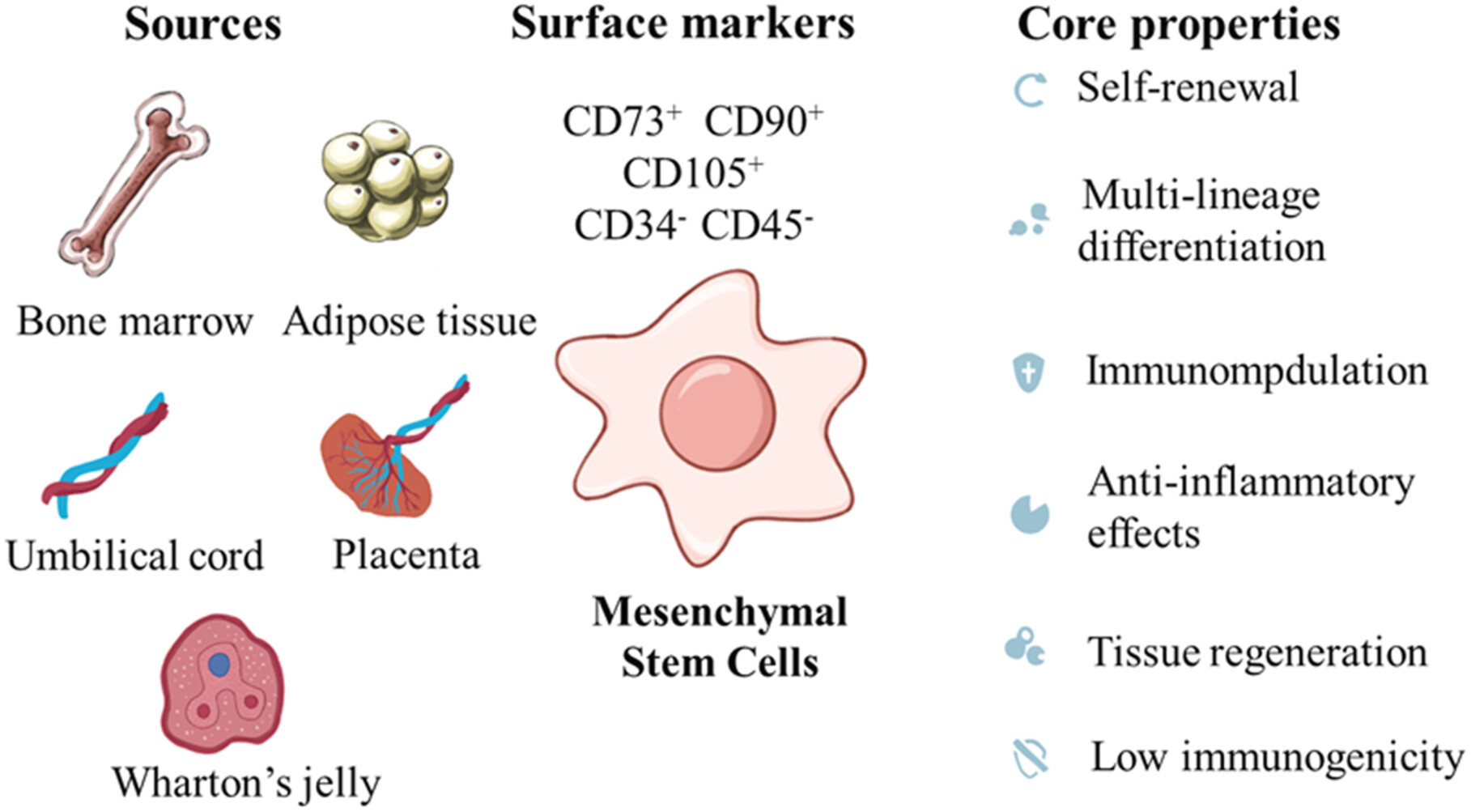
图3:间充质基质细胞:起源、表型和功能特征。
此外,MSCs具有低免疫原性和良好的体外扩增能力,为其临床应用提供了可行性。由于表面主要组织相容性复合体II类分子及共刺激分子表达缺失,MSCs不易被宿主免疫系统识别和排斥。通过使用化学成分明确的无血清培养基或血小板裂解物,可实现MSCs的大规模、标准化扩增。
研究还表明,利用干扰素-γ等细胞因子进行预处理或进行特定基因修饰,可进一步调控和增强MSCs的免疫调节功能与治疗效果,但其最终疗效仍高度依赖于所处微环境。
间充质干细胞(MSCs)治疗类风湿关节炎(RA)的作用机制
MSCs治疗RA的作用机制涉及多个方面,主要包括免疫调节、抗炎作用、促进组织修复以及抑制破骨细胞生成。这些机制相互协同,共同发挥治疗效应。
首先,间充质干细胞治疗类风湿关节炎的核心机制在于其强大的免疫调节能力。
MSCs能够直接干预RA发病中的关键免疫细胞,恢复免疫稳态。它们通过抑制T细胞的异常活化和增殖,并分泌IL-10、TGF-β等因子,促进具有免疫抑制功能的调节性T细胞生成。同时,MSCs还能抑制B细胞产生自身抗体,并阻碍树突状细胞的成熟,从多个环节减轻自身免疫攻击。
其次,MSCs通过多途径发挥显著的抗炎作用。
它们通过分泌抗炎细胞因子来中和关节内的促炎因子(如TNF-α、IL-1、IL-6),从而打破炎症级联反应。此外,MSCs能诱导巨噬细胞从促炎的M1型向抗炎的M2型极化,并调控如p38 MAPK等关键炎症信号通路,从源头上减少炎症介质的产生,缓解关节滑膜的炎症状态。
第三,间充质干细胞能够促进组织修复与再生。
在归巢至受损关节后,MSCs能够在局部微环境中分化为软骨细胞、成骨细胞等,直接补充受损的软骨和骨组织。更重要的是,它们通过旁分泌作用释放胰岛素样生长因子-1、血管内皮生长因子等多种生长因子,刺激血管生成,改善血供,并加速宿主自身修复细胞的增殖与迁移,从而促进关节结构的修复。
第四。实现上述作用的前提是MSCs高效的趋化与靶向归巢能力。
MSCs表面表达如CXCR4等趋化因子受体,能感知并主动迁移至炎症关节部位高表达的趋化信号(如SDF-1/CXCL12)。这种向病灶部位的特异性富集,确保了治疗细胞能够精准到达需要发挥作用的部位,极大提高了局部药物浓度和治疗效率,是其发挥治疗效应的关键第一步。
综上所述,MSCs治疗RA的多种机制相互关联、协同作用,为RA治疗提供了新的策略与广阔前景。随着研究的深入与临床试验的推进,MSCs有望成为一种安全有效的治疗选择,为患者带来显著且持久的病情缓解。
间充质干细胞治疗RA的临床研究
对于无法耐受或对传统治疗无效的类风湿关节炎(RA)患者,以及合并其他疾病的患者,间充质干细胞(MSCs)因其强大的免疫调节特性而成为一种颇具前景的替代疗法(见表1;图4)。
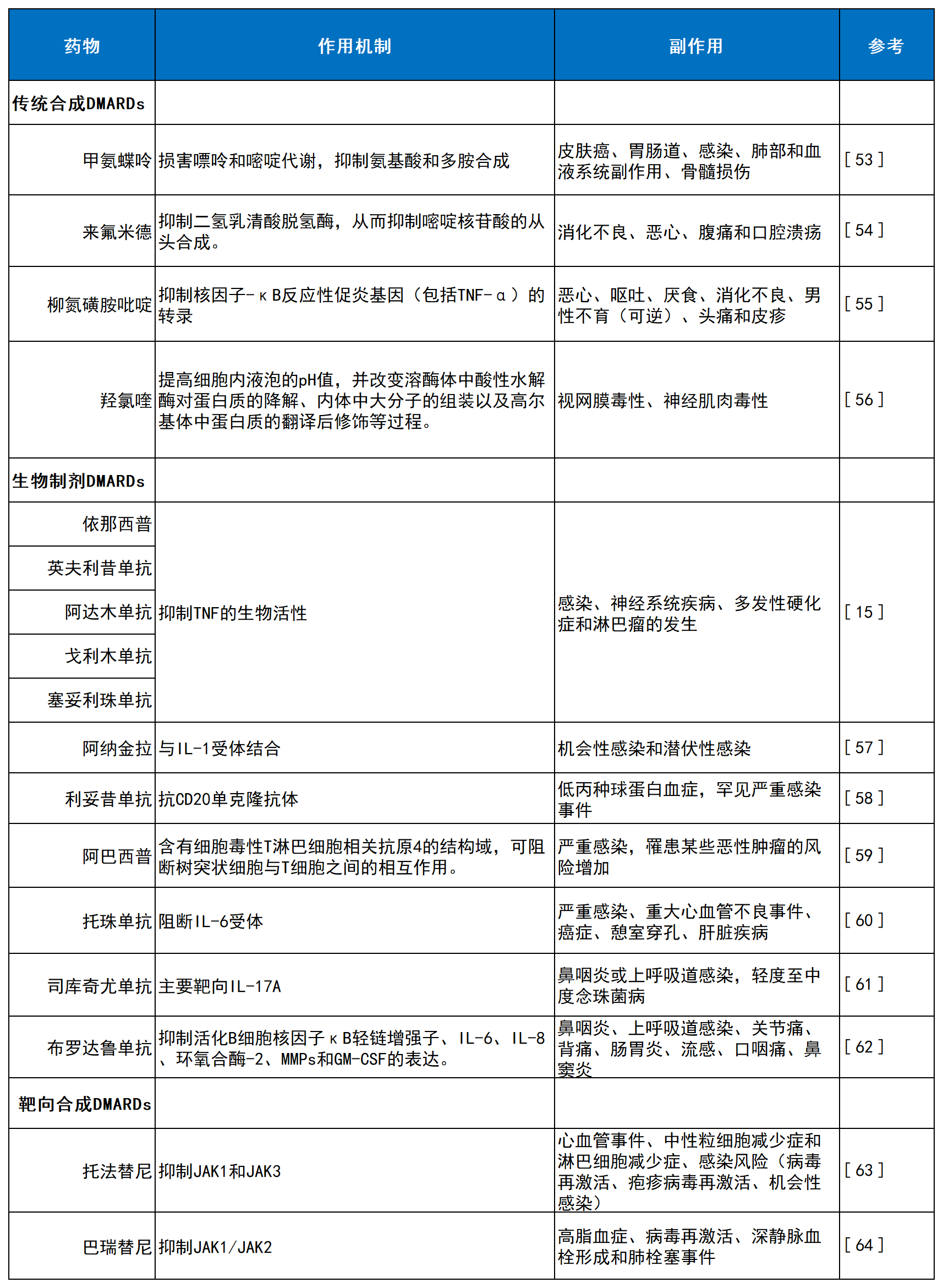
表1:类风湿性关节炎的治疗方法概述。
图4:间充质干细胞治疗类风湿性关节炎的长期疗效和安全性。
2019年,在一项纳入9名中度疾病活动度RA患者的I期、非对照、开放标签临床试验中,研究者分别给予不同剂量的MSC移植(2.5 × 10⁷、5 × 10⁷和1×10⁸个细胞)。

输注后4周,所有剂量组均未观察到显著毒性反应,且临床指标如红细胞沉降率(ESR)和28关节疾病活动度评分(DAS28)均有所改善。值得注意的是,在接受最高剂量(1 × 10⁸个细胞)输注后24小时内,患者血清中炎症因子IL-1β、IL-6、IL-8和TNF-α水平显著下降,表明MSC可快速控制炎症反应。
2024年,在一项异体骨髓来源克隆间充质基质细胞治疗难治性类风湿性关节炎:一项初步研究显示,在24周内每月输注一次MSC后。

6名患者中有3人的视觉模拟评分(VAS)得到改善,其中2人实现了持续性疼痛缓解并提升了生活质量。至第16周时,4名患者达到了美国风湿病学会(ACR)20%改善标准(ACR20)。临床DAS评分以及炎症标志物(如C反应蛋白[CRP]和ESR)均有所降低;血清学分析还显示,5名患者体内抗炎因子IL-10水平升高,而促炎因子TNF-α和IL-17水平下降。
这些短期研究结果为MSC的疗效提供了初步证据,并为长期研究奠定了基础。
在更长期的研究中,2013年,Liu等人对172名对传统治疗无效的活动性RA患者进行了为期8个月的随访,评估了人脐带来源间充质干细胞(UC-MSCs)的安全性与有效性。受试者被随机分为两组:一组接受改善病情抗风湿药(DMARDs)联合不含UC-MSC的培养基,另一组则在DMARDs基础上接受单次静脉输注4 × 10⁷个UC-MSCs。
治疗后,患者血清中TNF-α和IL-6水平下降,外周血中CD4⁺CD25⁺Foxp3⁺调节性T细胞(Tregs)的比例增加。根据美国风湿病学会(ACR)改善标准、DAS28评分及健康评估问卷(HAQ)评分,患者症状显著缓解。治疗效果可持续3至6个月,无需持续输注MSC;而重复输注可进一步增强疗效。此外,MSC治疗耐受性良好。
长期随访研究对于评估MSC疗法的持久性至关重要。
2019年,Liu等人进一步对64名RA患者(年龄18–64岁)进行了观察,这些患者在接受个体化低剂量DMARDs的同时,接受了单次静脉输注UC-MSCs(2 × 10⁷个细胞/20mL)。

治疗后1年和3年时,患者的常规血液检查、肝肾功能及免疫球蛋白水平均维持在正常范围内。与基线相比,炎症标志物(如ESR、CRP、类风湿因子[RF]和抗环瓜氨酸肽抗体[anti-CCP])显著降低。通过HAQ和DAS28进行的功能评估也显示持续改善。
表2汇总了部分针对RA的MSC疗法长期临床研究。一项关于随机对照试验的系统综述与荟萃分析进一步证实,MSC可显著改善RA患者的关节间隙狭窄和骨侵蚀情况。
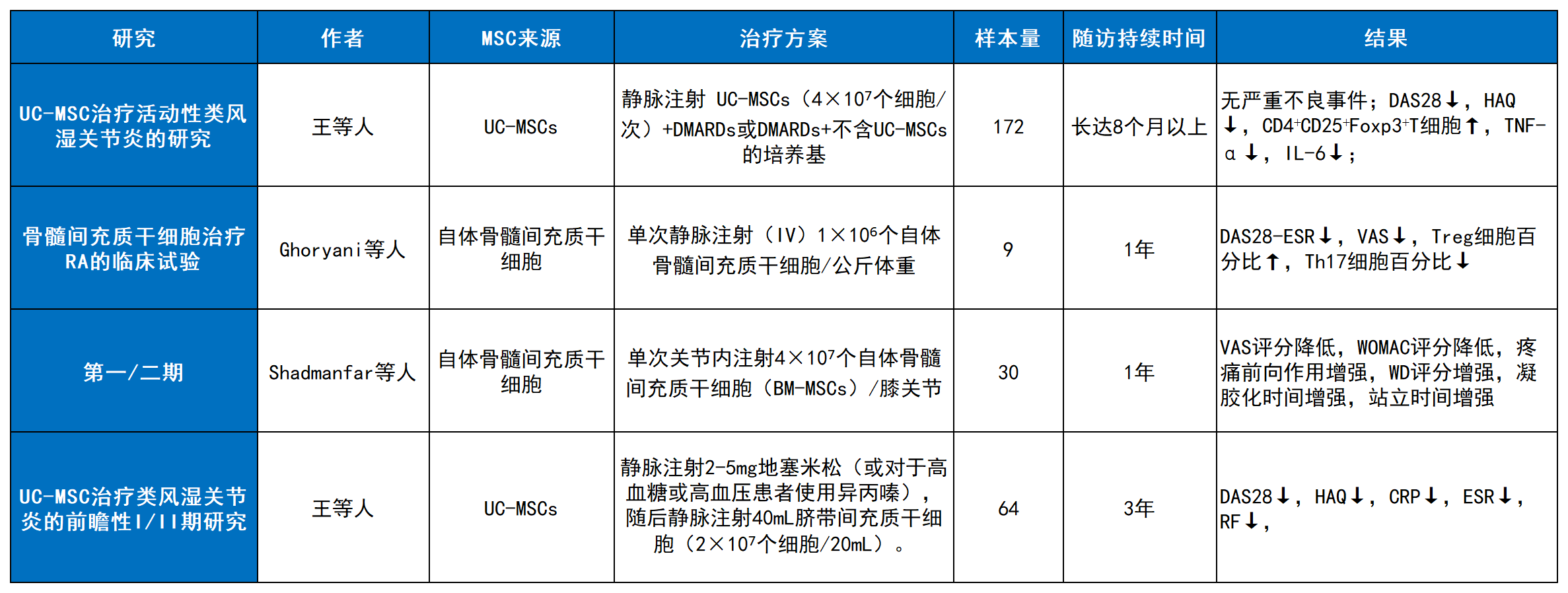
表2:间充质干细胞治疗类风湿关节炎的长期临床研究。
间充质干细胞抑制T细胞和B细胞的增殖和活化,减少促炎细胞因子的分泌,调节免疫反应,减轻炎症,且不会引起过度免疫抑制,从而避免机会性感染等并发症。
间充质干细胞治疗RA的影响因素
间充质干细胞(MSC)治疗类风湿关节炎(RA)的疗效受多种因素影响,包括细胞固有特性、治疗方案和患者个体差异。来源于不同组织来源的MSC可能表现出不同的治疗潜力(表3)。
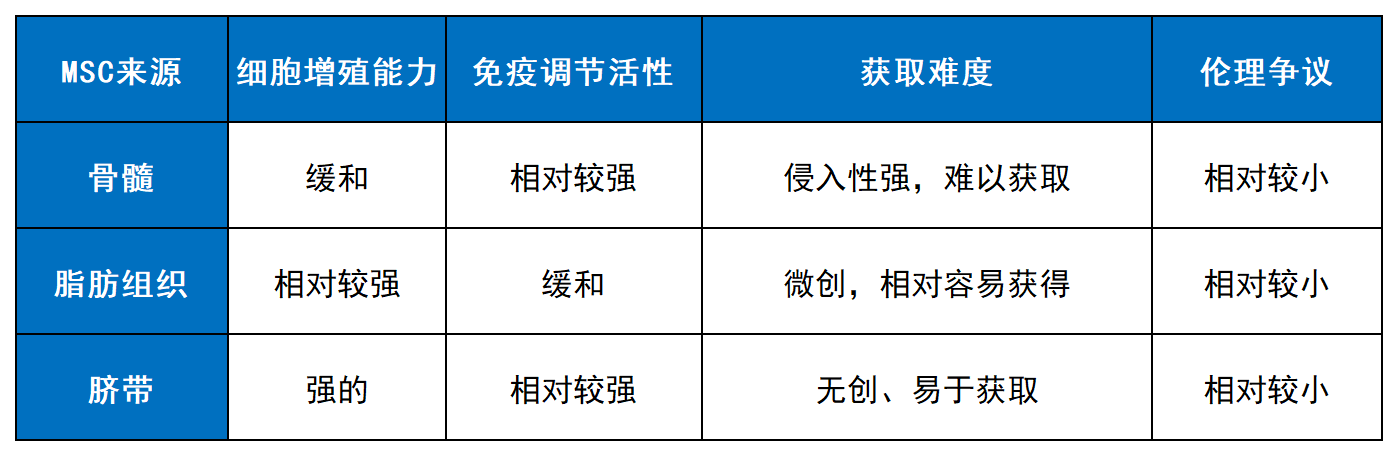
表1:不同来源MSC的特性比较。
首先,细胞来源与自身特性显著影响疗效。不同组织来源的MSCs在分化潜能、免疫调节能力和增殖活力上存在差异。例如,临床前研究表明,在RA动物模型中,骨髓来源的MSCs可能比脂肪来源的MSCs展现出更强的免疫调节特性;而脐带来源的MSCs则因其采集便利、低免疫原性和强增殖能力,在临床研究中显示出良好的应用前景。
其次,治疗方案的具体参数是决定疗效的核心可控因素。这包括给药的剂量、途径、频率以及细胞的预处理方法。剂量需在安全有效的窗口内优化,过低可能无效,过高则可能增加风险。给药途径直接影响细胞分布和作用方式:静脉注射利于全身性免疫调节,关节内注射可实现病灶局部高浓度聚集。此外,输注前使用细胞因子等对MSCs进行预处理,可有效增强其免疫调节和抗炎功能。
最后,患者个体状况与体内微环境是影响治疗反应的关键变量。患者的年龄、疾病活动度、合并症以及既往治疗情况等个体差异,会导致对MSCs疗法的反应不同。更重要的是,患者炎症关节局部的微环境(如特定细胞因子和趋化因子的水平)会直接影响输注后MSCs的存活、归巢及其功能发挥,从而最终决定治疗的成败。
讨论与结果
一、显著的临床疗效与治疗潜力
研究表明,MSC疗法在临床前和临床研究中均展现出显著的长期疗效。它能有效缓解关节疼痛、肿胀和僵硬等症状,并持续改善关节功能和整体疾病活动度。其疗效体现为关键炎症生物标志物(如ESR、CRP、RF和抗CCP抗体)水平的降低,并与滑膜炎症和关节破坏的减少直接相关。更重要的是,MSC疗法显示出减缓甚至修复软骨退化和骨侵蚀的潜力,有望从症状控制和结构修复两方面改变RA的自然病程。
二、良好的安全性与严格的质量控制
大量临床试验证实,MSC疗法具有高度的安全性。迄今未报告有直接归因于MSC输注的严重不良事件,感染、免疫排斥或异常分化等风险极低。这得益于在细胞分离、培养、鉴定到储存和给药全流程中建立的标准化质量控制体系。此外,通过细胞因子预处理或基因修饰等策略,可在增强疗效的同时保障安全性,使其符合临床转化的监管要求。
三、技术优化与疗效增强策略
为提高疗效,研究聚焦于两大优化方向。一是通过基因工程改造MSCs,使其过表达IL-10、TGF-β等特定治疗因子,从而强化其免疫调节和组织再生能力。二是开发创新的生物递送平台,如纳米颗粒、水凝胶和仿生支架,旨在更精准地将MSCs或其分泌的外泌体靶向递送至炎症关节,实现治疗因子的可控释放,提高归巢效率并减少脱靶效应。
四、当前局限与未来发展方向
尽管前景广阔,MSCs疗法仍面临诸多挑战。现有临床试验普遍存在样本量小、患者异质性高、MSCs来源与治疗方案不统一等问题,限制了结果的可比性与普适性。MSCs在体内的长期存活、归巢效率及最终命运尚不完全明确,且其疗效可能受患者个体差异和关节微环境的显著影响。
未来研究需致力于优化给药方案、探索与现有药物的联合治疗策略、开发预测疗效的生物标志物,并通过推进细胞生产工艺的标准化与规模化,最终实现该疗法的成本降低与广泛临床应用。
总之,间充质干细胞疗法作为一种变革性的类风湿关节炎治疗手段,展现出巨大的潜力,不仅能够有效缓解症状,而且有望实现持久的疾病改善与组织再生。
主要参考资料:[1]:Chen Y, Gao R, Guo X, et al. Mesenchymal stromal cell therapy for rheumatoid arthritis: long-term efficacy, safety, and mechanistic insights. Rheumatol Autoimmun. 2025; 1-13. doi:10.1002/rai2.70032
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复