摘要:间充质干细胞(MSC)的临床疗效异质性,部分可归因于供体年龄与体外扩增诱导的细胞衰老。本文系统综述了间充质干细胞的衰老机制在形态、增殖、分化、免疫调节及旁分泌等方面的功能衰退表型,并从DNA损伤、线粒体功能障碍、衰老相关分泌表型(SASP)及表观遗传失调等多维度阐明了其分子机制。重点探讨了以“线粒体移植”和“表观遗传重编程”为核心的细胞年轻化策略,旨在逆转衰老标志、恢复细胞功能。最后,提出了一个涵盖细胞筛选、体外年轻化干预及临床适配的整合性框架,为将衰老MSC转化为安全有效的治疗制剂提供了理论依据与可行路径。
一、 引言:从“万能预设”到“衰老现实”的范式转变
过去二十年间,间充质干细胞(MSC)因其易于获取、低免疫原性及多向分化潜能,在骨关节炎、自身免疫性疾病、心血管修复与神经退行性疾病等领域的临床研究中被寄予厚望,一度被视为“万能”的再生修复工具。然而,随着大样本临床试验与真实世界研究的深入,MSC疗法的疗效呈现出显著的个体异质性。越来越多的证据指出,供体年龄、基础疾病状态以及体外扩增过程带来的复制性压力,是导致MSC功能持续耗竭、治疗响应不一的关键因素[1]。
这意味着,将MSC视为均一、通用的“现成药物”的传统观念必须修正。我们面对的现实是:特定年龄与生理状态的MSC,是一种功能有限且会随时间衰退的“活体制剂”。因此,深刻理解并主动干预MSC自身的衰老进程,成为破解“以老年供体细胞治疗老年疾病”这一临床困境的前提,决定了MSC疗法在老龄化社会中的最终应用上限[2]。
二、 间充质干细胞的衰老机制表型:从细胞到功能层面的系统性“失能”
1. 经典细胞与分子衰老标志
随着供体年龄增长或体外传代次数增加,间充质干细胞会呈现一系列可量化检测的衰老标志[3]:
-
形态学:细胞体积增大、变得扁平,胞质内空泡增多,细胞骨架(如肌动蛋白丝)排列紊乱、增粗。
-
增殖与克隆形成能力:群体倍增时间显著延长,克隆形成单位(CFU-F)数量急剧下降,细胞周期主要停滞于G1/S期。
-
分子标志物:衰老相关β-半乳糖苷酶(SA-β-gal)活性阳性细胞比例升高;细胞周期抑制蛋白(如p16INK4a, p21Cip1)及肿瘤抑制蛋白p53表达持续上调;端粒酶活性降低,端粒长度缩短。
-
组学特征:转录组分析显示,衰老MSC中与DNA损伤应答、细胞外基质重塑相关的基因表达上调,而与干性维持、迁移和有益旁分泌相关的基因则被抑制,整体呈现一种促纤维化、促炎性的“基质重塑”状态。
2. 核心治疗功能的衰退
功能的衰减比形态变化更具临床破坏性:
-
免疫调节功能紊乱:衰老MSC抑制T细胞增殖的能力减弱,其分泌谱从抗炎转向促炎(如IL-6、IL-8分泌增加),而程序性死亡配体-1(PD-L1)、吲哚胺2,3-双加氧酶(IDO)等关键免疫抑制分子表达不稳定,导致其免疫调节“开关”功能失灵。
-
旁分泌谱失衡:其分泌的外泌体及可溶性因子中,促血管生成和营养因子(如VEGF、HGF、IGF-1)相对减少,促炎因子和细胞外基质(ECM)降解酶(如MMPs)增多,使得本应支持再生的微环境趋向于炎症和纤维化。
-
迁移与归巢能力受损:趋化因子受体(如CXCR4、CCR2)表达下调,整合素等粘附分子功能异常,导致静脉输注后细胞无法有效靶向损伤组织,大量滞留在肺、肝等非靶器官,大幅降低到达病灶的细胞数量。
-
分化潜能偏移:最典型的是成骨分化能力下降,同时成脂倾向增加,这不仅削弱了其在骨质疏松等疾病中的治疗潜力,还可能带来异位脂肪形成的风险。在成软骨、成神经谱系分化中也观察到效率降低和谱系不稳定的问题。
因此,细胞制剂中衰老MSC的比例,直接决定了治疗的“有效窗口期”。建立基于衰老标志物的MSC质量释放标准,已成为该领域质量控制的重要发展方向。
三、 衰老的分子机制图谱:多层级网络的交织与崩塌
间充质干细胞的衰老机制是多种内在损伤累积与信号网络失调的结果,各机制间相互促进,形成恶性循环。
1. DNA损伤与端粒/细胞周期检查点
体外培养的高氧环境、机械剪切力等因素,使MSC易积累DNA双链断裂和端粒损伤。持续的DNA损伤反应(DDR)通路(ATM/ATR-Chk1/Chk2)被激活,进而通过p53-p21和p16INK4a-Rb两条经典通路,驱动细胞周期不可逆地停滞。高龄供体MSC中可检测到更多的DNA损伤焦点(γ-H2AX)和端粒功能障碍,这与SA-β-gal活性的升高及功能衰退高度相关。端粒的耗竭不仅影响基因组稳定性,还可能通过改变端粒染色质结构,引发全基因组范围内的三维构象和基因表达变化。
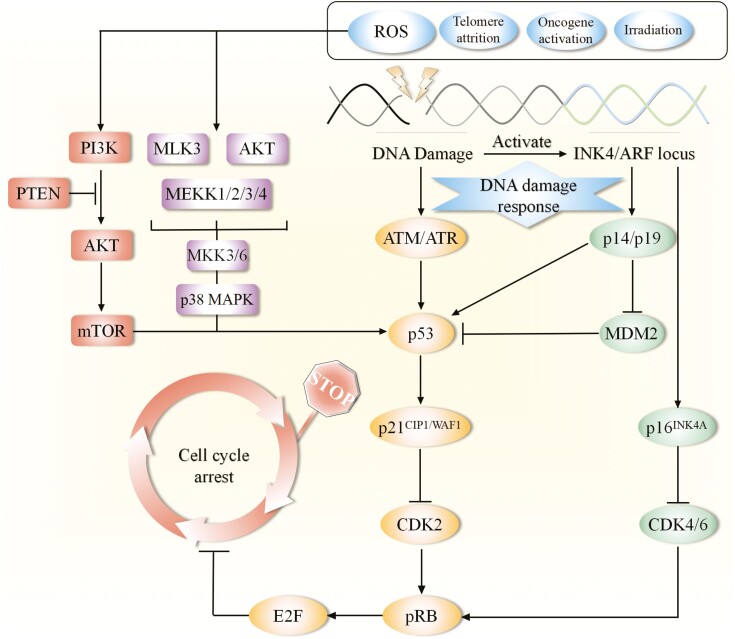
图1:间充质干细胞 (MSC) 细胞周期阻滞中的 DNA 损伤反应网络。衰老 MSC 中的 DNA 损伤反应由内源性和外源性应激触发,例如活性氧 (ROS)、端粒缩短、癌基因激活和辐射,从而激活两条主要的衰老相关信号通路,即 p53/p21 CIP1/WAF1和 p16 INK4A,最终导致细胞周期阻滞和 MSC 衰老。
2. 线粒体功能障碍与氧化应激风暴
衰老MSC的线粒体网络发生显著退化:
-
结构与功能异常:线粒体出现肿胀、嵴结构模糊,膜电位(ΔΨm)下降,三磷酸腺苷(ATP)合成能力减弱。
-
呼吸链效率低下:电子传递链复合体亚基表达减少,导致电子漏增加,活性氧(ROS)产量显著上升。
-
质量控制失灵:线粒体自噬(Mitophagy)过程受阻,受损的线粒体无法被有效清除。
-
恶性正反馈循环:过量ROS既是直接的生物大分子损伤因子,也是重要的信号分子,可进一步激活p38 MAPK、核因子-κB(NF-κB)等促炎和促衰老通路,同时加剧核DNA与线粒体DNA(mtDNA)的损伤,形成“损伤-更多损伤”的自我放大回路。
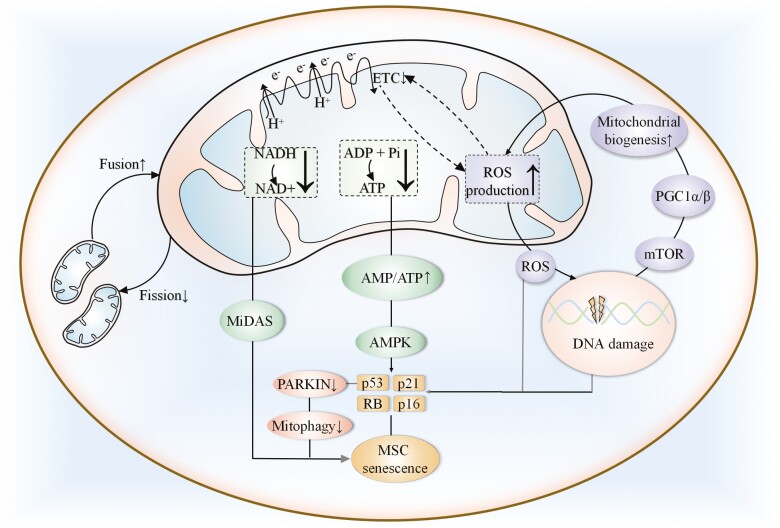
图2:间充质干细胞衰老中的线粒体功能障碍。衰老相关的线粒体功能障碍是间充质干细胞衰老的标志之一,包括线粒体生物合成失调、线粒体自噬减少和线粒体网络过度融合。衰老过程中,AMP/ATP 和 NAD+/NADH 比值发生代谢紊乱,启动下游信号级联反应。值得注意的是,功能异常的线粒体产生的过量活性氧 (ROS) 可能导致 DNA 损伤和 ROS 积累,进而加剧线粒体功能障碍,形成正反馈回路。
3. SASP:从细胞自主衰老到微环境“毒化”
衰老相关分泌表型(SASP)是衰老MSC影响周围组织的核心机制。衰老的MSC会大量分泌白细胞介素-6(IL-6)、IL-8、单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶(MMP-1/3/13)及粒细胞-巨噬细胞集落刺激因子(GM-CSF)等因子。这些因子通过以下途径创造“促衰老微环境”:
-
信号放大:主要由NF-κB和C/EBPβ转录因子驱动,维持SASP基因的高水平表达。
-
信号交叉:JAK/STAT、p38 MAPK等通路进一步强化炎症信号和生长抑制信号。
-
旁分泌衰老:SASP因子可诱导邻近的健康细胞也进入衰老状态,导致局部组织内衰老细胞群体性扩增,严重阻碍组织的再生与修复。因此,“衰老MSC + 衰老组织”构成了一个功能持续恶化的负向循环。
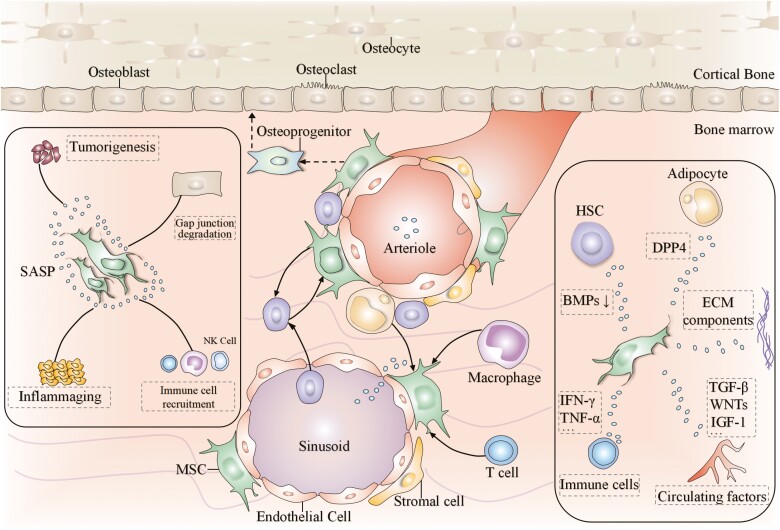
图3:衰老间充质干细胞 (MSC) 与其微环境之间的相互作用。MSC 存在于一个称为干细胞微环境的支持性微环境中。干细胞微环境包含多种类型的细胞、血管网络、分泌的代谢和物理因子以及细胞外基质 (ECM)。一方面,驻留的 MSC 会受到其微环境的深刻影响。另一方面,衰老 MSC 的分泌组变化,例如衰老相关分泌表型 (SASP) 相关因子,会导致干细胞微环境重塑并形成促炎性环境。
4. 表观遗传与“衰老记忆”
表观遗传改变是衰老状态的“分子记忆”。随着年龄和压力累积,MSC的DNA甲基化模式、组蛋白修饰(如H3K9me3增加、H3K27ac减少)和非编码RNA网络发生系统性重编程。
-
干性基因沉默:与自我更新和多向分化相关的基因启动子区域常出现异常高甲基化而被沉默。
-
炎症基因易感:一些应激和炎症反应基因的增强子区域染色质开放性增加,使其更易被NF-κB等因子激活,形成SASP的“表观遗传易感状态”。
这种表观遗传的“记忆”特性,使得衰老状态即使在外界压力暂时解除后也难以自发逆转,同时也为通过干预表观遗传来“擦除”衰老标记、实现年轻化提供了理论基础。
四、 细胞年轻化策略I:线粒体移植——能量系统的“硬件升级”
1. 从“供体”到“受体”:理念的转变
传统上,MSC常作为功能线粒体的“供体”,通过隧道纳米管(TNTs)、细胞外囊泡(EVs)或细胞融合等方式,将健康线粒体转移至受损的体细胞(如心肌细胞、神经元),以挽救其功能。新近的研究则逆向思考:将年轻/健康的线粒体作为“治疗剂”导入衰老的MSC自身,以修复其能量代谢缺陷。
2. 效果与挑战
实验表明,向衰老MSC导入功能性线粒体,可显著提升其氧化磷酸化水平、恢复膜电位、降低ROS,并伴随p38 MAPK/NF-κB通路活性下调、SASP因子减少。功能上,这些细胞的增殖、迁移和成骨分化能力得到改善。然而,该技术面临线粒体获取、高效递送、移植后的长期功能维持及潜在的免疫排斥等挑战。
3. 组合策略
将线粒体移植与药物调控相结合是更可行的路径:
-
线粒体抗氧化剂:如MitoQ,可直接靶向线粒体,清除ROS。
-
激活线粒体生物合成:使用激活AMPK-SIRT1-PGC-1α轴的小分子(如白藜芦醇、二甲双胍),促进新线粒体生成。
-
调节线粒体动力学:通过调控融合蛋白(MFN1/2)和分裂蛋白(DRP1)的表达,恢复其正常的融合-分裂循环。
五、 细胞年轻化策略II:表观遗传重编程——“衰老时钟”的软件重置
1. 从完全重编程到部分重编程
通过导入山中因子(OSKM)可将体细胞重编程为诱导多能干细胞(iPSC),彻底重置其表观遗传年龄,但存在致瘤和细胞身份丢失的风险。因此,“部分重编程” 成为更有前景的策略:通过瞬时、可控地表达重编程因子,使细胞逆转衰老相关表观标记(如DNA甲基化年龄),恢复年轻基因表达谱和功能,但不过度重编程至多能状态,从而保持原有细胞类型和安全性。
2. 非整合性表观调控工具
为避免基因组整合风险,研究者开发了多种工具:
-
小分子药物:组蛋白去乙酰化酶抑制剂(HDACi)、BET蛋白抑制剂、DNA甲基转移酶抑制剂(DNMTi)等,可在一定程度上逆转衰老相关的染色质紧缩状态,部分恢复年轻表型,但需注意其作用的广谱性和潜在脱靶效应。
-
机械刺激与微环境工程:改变培养基质的刚度、施加适当的流体剪切力或采用三维支架培养,可以通过细胞骨架-核骨架连接,直接影响染色质结构和基因表达,诱导出更“年轻”的功能状态。
-
低氧培养:生理性低氧环境(2-5% O₂)是维持MSC干性、延缓体外衰老的有效手段,其本质也是通过稳定HIF等转录因子来调控细胞的表观遗传和代谢状态。
六、 整合框架:构建面向临床的“准年轻化”MSC治疗产品
为应对“老细胞治老病”的挑战,需建立一个从源头到床旁的全程化策略:
1. 上游:精细化筛选与质控
-
供体评估:将供体年龄、健康状况(如是否患糖尿病、代谢综合征)纳入筛选体系。
-
过程监控:在细胞制备过程中,引入SA-β-gal活性、p16/p21表达、端粒长度、线粒体膜电位、ROS水平及表观遗传年龄(如DNA甲基化时钟)等多维度衰老标志物作为质控指标。
-
亚群富集:利用流式细胞术或单细胞测序技术,识别并分选“低衰老/高功能”的MSC亚群用于生产。
2. 中游:标准化“年轻化”制备流程
在良好生产规范(GMP)框架下,整合模块化的年轻化干预单元:
-
培养条件优化:采用低氧联合抗氧化剂(如N-乙酰半胱氨酸)的培养体系,从源头减少氧化损伤。
-
线粒体功能增强:在培养体系中添加线粒体保护剂或生物合成激活剂。
-
表观遗传重塑:探索使用安全、可控的小分子“鸡尾酒”方案,或在严格监控下进行瞬时的部分重编程处理。
-
仿生支架应用:利用具有适宜力学性能和拓扑结构的三维生物材料进行扩增,引导细胞维持更年轻的状态。
3. 下游:临床精准应用与联合策略
在老年骨关节炎、骨质疏松、老年性心衰和神经退行等“老病”胁迫下,可:
-
以“年轻MSC”为核心,联用抗炎药物、SASP调节剂或免疫调节剂,以增加潜在的SASP风险。
-
根据靶组织特点设计路径与剂量,如关节腔局部注射vs静脉/动脉输注,结合图像追踪和功能评估,动态调整治疗方案。
-
结合微环境调节,如控制血压、改善营养、抗氧化和认知运动,为外源MSC提供“更年轻”的着陆环境,降低其二次老年人的速度。
七、 结语
间充质干细胞的“万能”光环之下,潜藏着其作为生命体必然经历的衰老宿命。供体年龄和体外扩增导致的细胞功能衰退,是横亘在其临床应用理想与现实之间的核心障碍。所幸,科学的发展正使我们从被动的“筛选者”转向主动的“重塑者”。线粒体移植与表观遗传重编程等前沿技术,为我们提供了在分子和细胞层面干预“衰老时钟”的强大工具。
未来的成功,或许不在于寻找永不衰老的“完美细胞”,而在于通过标准化、可监管的工程化手段,将“老细胞”稳定地重编程至一个功能恢复、安全可控的“治疗性年轻态”。这要求再生医学领域融合细胞生物学、生物材料学、基因工程和临床医学等多学科智慧,共同将MSC从一种充满不确定性的“生物材料”,改造为一种设计精密、质量均一、疗效可预测的“活体药物”。唯有如此,我们才能真正兑现“用老细胞根治老病”的承诺,让再生医学更好地服务于老龄化社会。
主要参考资料:
[1]:https://pmc.ncbi.nlm.nih.gov/articles/PMC12434831/
[2]:https://pubs.acs.org/doi/10.1021/acsptsci.4c00284
[3]:https://pmc.ncbi.nlm.nih.gov/articles/PMC9052415/
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复