
本文基于《Regenerative Therapy》2025年12月时间段上发表的一篇综述文章,这篇综述系统梳理了间充质干细胞治疗阿尔茨海默病中的临床前与临床应用、潜在作用机制、当前面临的局限性以及未来可能的解决方案[1]。
阿尔茨海默病的病理机制
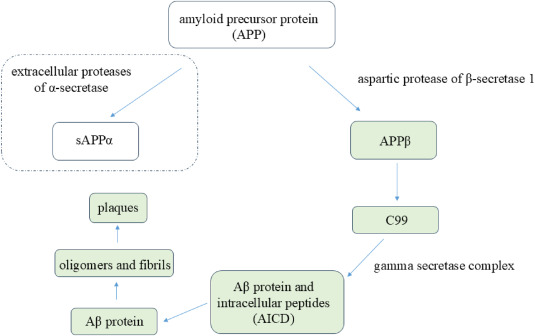
图1:由β-淀粉样蛋白介导的AD病理过程
另一关键机制是tau蛋白异常磷酸化与神经原纤维缠结(NFTs)的形成。正常情况下,tau蛋白参与微管稳定和轴突运输,但在AD中,tau蛋白在特定位点发生过度磷酸化、错误折叠并聚集成不溶性纤维。这些异常聚集的tau蛋白形成NFTs,破坏神经元骨架结构,损害细胞内运输,最终导致神经元死亡。该过程与认知障碍的进展密切相关,且错误折叠的tau蛋白可在脑内沿神经连接扩散,加剧病变(图2)。
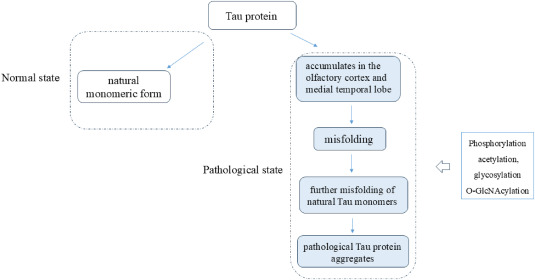
图2:由Tau蛋白介导的AD病理过程。
此外,遗传因素与环境风险共同影响疾病的发生发展。基因方面,早老素(PSEN1/PSEN2)突变可通过影响γ-分泌酶功能促进Aβ生成,而APOEε4等位基因则会增加Aβ沉积与炎症风险。环境因素如PM2.5暴露、吸烟等可通过诱导神经炎症、氧化应激及血管损伤,加速病理进程。这些因素相互作用,解释了AD多数病例的多因素、散发性特征。
综上所述,AD的病理机制是多种过程相互交织的复杂网络:Aβ沉积与tau蛋白病变构成核心病理,二者协同作用导致突触丢失和神经元死亡;遗传背景调控个体易感性,环境因素则作为重要诱因;同时,神经炎症、氧化应激和血管功能障碍等过程贯穿始终,共同推动认知功能的进行性衰退。这一多机制并行的特点也为AD的药物研发带来了挑战。
阿尔茨海默病目前的治疗策略
目前,阿尔茨海默病的治疗原则主要包括早期诊断、及时干预和终身管理。
现有治疗手段可分为药物和非药物两大类,二者常结合使用以优化疗效。
在药物治疗方面,常用药物包括胆碱酯酶抑制剂、兴奋性氨基酸受体拮抗剂、单克隆抗体药物以及对症治疗药物。这些药物已被证实具有一定的神经保护作用,安全性较好,并能一定程度上改善认知功能。然而,其疗效仍然有限,且尚无充分证据表明它们能够逆转或阻止疾病进展。此外,这些药物还可能引发腹泻、恶心、呕吐和头晕等不良反应。

非药物疗法则涵盖认知训练、运动疗法、感觉刺激疗法、环境疗法和饮食干预等多种方式。这些干预措施有助于减轻神经精神症状,且经济成本较低、副作用极少。但其局限性在于疗效可能随时间减弱,且需要患者长期坚持,这对部分患者而言是一大挑战。
表1总结了间充质干细胞疗法与现有药物及非药物疗法的比较。尽管现有手段能在一定程度上控制症状,AD治疗领域仍亟需能够改变疾病进程的新方法,这也为间充质干细胞等新型治疗策略提供了探索空间。
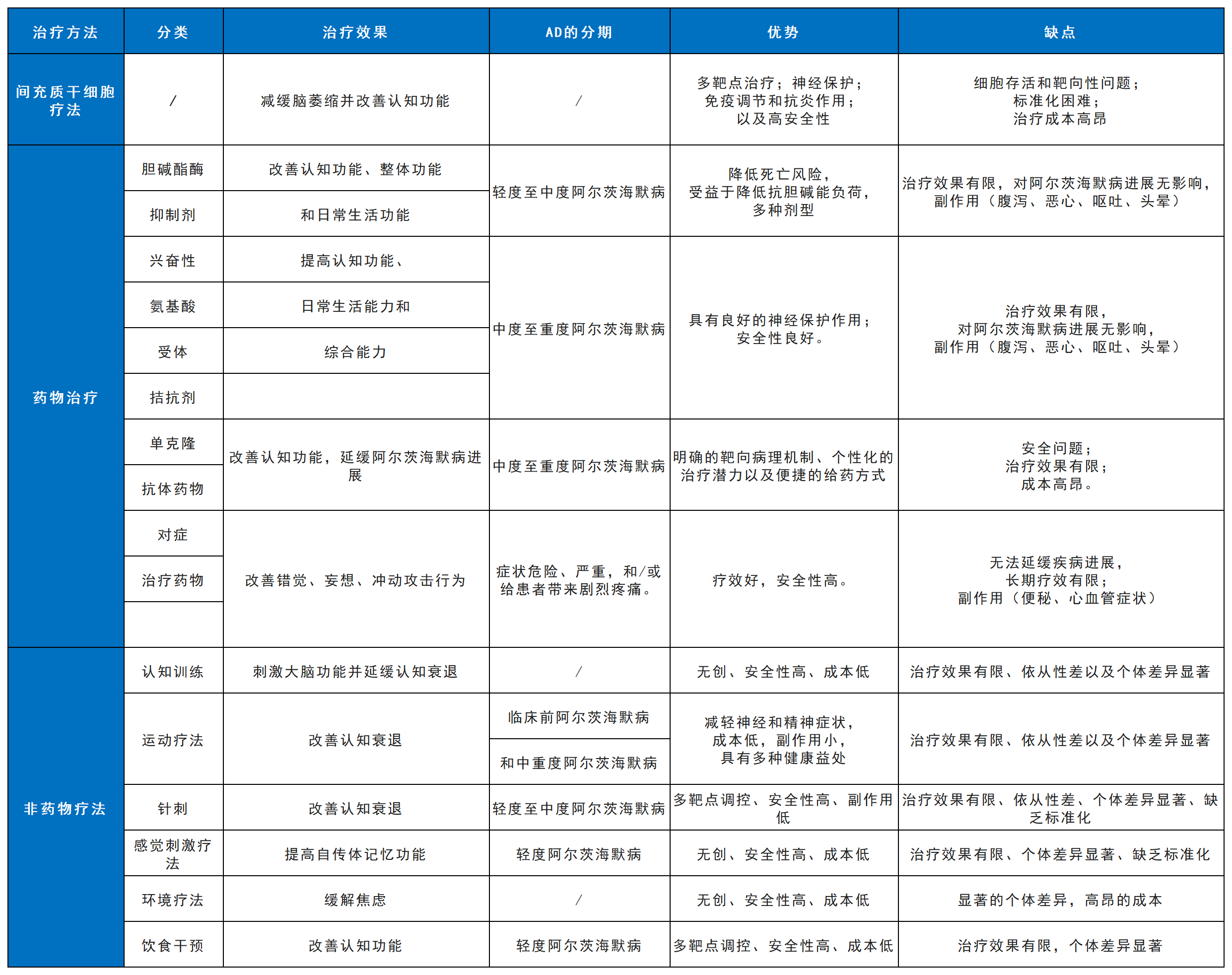
表1:MSC疗法、药物治疗和非药物疗法在AD治疗中的优缺点总结。
间充质干细胞在阿尔茨海默病中的临床前应用
此外,研究显示造血干细胞(HSCs)能在中枢神经系统中扩增、分布并分化为髓系细胞,移植后可促进AD动物模型内Aβ的降解和吞噬。Yalan Lu等人证明,向AD大鼠注射骨髓间充质干细胞(BMMSCs)来源的细胞因子可增强认知功能、减少β-淀粉样蛋白沉积并降低神经元凋亡,这一效应与AKT/IAP信号通路的调控有关。
我们在表2中总结了间充质干细胞在AD治疗中的最新研究进展,包括其治疗效果与作用机制,这些临床前证据为后续临床应用奠定了基础。
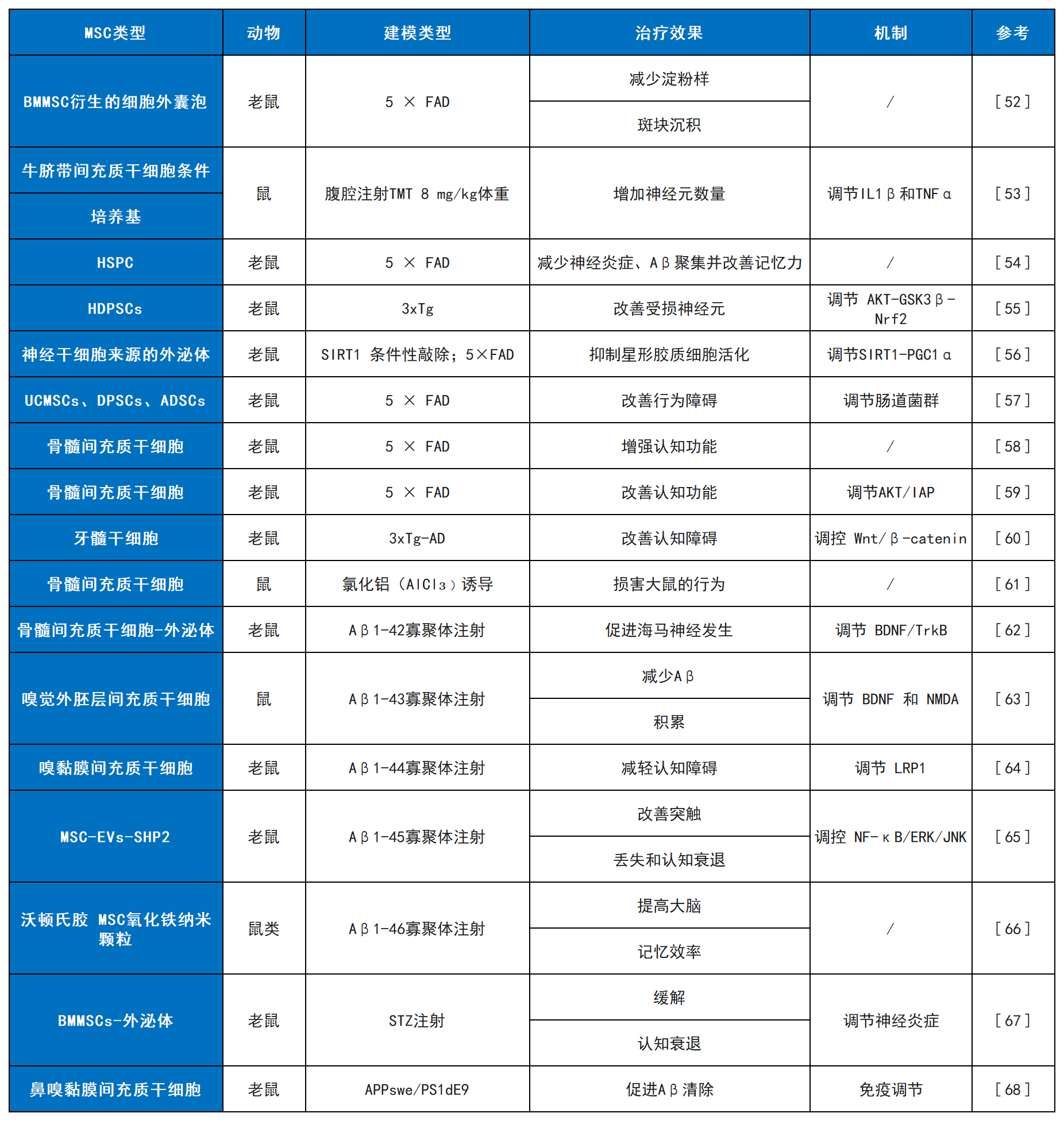
表2:MSCs在AD中的应用研究进展总结
间充质干细胞在治疗阿尔茨海默病中的临床应用
为了系统地开展药物研发,验证间充质干细胞(MSCs)在阿尔茨海默病(AD)中的临床和药理作用,并确定其安全性和有效性,已开展了多项MSCs治疗AD的临床试验。
2021年,韩国首尔三星医疗中心阿尔茨海默病融合研究中心的研究人员设计并开展了阿尔茨海默病痴呆患者脑室内注射人脐带血间充质干细胞:一项I期临床试验。

向阿尔茨海默病痴呆患者脑室内注射人脐带血间充质干细胞:一项 I 期临床试验

自体脂肪组织来源干细胞移植治疗衰老相关低度炎症患者的安全性和有效性:一项单组、开放标签、I期临床试验
通过脑室内注射的方式,评估了脂肪来源的基质血管成分(ADSVF,包含8%的造血干细胞和7.5%的脂肪干细胞)在31例患者中的安全性和有效性。数据显示,这种ADSVF能够改善阿尔茨海默病患者的认知功能,并降低磷酸化tau蛋白和β-淀粉样蛋白的水平。
具体而言,经过2年的随访,患者的海马体积从第5百分位增加到第48百分位,其中一名阿尔茨海默病患者接受了8次ADSVF注射。ADSVF注射的副作用包括短暂性脑膜刺激征、头痛、发热以及需要住院治疗。
2025年3月,在《Nature Medicine》上发表的一项“异体间充质干细胞联合拉罗美司特罗治疗轻度阿尔茨海默病:一项随机对照IIa期试验”。

异体间充质干细胞联合拉罗美司特罗治疗轻度阿尔茨海默病:一项随机对照 IIa 期试验
结论与展望
间充质干细胞(MSCs)因其多能分化、免疫调节和易于获取的特性,在治疗阿尔茨海默病(AD)中展现出显著的应用潜力和前景。
理论上,MSCs能够通过分化为神经细胞、调节炎症反应、减少淀粉样蛋白沉积和tau蛋白过度磷酸化等多种机制,来缓解AD的病理进程并改善认知功能,这使其成为一种极具吸引力的新型治疗策略。
然而,MSCs的临床应用面临两大核心挑战。
- 一是MSCs存在显著的异质性,包括因分离纯化方法(依赖不同表面标志物)导致的表型异质性,以及其在代谢、信号传导和分泌功能上的功能异质性,这些因素直接影响治疗效果的一致性和可预测性。
- 二是临床转化存在瓶颈,尽管动物实验效果积极,但现有临床试验报告了头痛、发热等不良反应,且整体临床应用规模有限,亟需更大规模、设计更规范、监管更严格的临床试验来验证其安全性与有效性。
展望未来,推动间充质干细胞治疗阿尔茨海默病的关键在于多方面的协同改进。
- 首先,需要完善相关法规,优化MSCs的制备、质控和个性化治疗方案以提高其纯度和治疗安全性。
- 其次,必须通过标准化、国际合作的临床研究来积累可靠数据,并探索联合治疗等新策略。
随着生命科学技术的发展和对上述问题的逐步解决,间充质干细胞有望在阿尔茨海默病的治疗领域取得实质性突破。
参考资料:
[1]:https://www.sciencedirect.com/science/article/pii/S2352320425001609?via%3Dihub #bib89 免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复