脂肪干细胞因其微创提取和高丰度获取方式,极大地推动了再生医学的研究。干细胞一直是组织重建和损伤修复的关键研究领域。由于缺乏有效的再生疗法,许多疾病缺乏合适的治疗方案。干细胞的出现促进了这些疗法的发展,尤其适用于严重的组织损伤。脂肪干细胞提供了一种更优的选择,目前已有多个临床试验正在探索其在各种疾病中的应用。
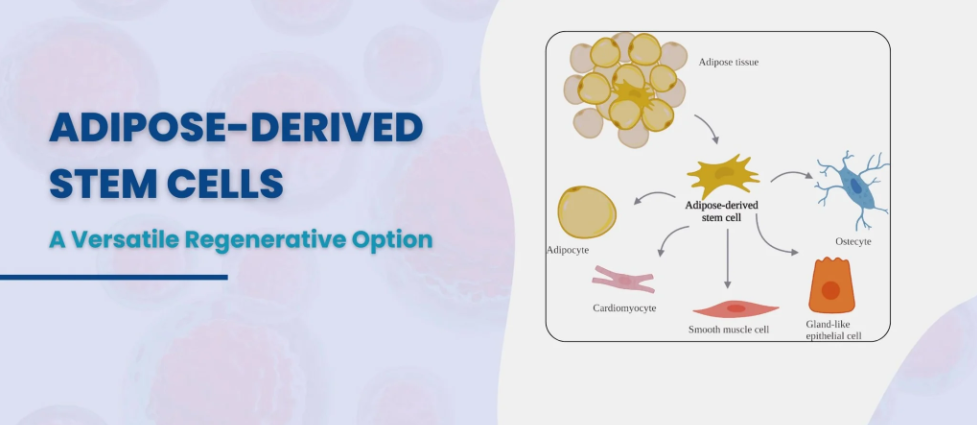
脂肪来源干细胞
2001年,脂肪组织被确认为间充质干细胞(MSCs)的新来源。这些细胞,也称为脂肪来源干细胞,由于脂肪组织储量丰富,展现出广阔的应用前景。脂肪组织是储存脂肪的区域,常见于皮下、内脏和肌肉组织。脂肪组织的普遍存在使得人们能够大量且顺利地获取干细胞。
皮下组织是常用的人类脂肪干细胞(ASCs)来源,通常从腹部、手臂和大腿等部位分离。ASCs的特性因其所在位置而异。例如,来自腹部浅表区域的ASCs比来自手臂的ASCs凋亡更少。ASCs在组织内的具体位置尚存争议,目前认为它们位于血管附近或血管内。尽管ASCs起源于中胚层,但它们已显示出分化为肌源性、神经源性和心血管源性细胞的能力,这表明它们具有潜在的治疗价值。
隔离过程
分离过程采用酶消化法。脂肪组织提取前先用缓冲液洗涤,随后在II型胶原酶溶液中孵育。酶消化后得到细胞沉淀,称为基质血管组分(SVF)。下一步加入培养基可使酶失活。洗涤细胞并将其重悬于低渗NH4Cl或NaCl溶液中以去除红细胞。
将SVF通过滤网过滤,分离组织碎片。经过最后一次洗涤后,将SVF接种于含CO2培养箱的培养基中,即可获得多种细胞群,包括前脂肪细胞、内皮细胞、脂肪干细胞(ASCs)、免疫细胞、成纤维细胞、平滑肌细胞等。其中,脂肪干细胞(ASCs)会黏附于培养皿,其他细胞可通过洗涤去除,从而获得ASCs。ASCs呈梭形,倍增时间约为2-5天。
脂肪来源干细胞的特性分析
分离的脂肪干细胞(ASC)并非同质细胞群,需要进行适当的鉴定。国际细胞治疗协会(ISCT)已制定了ASC鉴定的标准,包括细胞在培养板上的黏附性、标志物的表达以及阴性标志物的低表达或可忽略不计的表达。阳性标志物包括CD106、CD90和CD73,超过80%的细胞表达CD44、CD29和CD13。阴性标志物属于造血谱系,例如CD34、CD11b、CD45、HLA-DR、CD19、CD31和CD235a。此外,还可以通过功能性检测来验证ASC的鉴定,例如评估其分化为前脂肪细胞、成骨细胞和软骨细胞的能力。
然而,在第一代传代中,ASCs表达CD34,但随着传代次数的增加,CD34表达逐渐降低。到第二代时,它们会失去造血标志物并获得间充质标志物。因此,第二代传代的ASCs群体更加均一。ASCs的冷冻保存不会影响其功能,从而促进了它们在细胞培养研究中的应用。
脂肪干细胞的应用
2004年,首个使用脂肪干细胞(ASCs)的临床试验报告发表。该报告证实,ASCs对一名患有颅骨缺损的7岁女孩具有治疗效果。这些细胞还表现出抗炎和免疫调节特性。通过输注同种异体ASCs,这些特性有效地治疗了难治性移植物抗宿主病。此外,ASCs能够迁移至损伤和肿瘤组织,表明它们在将治疗药物递送至肿瘤部位方面发挥着重要作用。因此,ASCs在疾病治疗方面具有广阔的应用前景。以下列举了这些细胞的一些应用。
伤口愈合
脂肪干细胞(ASCs)分泌多种生长因子,通过旁分泌信号传导促进组织愈合。此外,它们还能募集免疫细胞,并利用粒细胞集落刺激因子(G-CSF)、表皮生长因子(EGF)、血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)等生长因子刺激血管生成,从而促进伤口愈合。动物实验表明,ASCs输注后瘢痕面积缩小。与支架结合使用可提高其在组织中的效力和存活率。ASCs培养基为伤口愈合提供了一种无细胞的替代方案。因此,ASCs有望用于治疗糖尿病足溃疡、烧伤瘢痕、皮肤损伤和溃疡。
骨再生
脂肪干细胞(ASCs)可分化为成骨细胞和软骨细胞,用于治疗骨骼疾病。它们已被证实能够修复软骨缺损和颌面部缺损。这些细胞还会释放诸如成纤维细胞生长因子(FGF)、基质金属蛋白酶(MMP)、骨形态发生蛋白2(BMP2)等刺激骨形成的因子。此外,将ASCs接种于支架上可改善骨骼结构和特性。在支架中添加能够诱导ASCs分化的生长因子和miRNA也能进一步提升治疗效果。目前已有许多合成材料、天然材料和复合材料被用于骨再生,每种材料各有优缺点。临床试验已证实支架的有效性。然而,该技术仍需进一步标准化。
神经系统再生
脂肪干细胞(ASCs)可以分化为神经元和支持神经元功能的雪旺氏细胞。此外,ASCs还能分泌多种神经营养因子,例如脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)、胰岛素样生长因子1(IGF1)、成纤维细胞生长因子(FGF)等。分化后的神经元表达更多的神经元标志物,并且比其他干细胞具有更高的增殖速率。ASCs的抗凋亡和抗炎特性也有助于促进神经修复。
它们还能提高M2型小胶质细胞与M1型小胶质细胞的比例,从而减轻神经炎症。ASCs还会释放外泌体,下调导致炎症的NF-κB和MAPK信号通路。ASCs疗法已在脊髓损伤模型中显示出功能恢复的迹象。这些细胞在周围神经损伤中表现出髓鞘纤维增多和神经组织结构改善。神经系统疾病目前尚无绝对治愈的方法。ASCs有望成为此类疾病的一种潜在治疗方法。
心血管疾病
心血管疾病一直是导致死亡和并发症的主要原因。研究表明,ASC疗法具有积极的疗效。ASC可分化为心肌细胞,并释放抗凋亡、血管生成、抗炎和抗纤维化因子。ASC给药可缩小心肌梗死面积,改善心脏功能,并促进血管生成。
然而,疗效会因给药途径的不同而有所差异。更多策略,例如对脂肪干细胞进行基因工程改造、将细胞与细胞外基质联合使用、干细胞预处理等,均已取得良好效果。ATHENA 和 APOLLO 的 I 期和 II 期临床试验均显示心脏瘢痕面积缩小。进一步的研究和试验有望提供更准确的结果。
肝脏再生
缺血再灌注损伤是肝脏手术常见的术后并发症。ASC移植表现出增强的抗氧化活性和损伤相关生物标志物的下降。它们还能分泌再生因子并抑制炎症细胞因子,从而减轻损伤。在大动物模型中,ASC治疗显示出改善肝功能和结构的疗效。在肝硬化模型中,ASC通过诱导肌成纤维细胞凋亡和降低氧化应激来减轻肝纤维化。因此,ASC有望成为治疗肝脏疾病的有效疗法。
结论
脂肪干细胞(ASCs)能够分化为非中胚层细胞,这拓宽了干细胞疗法的应用范围。此外,其丰富的储量也极大地促进了其在研究和临床试验中的应用。早期研究显示,ASCs的给药已取得积极成果。然而,流程标准化仍然是其应用于临床的关键步骤。更多研究有望进一步提升其治疗潜力。Kosheeka通过提供质量和纯度有保障的人类ASCs,加速了相关研究的进展。
常见问题解答
问:脂肪干细胞(ASCs)是从哪里提取的?
它们是从皮下和内脏区域的脂肪组织中分离出来的。分离主要在手臂、大腿和腹部的皮下区域进行。
问:ASCs可以分化成哪些细胞?
脂肪干细胞是中胚层细胞,可分化为脂肪细胞、成骨细胞和软骨细胞。然而,它们也被证实可以转化为心肌细胞、肌肉细胞、神经元和血管细胞。
问:ASC 的标志物是什么?
ASC 的阳性标志物有:CD106、CD90、CD73、CD44、CD29 和 CD13。阴性标志物包括 CD34、CD11b、CD45、HLA-DR、CD19、CD31 和 CD235a。
问:通过标记进行表征是否足以鉴定ASC?
为了鉴定 ASC,还应进行功能性检测,以测试 ASC 向脂肪前体细胞、软骨细胞和成骨细胞的分化情况。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复