干细胞研究因其在再生和修复疗法中的应用而成为快速发展的领域。间充质干细胞(MSCs)因其对多种不治之症的疗效而成为干细胞疗法的重要组成部分。获取间充质干细胞的研究取得了巨大进展。然而,从骨髓或脂肪组织中提取间充质干细胞通常需要进行侵入性手术。脐带间充质干细胞的采集仅限于分娩。但牙髓干细胞为间充质干细胞提供了一种新的来源。牙齿属于医疗废弃物,且不依赖于特定的医疗条件。因此,利用牙髓作为间充质干细胞的来源是一种更具吸引力的选择。
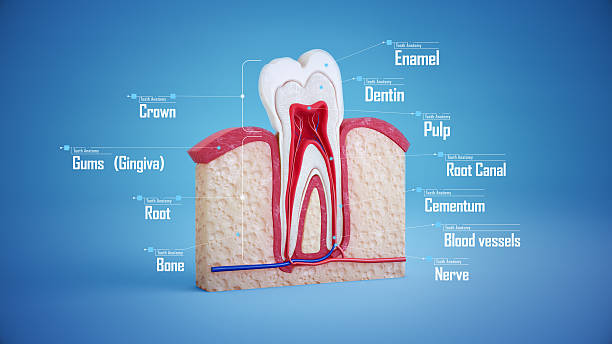
牙髓干细胞
牙髓是存在于牙齿矿化腔内的结缔组织。它包含间充质干细胞(MSCs)、神经细胞、血管和淋巴管。血管和神经纤维通过牙根尖端的开口进入牙髓。牙髓来源的间充质干细胞(DPMSCs)与骨髓间充质干细胞(BMMSCs)有许多相似之处,但也存在一些差异。例如,DPMSCs中3G5的表达高于BMMSCs。
GFAP、P75、HNK-1、S100 和 Nestin 等标记物的存在表明这些细胞来源于颅神经嵴细胞。因此,这些细胞具有分化为神经元、胰岛β细胞、内皮细胞和心肌细胞的能力。此外,它们还可以像骨髓间充质干细胞 (BMMSC) 一样形成脂肪细胞、成骨细胞和软骨细胞。
牙髓干细胞分离
来源:最初的分离方法采用第三磨牙作为细胞来源。然而,脱落的乳牙(也称婴儿牙)也被证明是极佳的细胞来源。科学家们强调了牙髓干细胞(DPSCs)来源的细节。来自乳牙的干细胞被称为SHEDs,而源自乳牙的干细胞则被称为SCDs。据报道,SHEDs具有更高的增殖速率,并具有更强的多能性和神经外胚层标志物。
牙髓分离方法:牙髓分离主要有两种方法。最早的分离方法是酶解法,需要解剖牙齿以获取牙髓组织,然后用胶原酶和分散酶消化牙髓。另一种方法是外植体培养法,即将牙髓组织置于培养基中培养,细胞逐渐转移到培养基中。
表征:该流程遵循细胞表面标志物分析。由于其与骨髓间充质干细胞(BMMSCs)的相似性,其表征过程与BMMSCs相同。例如,通过检测BMMSCs标志物(CD29、CD90、CD105、CD73、STRO-1、CD44、CD146、CD166和CD271)的阳性表达以及造血标志物的阴性表达来评估其特性。此外,功能表征通过不同的检测方法评估牙髓干细胞(DPSCs)向脂肪生成、成骨和软骨生成谱系的分化能力。
免疫调节特性
多项研究报告强调了牙髓干细胞(DPSCs)的免疫调节特性。体外DPSCs与T淋巴细胞共培养实验表明,DPSCs可抑制T淋巴细胞增殖,使其停滞于细胞周期的G0/G1期。DPSCs的条件培养基也能抑制外周血单核细胞的增殖。此外,DPSCs还能释放IL-10和TGF-β,从而促进调节性T淋巴细胞的增殖。在共培养模型中,DPSCs还能抑制巨噬细胞分泌炎症介质。
干细胞的命运
表观遗传因素决定干细胞的命运,包括组蛋白去乙酰化和DNA甲基化。组蛋白去乙酰化酶(HDACs)是一类调控染色质结构并进而影响其后续基因表达的酶。HDAC抑制剂丙戊酸可改善牙髓干细胞(DPSCs)中骨相关基因的表达和基质形成。皮下移植到小鼠体内后,这些细胞还能形成骨组织。同样,另一种HDAC抑制剂曲古抑菌素A也能改善DPSCs的更新和迁移能力。
临床应用
分离后可用的牙髓干细胞数量较少,这可能会限制其未来的应用。研究表明,牙髓干细胞可以长期培养而不丧失其形态或干细胞标志物。此外,它们的HLA-II DR表达水平较低,这表明输注后发生免疫反应的可能性较小。鉴于上述两方面的优势,牙髓干细胞的应用已得到研究。
神经再生
牙髓干细胞(DPSCs)属于神经嵴细胞,因此具有分化为神经元的能力。它们还能产生神经营养因子,促进神经元存活。动物研究表明,将DPSCs移植到脊髓中可提高运动神经元的质量,从而证明了其在治疗多种神经系统疾病方面的潜在价值。
视网膜再生
研究表明,牙髓干细胞(DPSCs)在视网膜疾病中发挥着重要作用,因为它们在与大鼠视网膜细胞共培养后能够表达多种神经营养因子,例如神经营养因子-3、脑源性神经营养因子和神经生长因子。此外,它们还表达感光细胞的标志物,这支持了它们具有视觉修复能力。
骨再生
牙髓干细胞(DPSCs)的成骨能力促进了其在骨组织工程中的应用。骨组织工程利用具有骨诱导性的三维(3D)支架来生成矿化骨组织。将DPSCs植入由羟基磷灰石和磷酸三钙构成的多孔支架中,可形成矿化良好的骨组织以及部分发育的造血组织。添加某些生长因子,例如骨形态发生蛋白-2(BMP2),可增强其成骨诱导性。此外,将DPSCs分化为成骨细胞,并在由胶原蛋白、羟基磷灰石和聚乳酸-己内酯(PLCO)构成的支架上进行培养,可刺激成骨细胞增殖。因此,DPSCs可有效治疗骨科疾病。
血管再生
牙髓干细胞(DPSCs)分泌血管内皮生长因子(VEGF),并可分化为具有修复血管损伤潜能的内皮细胞。在心肌梗死大鼠模型中,DPSCs可缩小梗死面积并增加血管数量。利用DPSCs在Matrigel基质胶上形成管状结构,证实了其新生血管生成能力。在肢体缺血模型中,DPSCs输注可增强血流并促进血管生成。其血管生成能力在卒中和心血管疾病等疾病的治疗中具有显著的益处。
肝移植
体外研究表明,牙髓干细胞(DPSCs)可以分化为肝细胞,并整合其形态和功能。分化后的细胞能够执行肝脏功能,例如糖原储存、尿素生成等。因此,牙髓干细胞未来有望用于治疗肝脏疾病。
糖尿病治疗
多项研究报告描述了牙髓干细胞(DPSCs)向β细胞的分化。这些研究显示,分化后的β细胞能够分泌葡萄糖依赖性胰岛素,并表达β细胞发育相关基因,例如十二指肠同源框1(DHO-1)、胰岛素等。这些分化后的β细胞形成类似胰岛的细胞簇,能够逆转糖尿病小鼠模型中的高血糖症。
简而言之
牙髓干细胞 (DPSC) 为间充质干细胞 (MSC) 提供了一种新型且易于获取的来源。牙齿作为医疗废弃物,甚至可能为未来建立 DPSC 库铺平道路。DPSC 与其他 MSC 的区别在于其发育过程,这赋予了它们分化为神经元细胞的特性。目前,研究主要集中在阐明其分化机制及其潜在的治疗应用。随着 MSC 在临床试验中的进展,DPSC 或许很快就能迎来临床应用。我们提供经过广泛测试和鉴定的 DPSC,助力您的干细胞研究。
常见问题解答
问:牙髓干细胞(DPSCs)存在于哪里?
它们存在于牙髓组织中——牙髓组织是牙齿内部的一种柔软的结缔组织。
问:牙髓干细胞来源于哪里?
它们起源于神经嵴细胞,因此具有分化成神经元、胰腺细胞和肝细胞的能力。
问:牙髓干细胞的标志物是什么?
由于牙髓干细胞(DPSCs)与间充质干细胞(MSCs)相似,因此用于鉴定DPSCs的标记物和检测方法也与MSCs相同。DPSCs的标记物包括CD90、CD44、CD271和STRO-1。此外,还可以检测神经标记物,例如GFAP、S100和P75等。
问:牙髓干细胞是否也具有免疫调节特性?
是的,与 MSC 一样,DPSC 也具有免疫调节特性,可以抑制免疫细胞的增殖并刺激调节性 T 淋巴细胞。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复