作为替代肝移植的潜在策略,肝祖细胞治疗肝硬化的研究旨在解决供体器官短缺和手术风险两大核心瓶颈。在此背景下,本研究开发了一种将人原代肝细胞转化为可扩增的肝细胞衍生肝祖细胞样细胞(HepLPCs)的方案,这些细胞能够分泌高水平的基质金属蛋白酶和肝细胞生长因子。
近日,上海交通大学医学院附属仁济医院的多个科室联合中国上海海军军医大学东方肝胆外科医院临床检验科、德国汉诺威医学院等研究机构在《Cell Discovery》上发表了一项肝祖细胞治疗针对9名肝硬化患者的首次人体临床试验结果[1]。

研究结果表明,经肝动脉输注HepLPCs安全可行,且在6个月随访期内,8名完成随访的患者在肝脏生化、凝血功能及门静脉高压等多个关键指标上表现出显着改善,为肝硬化治疗提供了一种极具前景的新策略。
一、引言:肝硬化的治疗挑战与细胞治疗新方向
肝硬化是一种严重的慢性肝脏疾病,其特征是肝脏进行性瘢痕形成和功能损害,最终导致代谢、解毒及合成等关键功能的丧失。常见病因包括病毒性肝炎、酒精中毒及非酒精性脂肪肝等。肝移植虽是根治手段,却面临供体短缺、手术风险高和免疫排斥等挑战,使得开发替代疗法成为当务之急。
细胞移植是近年来备受关注的新策略。其中,胎肝细胞移植虽显示出潜力,但受限于伦理与实际操作问题。近期研究表明,通过化学重编程可将成熟肝细胞转化为增殖性肝祖细胞样细胞(HepLPCs),这些细胞与胎肝细胞具有相似的基因表达谱,在促进肝脏再生方面展现前景,但其对肝硬化的具体治疗效果仍需深入验证。
为此,本研究成功通过化学重编程将人原代肝细胞转化为可扩增的肝祖细胞(HepLPCs)。在培养过程中,这些细胞能够分泌促进肝脏再生并抑制纤维化的因子;在肝硬化大鼠模型中,HepLPCs展现出明显的抗纤维化作用与再生潜力。
毒理学风险评估完成后,一项纳入9名肝硬化患者的临床研究进一步验证了HepLPCs在治疗肝硬化方面的安全性及潜在疗效。临床前及临床研究的综合数据共同表明,HepLPCs具备良好的安全性及治疗前景,因此有望为解决肝硬化患者尚未满足的临床需求提供潜在突破。
二、如何生产出符合良好生产规范(GMP)和质量保证的HepLPC?
为确保临床应用的安全性与一致性,本研究在良好生产规范(GMP)条件下生产HepLPCs(图1)。
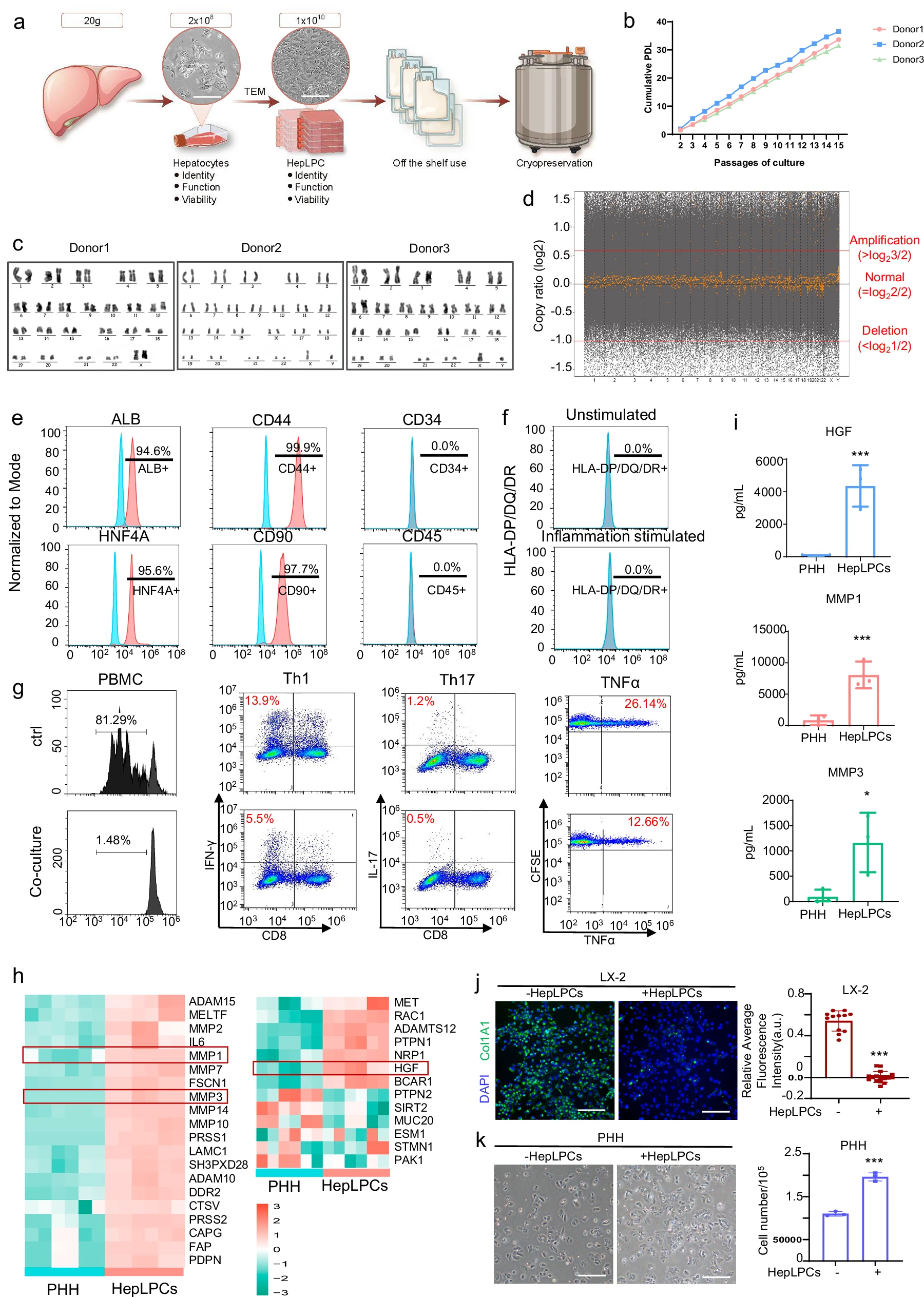
图1:符合GMP标准的HepLPC生产的特性。
标准化的培养体系:使用人原代肝细胞作为起始材料,在成分明确的无动物源性培养基中进行化学重编程,确保了生产过程的标准化。
全过程质量控制:建立了双层细胞库系统,并制定了严格的放行标准,对细胞进行特性、无菌性和安全性评估,保证最终产品符合预定义规格。
细胞特性与安全性验证:核型分析和全基因组测序证实了细胞的基因组稳定性。流式细胞术分析显示,HepLPCs同时表达肝脏特异性基因与干细胞/祖细胞基因,且不表达MHC II类抗原,具备低免疫原性。
功能效力确认:转录组学与功能实验证实,HepLPCs能高效分泌肝细胞生长因子(HGF)和基质金属蛋白酶(MMPs),在功能层面具备促进肝脏再生与抑制纤维化的双重潜力。
三、临床前研究:HepLPCs在大鼠模型中证实其疗效与安全性
治疗效果方面,在由硫代乙酰胺诱导的晚期肝硬化大鼠模型中,经门静脉移植人源HepLPCs显示出显着的治疗益处。与阴性对照组相比,HepLPCs治疗组大鼠的肝脏纤维化程度得到明显改善,具体表现为细胞外基质的主要成分(如胶原蛋白Col1a1和纤连蛋白)的积累显着减少。这些免疫组化结果直接证实了HepLPCs具备减轻乃至逆转肝纤维化的强大潜力(图2)。
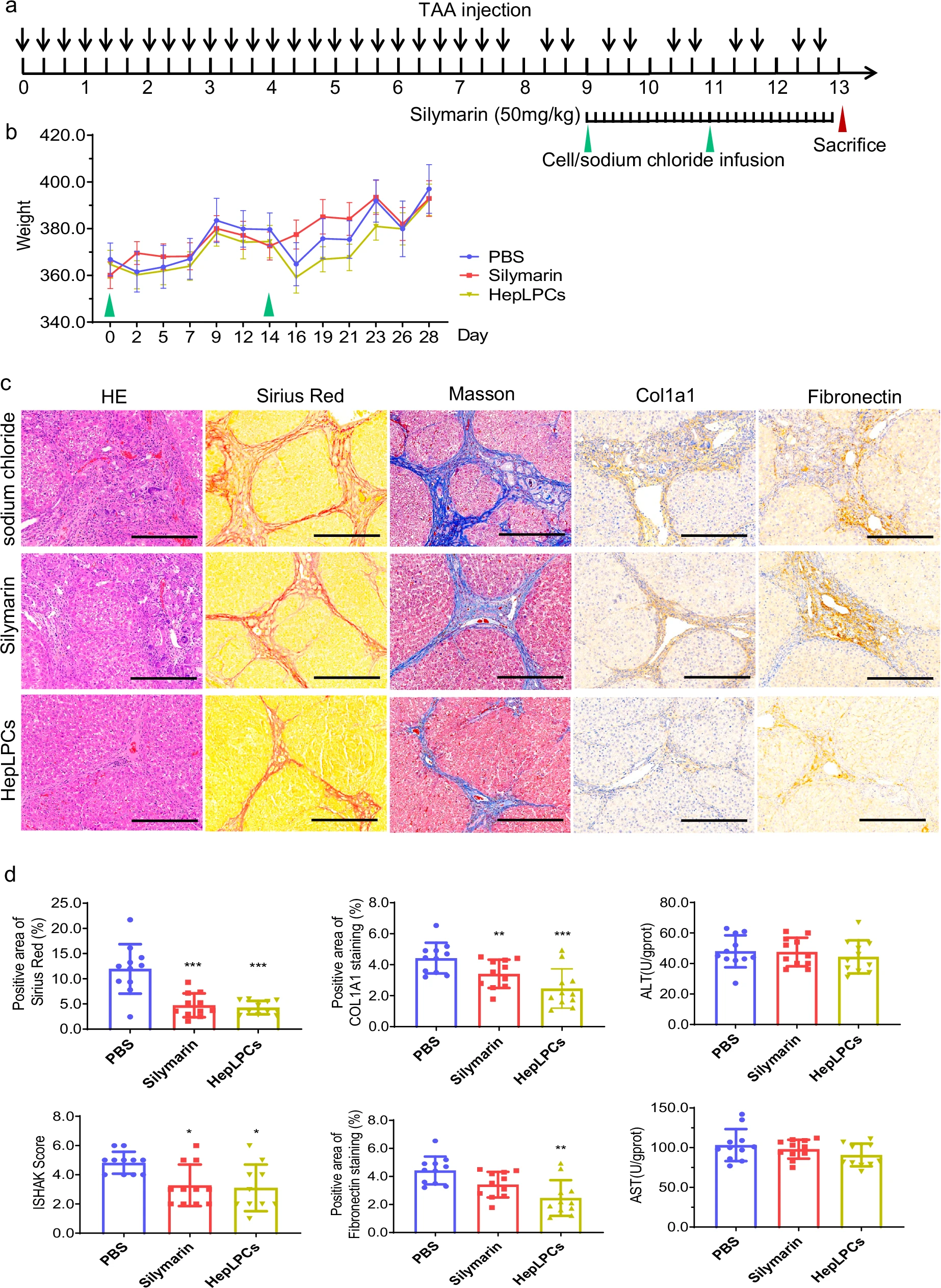
图2:符合GMP标准的HepLPC可减轻硫代乙酰胺诱导的大鼠肝硬化
安全性与作用机制方面,整个实验过程中所有大鼠体重稳定且无死亡,证明了治疗的安全性。值得注意的是,得益于HepLPCs本身低免疫原性的特性,移植过程无需使用免疫抑制剂。尽管血清ALT和AST水平的变化未达统计学意义,但其下降趋势仍提示肝损伤有所改善。这些综合结果有力地支持了HepLPCs移植作为一种安全且有效的策略,也为后续临床研究提供了有力的可行性依据(图3)。
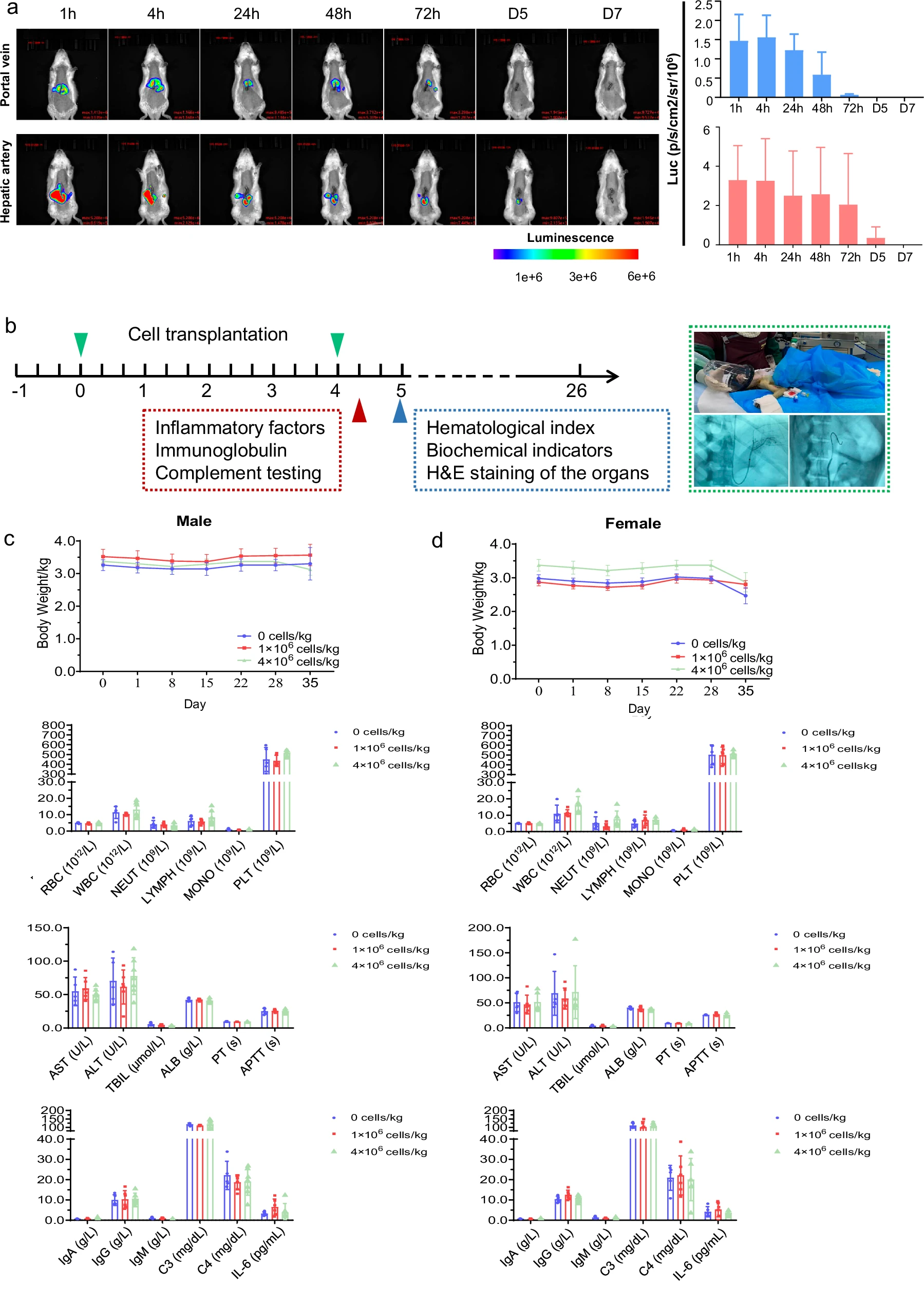
图3:移植的HepLPC的生物分布和毒性。
四、临床研究:肝祖细胞治疗肝硬化患者的可行性和安全性
首先,在成功建立符合GMP规范的生产流程并证实其临床前疗效的基础上,研究人员启动了一项针对肝硬化患者的单臂、开放标签临床试验,旨在评估HepLPCs疗法在人体内的可行性与安全性。
该研究在2021年12月27日至2022年12月14日期间,共招募并筛选了14例病因各异的肝硬化患者。其中9例患者接受了经肝动脉输注HepLPCs的治疗,剂量递增:低剂量组(0.3–0.4×10⁶/kg)、中剂量组(1.5–2.0×10⁶/kg)和高剂量组(3.0–4.0×10⁶/kg)(图4、5a)。
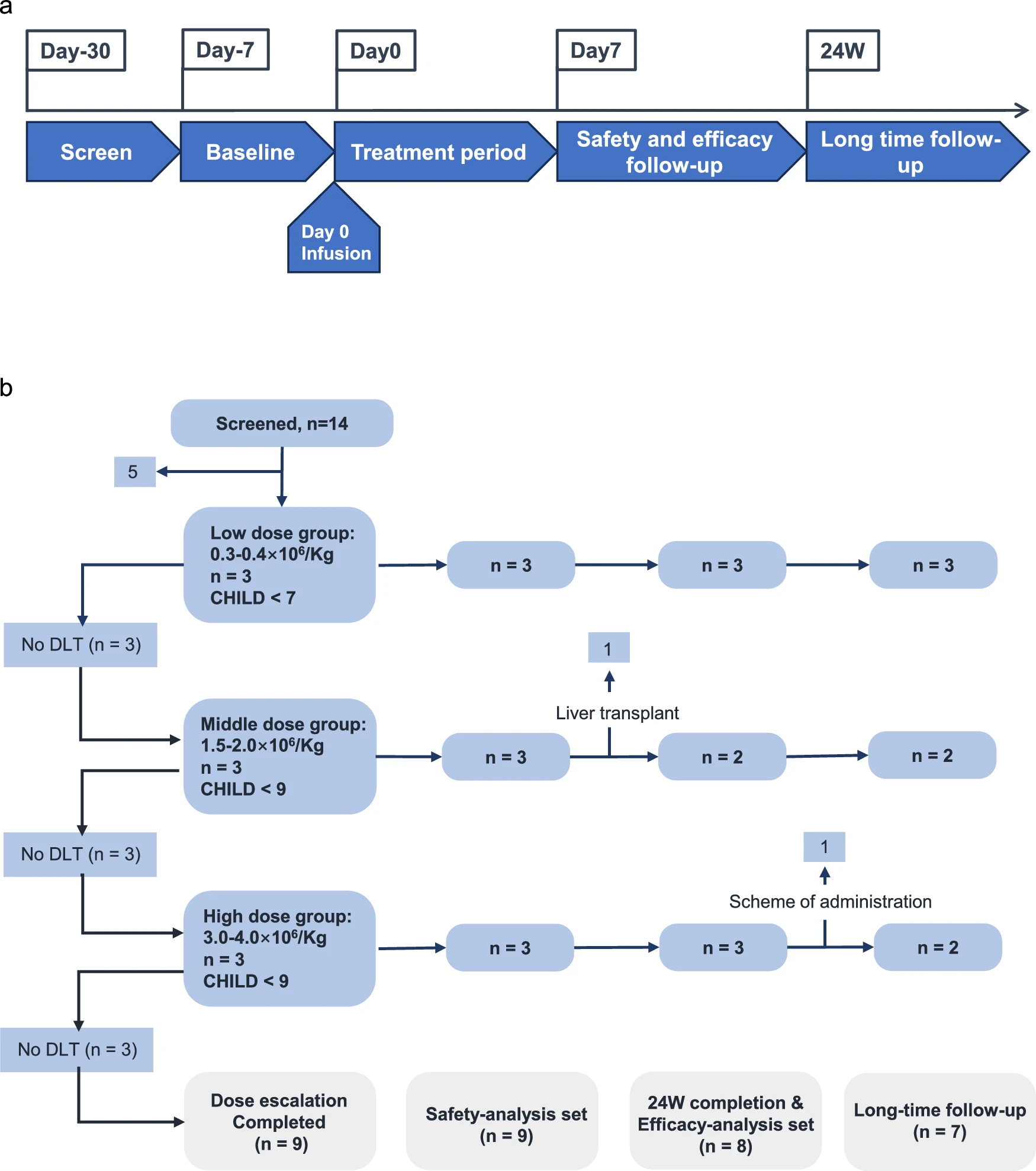
图4:研究设计和患者处置。 a.根据修改后的方案绘制的研究设计示意图。 b.患者处置和分配到队列及分析集的示意图。
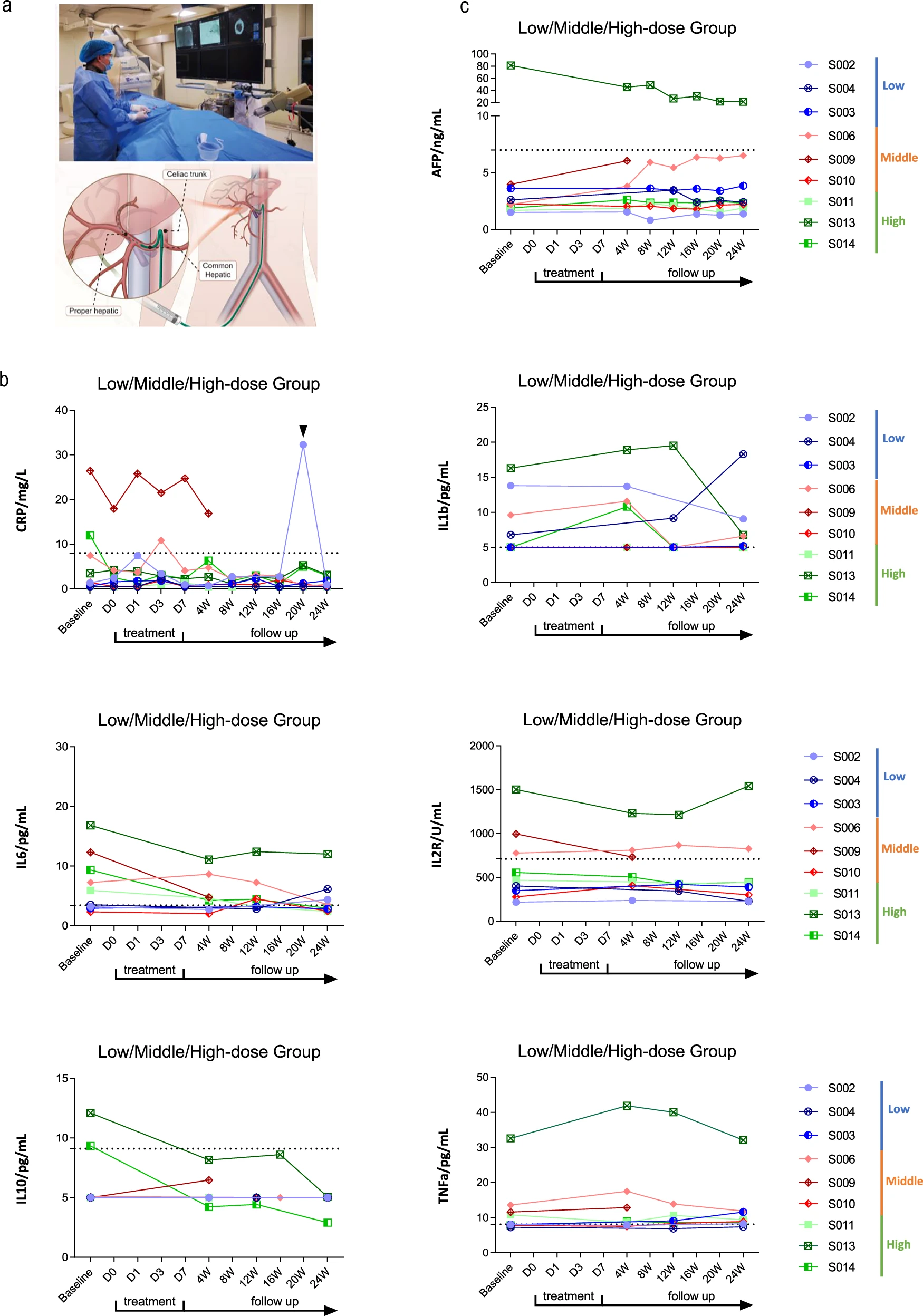
图5:HepLPC治疗肝硬化患者的安全性和可行性。a.HepLPC输注途径示意图。b.HepLPC治疗患者血清中CRP、IL-1β、IL-2R、IL-6、IL-10和TNF-α水平。2号患者出现流感样症状,并伴有短暂的CRP水平升高。虚线代表正常值。c.HepLPC治疗前后AFP水平的评估。
在整个治疗过程中,得益于临床前研究已证实的HepLPCs低免疫原性特性,所有接受治疗的患者均未使用免疫抑制剂,且未观察到任何免疫排斥或炎症反应。尤为重要的是,治疗期间所有患者均未出现急性输血反应或剂量限制性毒性,初步证明了该疗法在肝硬化患者中应用的良好安全性与耐受性。
HepLPCs治疗肝硬化卓越的安全性
HepLPCs治疗展现出卓越的安全性,主要体现在三个方面:
1. 严重不良事件与治疗无关,且治疗前期已显现安全性信号:研究中唯一一例严重不良事件(急性胆囊炎导致的肝移植)被证实与HepLPC治疗本身无关。
这一判断的关键依据在于:输注的细胞在体内存留时间短暂,且在该事件发生前(治疗后1个月),该患者的多项关键肝功能指标(如血氨、凝血功能、前白蛋白等)已显示出改善趋势。这一方面排除了治疗的直接责任,另一方面反而凸显了细胞输注初期的良好耐受性和潜在益处,强化了其安全性 。
2. 不良事件轻微可控,且未引发免疫或炎症风暴:研究期间记录的其他不良事件(如便秘、瘙痒等)均为常见临床症状,被评估与HepLPC或其输注方式无关,且患者耐受良好。
更重要的是,通过对血清细胞因子(包括CRP、IL-6等)的密切监测,证实所有患者均未发生细胞因子释放综合征等严重的免疫炎症反应。多数患者IL-6水平在治疗后甚至有所下降,这从免疫学角度提供了强有力的证据,表明该疗法即使在不使用免疫抑制剂的情况下,也具有卓越的免疫兼容性和炎症安全性。
3. 无血液学毒性或肿瘤发生风险,显示出长期的生物安全性:治疗未导致血细胞下降,反而改善了贫血状况。全程监测未发现甲胎蛋白(AFP)水平升高或肝脏肿瘤迹象,排除了长期风险。
显著的治疗效果:肝功能、凝血、纤维化及影像学改善
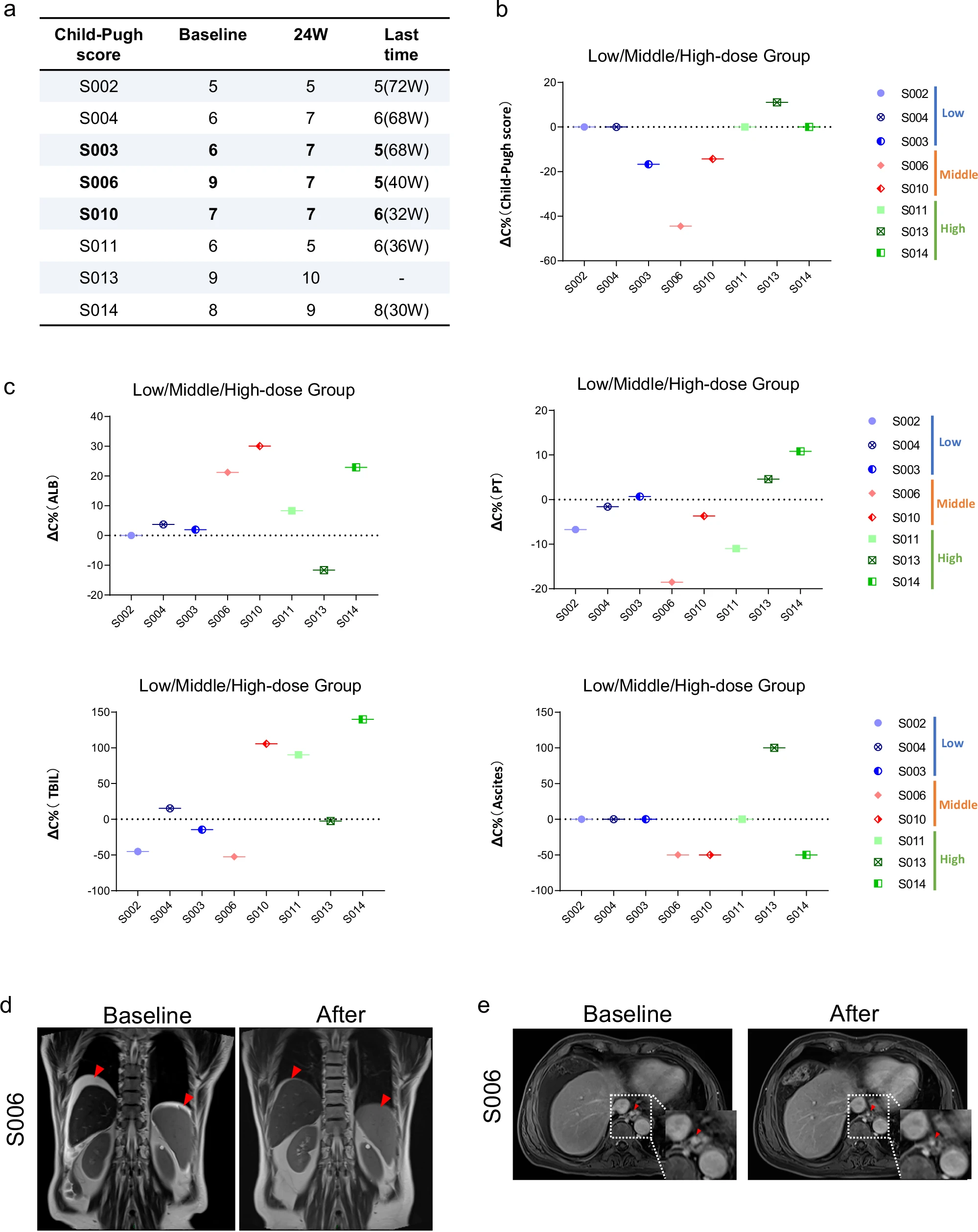
图6:HepLPC治疗肝硬化患者的疗效。a.HepLPC治疗前后Child-Pugh评分的评估。b 、c . HepLPC治疗患者的Child-Pugh评分、白蛋白(ALB)、凝血酶原时间(PT)、总胆红素(TB)和腹水程度的变化。d.6号患者HepLPC治疗前后的腹水情况。e.6号患者食管下端静脉曲张血管直径的变化。红色方框内显示的是肝硬化改善的指标。
2. 凝血功能全面恢复:评估凝血功能的多个关键参数均显示出积极变化。其中,62.5%(5/8)患者的凝血酶原时间(PT)缩短,而87.5%(7/8)患者的活化部分凝血活酶时间(APTT)下降,这表明机体的凝血机制趋于正常。此外,62.5%(5/8)患者的纤维蛋白原水平显著升高,进一步印证了肝脏合成凝血因子的能力在治疗后得到了有效增强。
3. 肝纤维化与硬度呈现逆转趋势:通过直接和间接的测量方法,均观察到肝纤维化的缓解。在影像学上,50%(4/8)的患者通过弹性成像检测的肝脏硬度值(LSM)出现下降。在血清学指标上,尤其是低剂量组的轻度肝硬化患者,其透明质酸(HA)等肝纤维化标志物水平显著且持续降低。这些数据共同表明,HepLPC治疗对逆转肝脏的纤维化病理改变具有积极影响。
4. 门静脉高压显著缓解与肝脏再生迹象:影像学检查(如弹性成像和磁共振)提供了治疗有效的有力结构证据。75%(6/8)的患者观察到脾脏体积缩小,这是门静脉高压得到改善的直接标志。尤为重要的是,有患者的下段食管静脉曲张血管直径减小,证实了门体分流的减少。此外,同样有75%(6/8)的患者肝脏体积出现增大,这强烈提示肝细胞可能发生了增殖,为HepLPs能够促进肝脏再生提供了关键的临床证据。
讨论与结论
低免疫原性赋予HepLPCs优异的安全性:本研究证实,HepLPCs在临床应用中具备出色的安全性。其所采用的细胞剂量与既往肝干细胞及间充质干细胞治疗研究相当,但在整个剂量范围内均未出现治疗相关不良事件或免疫毒性迹象。特别值得关注的是,在未使用免疫抑制剂的情况下,所有患者均未出现转氨酶或炎症细胞因子水平升高,这直接验证了临床前研究所揭示的低免疫原性特征——HepLPCs不表达MHC II类抗原,并可抑制T细胞增殖与促炎因子表达,从而实现了无需免疫抑制支持的安全应用。
肝动脉输注途径具备高安全性与细胞植入效率:在给药途径方面,本研究采用的经肝动脉输注展现出明显优势。相较于脾内移植或门静脉输注等传统方式,肝动脉途径具有血流速度快、血栓风险低、不受门静脉高压影响等特点,并能提供更高的细胞植入效率与持久性。临床结果进一步证实了该途径的可靠性,研究期间所有患者均未发生出血或血栓事件,为此输注方式的未来应用提供了有力的安全性依据。
肝功能改善提示旁分泌机制主导治疗效应:尽管在组织学层面尚未观察到肝硬化逆转的直接证据,但HepLPC治疗确实带来了多项关键肝功能指标的显著改善。患者的前白蛋白、凝血功能等合成指标迅速提升,解毒能力增强,门静脉高压相关临床表现(如脾肿大、腹水)也得到缓解。尤为重要的是,这些疗效在患者体内已检测不到供体细胞的情况下依然持续存在,强烈提示HepLPCs主要通过旁分泌机制发挥作用,即通过分泌活性因子促进宿主自身肝脏的再生与修复,从而实现疾病修饰效应。
总之,我们的研究表明,经肝动脉输注肝硬化患者肝脏来源的肝细胞(HepLPCs)安全、可行,且可能有效治疗肝硬化。这种新型治疗方法在肝硬化的临床治疗中具有巨大的应用前景。
令人鼓舞的结果为推进下一阶段的临床试验提供了强有力的理论依据,并有望将该疗法的应用范围从肝硬化扩展到急性加重型慢性肝衰竭。
参考资料:
[1] He, K., Zhu, XJ., Shi, YP. 等. 利用肝细胞衍生的肝祖细胞样细胞治疗肝硬化:一项前瞻性、开放标签、单臂安全性试验. Cell Discov 11 , 88 (2025). https://doi.org/10.1038/s41421-025-00831-y
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复