从大脑的隐秘角落提取出的特殊细胞,正以其多能性为帕金森病、脊髓损伤等神经系统疾病带来革命性的治疗希望。
在人类大脑的脑室下区和海马体等隐秘角落,存留着一群特殊的细胞——神经干细胞。它们终身维持着大脑的可塑性,是人类神经再生的希望之源。
这些细胞的数量稀少,形态又缺乏特异性,如同隐藏在浩瀚星海中的特殊星座,难以直接识别与分离。而神经干细胞的标志物,就是科学家们用以识别和定位这些细胞的特异性“分子指纹”。
神经干细胞起源于胚胎神经外胚层,最初是神经上皮细胞,它们能够分化生成神经元、星形胶质细胞和少突胶质细胞——这些细胞构成了中枢神经系统的大多数。神经干细胞具有两大主要功能:自我更新和分化。本指南总结了主要的神经干细胞标志物及其直接子代细胞最常用的标志物。
神经干细胞标志物:解码大脑再生的关键密码
01、为何寻找神经干细胞(NSC)标志物?
神经干细胞具有自我更新和多向分化的潜能,能够分化为神经元、星形胶质细胞和少突胶质细胞等多种神经细胞。
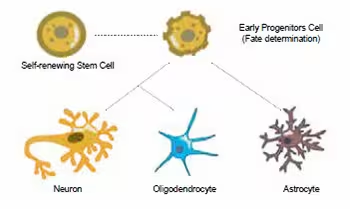
NSCs 主要根据环境信号分化为神经元、星形胶质细胞和少突胶质细胞。
由于神经干细胞数量稀少,且缺乏特异性形态特征,必须通过特定的分子标志物进行识别和鉴定。
神经干细胞标志物的识别不仅是基础研究的需要,也是临床治疗的前提。通过特异性标志物,科学家可以从脑组织中分离、纯化神经干细胞,进而探索其在神经退行性疾病、脑损伤、脊髓损伤等领域的应用价值。
02、主要神经干细胞标志物
根据功能和表达特点,神经干细胞标志物可分为以下几类:
胚胎神经干细胞自我更新的标志物
尽管所有干细胞的最终目标都是分化,但包括神经干细胞在内的所有干细胞群都必须在分化和自我更新之间取得平衡。自我更新过程使神经干细胞群能够扩增并维持其干性,从而在需要时持续提供新的细胞来源以进行分化。分化和自我更新之间的平衡由相互拮抗的转录效应因子调控。
Notch信号通路是维持这种平衡的关键。Notch 1受体的激活导致Hes1、Hes3和Hes5的表达——这些转录抑制因子抑制神经前体基因的表达,并促进多能性和自我更新。Notch激活后,神经干细胞分化。然而,Hes家族转录因子并非唯一受Notch信号通路调控的转录因子。Gli(Gli1、Gli2、Gli3)和SoxB1(Sox1、Sox2、Sox3)家族转录因子也有助于促进多能性和自我更新。Gli转录因子通过调控Notch激活下游Hes转录因子的表达来实现这一功能,而SoxB1转录因子则通过拮抗神经前体转录效应因子(如Ngn2和ASCL1)来实现这一功能。特别是SOX2,它是神经干细胞身份的最早标志物之一。
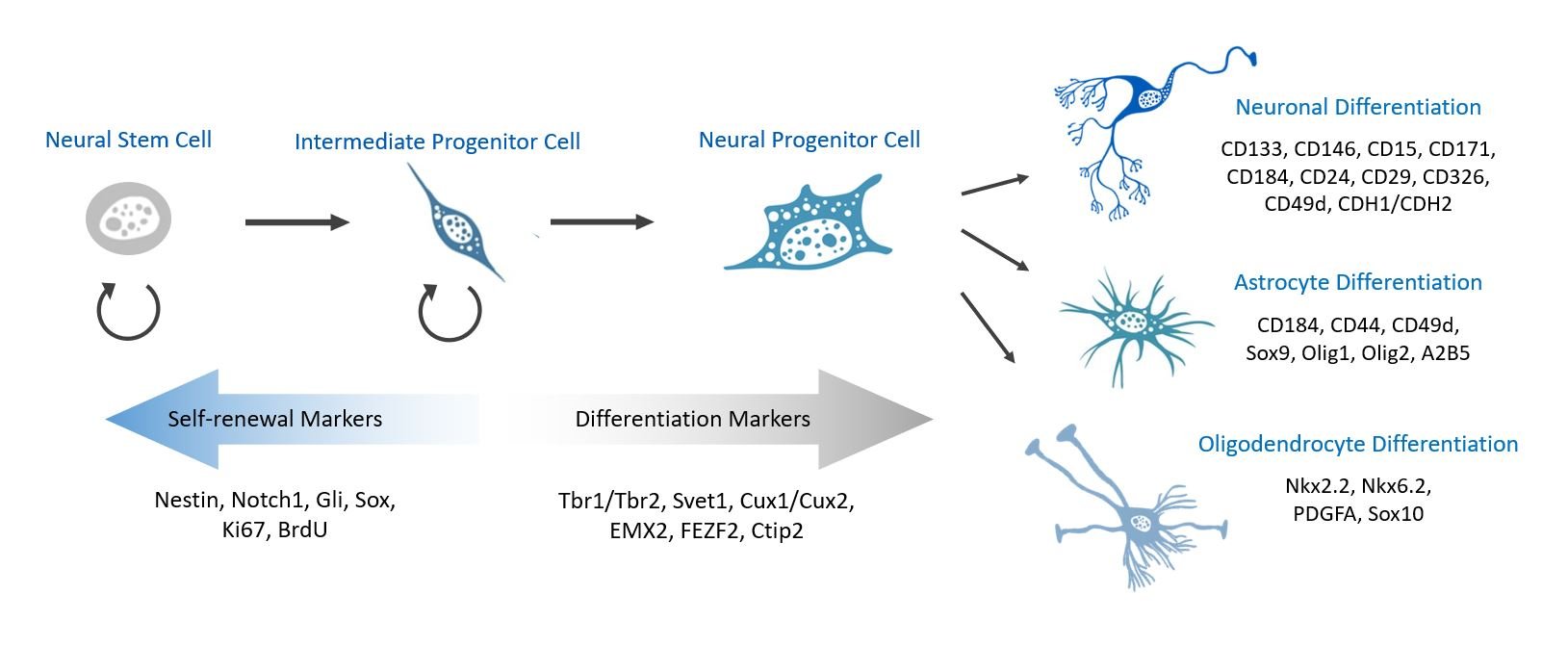
其他调控神经干细胞自我更新的转录调控因子包括ID4和HesR1/HesR2。前者促进增殖(但不促进多能性),后者抑制神经分化。
除了转录调节因子外,丝状蛋白神经上皮干细胞蛋白(或更常见的名称是巢蛋白)参与神经干细胞的存活和自我更新。
最后,非特异性增殖标记物 BrdU(一种胸苷类似物,可掺入增殖细胞中,并可通过抗体检测)和 Ki67(一种与自我更新普遍相关的核蛋白)也可用于三角定位神经干细胞,但只能与神经干细胞特异性标记物结合使用。
胚胎神经干细胞分化的标志物
神经干细胞分化涉及上述许多自我更新因子的下调。这种自我更新因子的下调伴随着促神经因子或促胶质因子的上调,这些因子驱动神经干细胞分化为神经元、星形胶质细胞和少突胶质细胞。
从放射状胶质细胞到中间祖细胞的转变标志着分化过程的第一步。这一转变伴随着转录调控因子Tbr1/Tbr2、Svet1、Cux1/Cux2、EMX2、FEZF2和Ctip2的上调。其中,Tbr2是神经干细胞分化过程中中间祖细胞阶段的特异性标志物。在下一阶段,Tbr2的表达会关闭,而其在早期阶段(放射状胶质细胞阶段)的表达则决定了中间祖细胞的身份。
中间祖细胞分化为神经祖细胞,之后这些细胞进一步分化为神经元和胶质细胞。这些细胞命运及其相关标志物概述如下。
神经元分化
神经元分化是由神经源性碱性环-螺旋-环(bHLH)转录因子(如Ngn2和Ascl1)诱导的。如上所述,这些转录因子直接拮抗神经干细胞增殖和自我更新的转录调节因子,例如SoxB1家族成员。
转录因子Pax6无论表达水平高低,均能促进神经发生并抑制细胞自我更新。Pax6高表达可增强其与促神经因子(如Ascl1)的相互作用,而Pax6缺失则会降低细胞周期调控因子的表达,从而促进神经发生。此外,Pax6还调控Notch配体和Hes5的表达。
在神经元分化的后期阶段,神经干细胞开始表达经典的神经元标记物MAP2和TUJ1。它们也表达波形蛋白,但这种标记物也由神经胶质细胞表达。
体外已鉴定出多种早期神经元分化相关的细胞表面标志物,包括CD133、CD146、CD15、CD171、CD184、CD24、CD29、CD326、CD49d和CDH1/CDH2。然而,细胞培养条件、细胞周期阶段以及细胞来源(例如胚胎干细胞与诱导多能干细胞)均会影响这些标志物的表达。De Gioia及其同事(2020)对这些标志物进行了更深入的探讨。
星形胶质细胞分化
在神经发生过程中,促神经bHLH转录因子(例如Ngn2)抑制胶质细胞生成。然而,在神经发生过程中,神经祖细胞对胶质细胞生成信号变得敏感,从而发生向星形胶质细胞或少突胶质细胞命运的转变。这种转变由胶质细胞生成转录因子Sox9、Olig1和Olig2驱动——这三种因子均支持星形胶质细胞和少突胶质细胞的分化。神经发生转录因子Pax6也在星形胶质细胞的成熟过程中发挥作用。A2B5抗体已被用于鉴定胶质细胞前体。
一些标记物可用于推断神经干细胞向星形胶质细胞的分化。GFAP 是常用的星形胶质细胞标记物,但其特异性并不高。此外,CD184、CD44 和 CD49d 已被证实是体外星形胶质细胞前体细胞的标记物。
少突胶质细胞分化
少突胶质细胞分化的标志物比星形胶质细胞分化的标志物更为明确。除了星形胶质细胞和少突胶质细胞前体细胞共有的标志物(如上所述)外,后者还表达Nkx2.2、Nkx6.2、PDGFA和Sox10。PDGFA是 决定少突胶质细胞命运的关键因子,也是少突胶质细胞祖细胞最有用的标志物之一。
成人神经干细胞的标志物
神经发生会持续到成年期,尽管其范围仅限于海马齿状回的颗粒下区和侧脑室旁的室下区。胚胎神经发生的典型转录程序和标记物与成年神经发生的转录程序和标记物基本相同。例如,Pax6、Hes家族成员、SoxB1家族成员、神经发生相关的bHLH转录因子以及Tbr2均参与这两个发育阶段。
尽管参与者基本相同,但正如 Christie 及其同事 (2013) 所讨论的那样,胚胎神经发生和成年神经发生之间某些标记的表达时间略有不同。
03、可用的神经干细胞、星形胶质细胞和少突胶质细胞标志物和抗体
神经干细胞(NSC)标记物
| 目标 | 产品编号 | 克隆性 | 已验证的 应用程序 |
小鼠/大鼠序列同一性 |
|---|---|---|---|---|
| BLBp/FABP7 | AMAB90595 | 单克隆抗体 | 免疫组化,免疫印迹 | 89%/90% |
| 体重指数 | HPA030472 | 多克隆抗体 | IHC、WB* | 95%/95% |
| CD133/PROML1 | HPA004922 | 多克隆抗体 | 免疫组化* | 57%/60% |
| EGFR/ERBB1 | AMAB90819 | 单克隆抗体 | 西布朗 | 90%/91% |
| EGR1 / INGFI-A | HPA029937 | 多克隆抗体 | 国际刑事法院-国际论坛 | 93%/94% |
| PCGF5 | HPA038349 | 多克隆抗体 | IHC、ICC-IF | 95%/93% |
| REELIN/RELN | HPA046512 | 多克隆抗体 | 国际刑事法院-国际论坛 | 90%/94% |
| SLC1A3/GLAST | HPA037468 | 多克隆抗体 | 免疫组化* | 93%/93% |
| TLX/NR2E1 | HPA055642 | 多克隆抗体 | 免疫组化* | 99%/99% |
神经干细胞标记物 |
|---|
| 目标 | 产品编号 | 克隆性 | 已验证的 应用程序 |
小鼠/大鼠序列同一性 |
|---|---|---|---|---|
| BRN2/POU3F2 | AMAB91406 | 单克隆抗体 | IHC、WB、ICC-IF | 100%/100% |
| BRN2/POU3F2 | HPA056261 | 多克隆抗体 | 国际刑事法院-国际论坛 | 100%/100% |
| FGFR1 | HPA056402 | 多克隆抗体 | 免疫组化,免疫印迹 | 94%/96% |
| FOXA2 | HPA050505 | 多克隆抗体 | IHC*、ICC-IF | 96%/82% |
| MAP2 | AMAB91375 | 单克隆抗体 | IHC、WB、ICC-IF | 91%/90% |
| 东北 | AMAB91314 | 单克隆抗体 | IHC、WB、ICC-IF | 97%/99% |
| NURR1/NR4A2 | HPA000543 | 多克隆抗体 | IHC、ICC-IF | 100%/100% |
| PAX3 | HPA063659 | 多克隆抗体 | IHC、ICC-IF | 92%/92% |
| PAX3 | HPA069000 | 多克隆抗体 | 国际刑事法院-国际论坛 | 98%/98% |
| PAX6 | AMAB91372 | 单克隆抗体 | IHC、ICC-IF | 100%/100% |
| S100B | AMAB91038 | 单克隆抗体 | IHC*、WB | 99%/98% |
| SOX11 | HPA000536 | 多克隆抗体 | 免疫组化,免疫印迹 | 82%/82% |
| SOX21 | AMAB91309 | 单克隆抗体 | 免疫组化,免疫印迹 | – |
| SOX21 | HPA048337 | 多克隆抗体 | 免疫组化 | 96%/37% |
| SOX21 | HPA064084 | 多克隆抗体 | 国际刑事法院-国际论坛 | 96%/37% |
| SOX4 | AMAB91378 | 单克隆抗体 | IHC、ICC-IF | – |
| SOX4 | AMAB91380 | 单克隆抗体 | IHC、ICC-IF | – |
| TBR2/EOMES | HPA065458 | 多克隆抗体 | 国际刑事法院-国际论坛 | 96%/96% |
| TUBB3 | AMAB91394 | 单克隆抗体 | IHC、WB、ICC-IF | – |
星形胶质细胞标记物 |
|---|
| 目标 | 产品编号 | 克隆性 | 已验证的 应用程序 |
小鼠/大鼠序列同一性 |
|---|---|---|---|---|
| 水通道蛋白4 | AMAB90537 | 单克隆抗体 | IHC*、WB | 93%/92% |
| 水通道蛋白4 | HPA014784 | 多克隆抗体 | IHC*、WB、ICC-IF | 93%/92% |
| 水通道蛋白9 | HPA074762 | 多克隆抗体 | 免疫组化* | 55%/55% |
| CD44 | HPA005785 | 多克隆抗体 | IHC*、WB*、ICC-IF | 51%/47% |
| 胶质纤维酸性蛋白(GFAP) | AMAB91033 | 单克隆抗体 | IHC*、WB* | 98%/100% |
| 胶质纤维酸性蛋白(GFAP) | HPA056030 | 多克隆抗体 | IHC*、WB、ICC-IF | 98%/100% |
| 胶质纤维酸性蛋白(GFAP) | HPA063513 | 多克隆抗体 | 免疫组化* | 100%/98% |
神经干细胞标记物 |
|---|
| 目标 | 产品编号 | 克隆性 | 已验证的 应用程序 |
小鼠/大鼠序列同一性 |
|---|---|---|---|---|
| CD140/PDGFRA | HPA004947 | 多克隆抗体 | 国际刑事法院-国际论坛 | – |
| 髓鞘碱性蛋白 | HPA049222 | 多克隆抗体 | 免疫组化,免疫印迹 | 97%/97% |
| 寡核苷酸2 | HPA003254 | 多克隆抗体 | IHC*、WB | 93%/94% |
| PROX1 | HPA000842 | 多克隆抗体 | 国际刑事法院-国际论坛 | 100%/93% |
| PROX1 | HPA001030 | 多克隆抗体 | 国际刑事法院-国际论坛 | 100%/99% |
| SOX10 | AMAB91297 | 单克隆抗体 | IHC、ICC-IF | 98%/98% |
| SOX8 | HPA058665 | 多克隆抗体 | IHC*、ICC-IF | 73%/70% |
04、神经干细胞鉴定方法
神经干细胞的鉴定不是依赖单一指标,而是需要多维度验证:
形态学观察
神经干细胞在悬浮培养中呈聚球生长,形成的神经球是其典型形态特征。细胞团无或有较短的突起,在形态上与其他种类的细胞没有明显差异。
免疫荧光检测
利用抗体检测神经干细胞标志物的表达,是鉴定NSC的核心手段。一套常见的鉴定标准为:
-
Nestin阳性表达率≥75%
-
β3-Tubulin阳性表达率≤10%
-
GFAP阳性表达率≤10%
-
GalC或OSP阳性表达率≤10%
分化潜能验证
真正的神经干细胞必须具有分化为多种神经细胞的能力。在含血清培养基中培养约7天,神经干细胞会自发分化为神经元细胞、星形胶质细胞和少突胶质细胞。
分化后,Nestin表达停止,转而表达各系细胞的标志物:β3-Tubulin标记神经元,GFAP标记星形胶质细胞,GalC或OSP标记少突胶质细胞。
05、研究前沿与新技术
单细胞测序技术
近年来,单细胞RNA测序技术极大推动了神经干细胞研究。通过对人类从出生到成年不同年龄段的海马体进行分析,科学家发现了成人海马体中存在增殖的神经祖细胞的直接证据。
研究还揭示了人与小鼠神经干细胞标志物的差异,例如EOMES在小鼠中特异表达于神经祖细胞,而在人类中则在神经祖细胞和神经母细胞中均有表达。
标志物在疾病研究中的应用
神经干细胞标志物在疾病机制研究中发挥重要作用。美国“脑计划”细胞网络图谱项目通过单细胞和空间技术,追踪脑细胞类型在发育过程中如何产生、分化和组织。
研究发现,细胞类型并非依固定阶段出现,而是重叠波浪式涌现,有些发育过程在成年期或疾病状态下可重新激活。这些发现有助于定位自闭症和精神分裂症等疾病于何时何处起源。
06、临床应用与挑战
自体神经干细胞移植
研究人员已成功从颅脑手术患者废弃脑组织中培养出神经干细胞,这些细胞表达Nestin,并能分化为神经元及神经胶质细胞。
这为立体定向自体神经干细胞移植治疗脑出血、脑梗塞及颅脑损伤后遗症提供了临床可能性。
神经干细胞来源的外泌体
神经干细胞衍生的外泌体已成为神经疾病治疗的有前景的策略。2025年8月发表的一项研究开发了携载超小纳米硒的神经干细胞外泌体,在创伤性脑损伤和脊髓损伤模型小鼠中显示出显著治疗效果。
挑战与局限性
当前神经干细胞标志物研究仍面临挑战。缺乏单一、特异的标志物来识别多能神经干细胞,经常需要多种标志物组合使用。
此外,随着新型干细胞的不断发现,需要更精确的工具来满足研究需求。
随着美国“脑计划”等国际科研项目的推进,科学家们正在绘制更为精细的大脑发育图谱,追踪干细胞如何分化为特定的神经元和胶质细胞。这些研究不断丰富着神经干细胞标志物的名单。
未来的神经干细胞研究,将不再局限于单一标志物的识别,而是通过多组学数据整合,在动态发育过程中理解神经干细胞的命运决定。
神经干细胞标志物的研究终将打通从基础科学到临床治疗的路径,为人类大脑修复和再生带来真正突破。
参考
1. Duan X, Kang E, Liu CY, Ming GL, Song H.成年脑神经干细胞的发育. Curr Opin Neurobiol. 2008;18(1):108-115. doi:10.1016/j.conb.2008.04.001
2. Yuan SH, Martin J, Elia J, 等.人类多能干细胞衍生的神经干细胞、胶质细胞和神经元的细胞表面标志物分离. PLoS One. 2011;6(3):e17540. doi:10.1371/journal.pone.0017540
3. Christie KJ, Emery B, Denham M, Bujalka H, Cate HS, Turnley AM.神经干细胞的转录调控和分化。Adv Exp Med Biol. 2013;786:129-155. doi:10.1007/978-94-007-6621-1_8
4. Zhang J, Jiao J.胚胎和成体神经干细胞及神经发生的分子生物标志物. Biomed Res Int. 2015;2015:727542. doi:10.1155/2015/727542
5. Vinci L, Ravarino A, Fanos V, 等.人类早期胚胎大脑皮层神经祖细胞的免疫组织化学标记物。欧洲组织化学杂志。2016;60(1):2563。doi:10.4081/ejh.2016.2563
6. De Gioia R、Biella F、Citterio G 等人。神经干细胞移植治疗神经退行性疾病。国际分子科学杂志。 2020;21(9):3103。 doi:10.3390/ijms21093103
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复