脑出血(ICH)是一种高致死致残率的脑血管疾病,现有治疗手段对神经功能缺损的改善有限。神经干细胞(NSC)移植因其自我更新、多向分化及神经保护潜能,成为极具前景的修复策略。
神经干细胞移植治疗脑出血的系统评价:NSC来源、输送途径、治疗机制和早期临床试验
在此背景下,近日,著名期刊杂志《神经药理学》刊发了一篇“神经干细胞在脑出血治疗中的应用:系统评价”的研究综述[1]。
综述结果表明,神经干细胞移植治疗脑出血的机制涵盖替代神经元、免疫调节与促进血管生成等多重途径;其来源可分为内源性激活与外源性移植,后者包括原代培养、多能干细胞分化及体细胞重编程;输送途径主要有立体定向脑内注射、经脑脊液移植及血管内注射,各有优劣。
尽管临床前研究证据积极,但早期临床试验规模有限,且面临移植参数标准化、安全性及转化医学等多重挑战。未来需通过严谨的临床试验与技术创新推动该疗法向标准化临床应用的转化。
脑出血的治疗挑战与临床需求
脑出血(ICH)是一种由高血压、脑血管病变等因素引发的脑内自发性出血,病情凶险,早期死亡率高达30%-47%,多数幸存者遗留严重残疾。当前标准治疗旨在预防再出血和管理继发性损伤,但对受损神经组织的修复能力有限,导致总体预后不佳。
神经干细胞:一种极具前景的修复策略
鉴于传统疗法的局限,修复受损神经或刺激神经新生成为改善预后的关键方向。干细胞疗法凭借其自我更新及多向分化能力,为神经修复提供了全新可能。其中,源自神经系统的神经干细胞(NSC)能够直接产生神经元、星形胶质细胞等,备受关注。
神经干细胞自1992年被发现以来,被证实具有长期静息、在损伤后被激活以参与修复的特性。最新研究进一步揭示,其活性受到深层代谢信号的精密调控。例如,线粒体丙酮酸载体的功能状态能影响神经干/祖细胞是保持静息还是激活进行再生,这为未来通过调控细胞代谢来增强修复疗效提供了新思路。
研究进展与综述目标
综上所述,神经干细胞移植通过抑制炎症、分化为功能性神经元以及促进神经保护与神经发生,展现出显著的治疗潜力,使其成为治疗脑出血的一种有前景的方法。本文旨在系统综述目前关于神经干细胞在脑出血治疗中的研究进展,重点关注其来源、给药途径、作用机制及临床转化意义。
系统评价神经干细胞在脑出血治疗中应用的方法
本研究严格遵循系统评价和Meta分析的首选报告条目指南开展。文献检索覆盖了PubMed、Embase、Web of Science、ClinicalTrials.gov及中国临床试验注册中心共五个数据库,检索时间范围为1990年1月至2025年8月。我们采用“神经干细胞”、“脑出血”及其相关同义词与缩写组合作为检索词。初步检索共获得1250条记录。
文献筛选由两位研究者独立完成,首先依据标题和摘要进行初筛,随后对可能符合要求的文献进行全文筛选,并通过讨论解决分歧。纳入标准限定为探讨神经干细胞应用于脑出血的同行评审英文研究(临床前或临床试验),排除综述、病例报告及非相关研究类型。
最终,共68项研究被纳入本系统评价。我们提取了研究设计、细胞来源与移植参数、结局指标及机制等数据,并使用SYRCLE和Cochrane工具分别评估临床前研究与临床试验的偏倚风险。鉴于纳入研究存在较高的异质性,本次未进行荟萃分析。
神经干细胞的来源
用于损伤修复的神经干细胞可分为内源性和外源性两类。现有研究表明,激活休眠的内源性神经干细胞和移植外源性神经干细胞均可分泌神经营养因子,从而改善其生长微环境,抑制炎症,促进恢复,并分化为神经元,最终恢复受损区域丧失的神经功能。
神经干细胞的内源性来源
内源性神经干细胞是指成年生物体内自然存在、具有自我更新潜能的细胞群,主要位于海马齿状回和脑室下区。正常情况下它们处于静息状态,但在ICH等损伤后可被激活、并定向迁移至受损区域,通过增殖和分化参与神经修复过程。
外部干预如重复经颅磁刺激、上调HIF-1α或体育锻炼,均可增强其活性。内源性NSC具有低免疫原性、无排斥风险的优势,但其数量有限、迁移效率低,且激活分化机制不明,限制了其直接治疗应用。
神经干细胞的外源性来源
神经干细胞的外源性来源首先包括通过原代组织培养技术直接从生物体神经组织中获取。例如,从小鼠全脑或脑损伤患者的废弃脑组织中分离并培养神经干细胞,再诱导其分化为神经元。然而,这种方法面临细胞产量低、分化效率有限以及维持细胞传代稳定性等挑战,尽管生长因子应用和3D培养等新兴技术有望提升其规模化应用潜力。
其次,多能干细胞分化是另一重要外源性途径,主要包括胚胎干细胞和诱导多能干细胞。胚胎干细胞虽能分化为神经干细胞,但存在伦理争议、免疫排斥和致瘤风险;而诱导多能干细胞通过体细胞重编程获得,避免了伦理问题,但制备过程耗时且存在类似的安全隐患,制约了其临床转化。
最后,体细胞重编程和转分化技术提供了更直接的生成方式,例如利用病毒载体或转录因子将成纤维细胞等体细胞转化为神经干细胞或神经元。尽管转分化方法相对简便,但病毒载体可能带来致瘤风险,且转化过程可能产生不必要的副产物,仍需进一步优化以提高安全性与效率。
神经干细胞移植途径
目前,神经干细胞移植主要通过脑内移植、鞘内/脑室内注射(经脑脊液途径)、血管内注射和鼻内给药等途径进行。最常用的方法是直接脑内移植。然而,每种方法都有其独特的优缺点,目前尚未确定统一的移植途径(图1)。
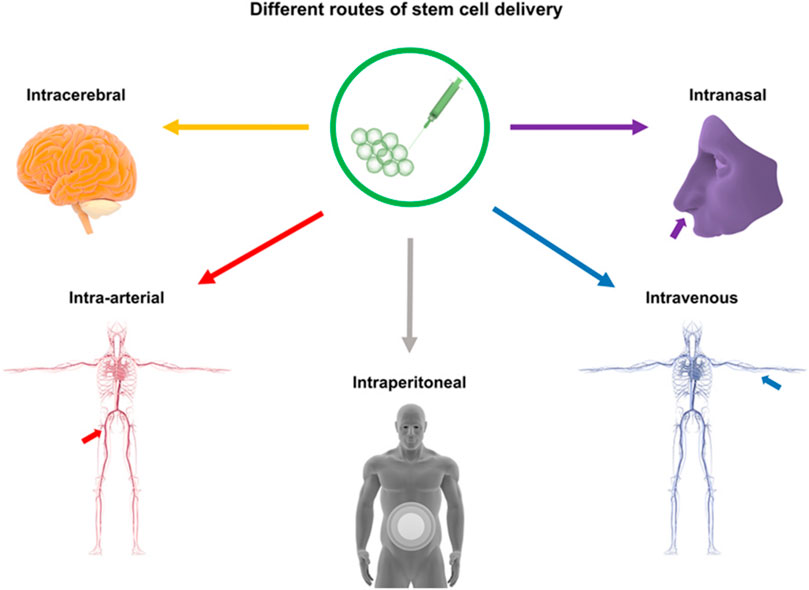
图1:干细胞移植途径:该图展示了用于中风治疗的干细胞输送途径,包括脑内(立体定向注射)、血管内(静脉/动脉)、腹腔内、脑室内、静脉内、鼻内和鞘内注射方法。
(表1总结了关键转化参数,包括临床前和临床研究中的途径、时间窗和剂量)
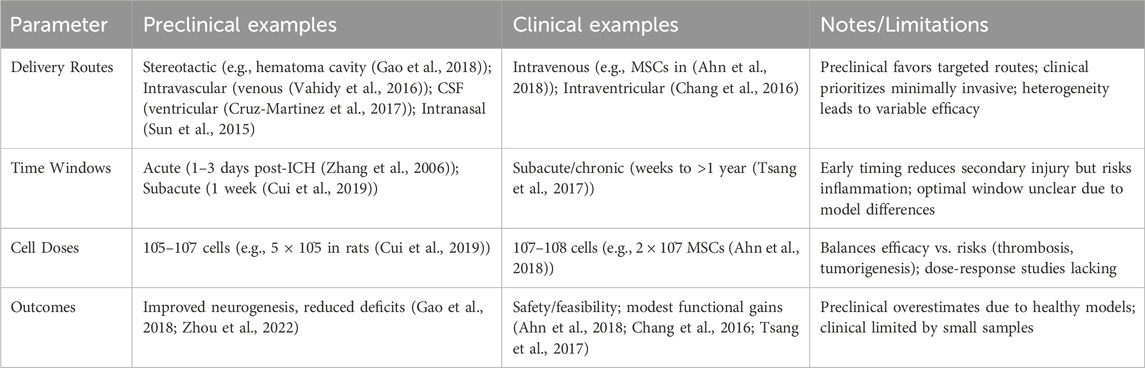
表1:神经干细胞在治疗脑出血研究中的关键转化参数总结。
1. 立体定向脑内注射
该方法是目前定位最精确的移植方式,通过立体定向技术将神经干细胞悬液直接输送到血肿腔或损伤周边区域。其优势在于细胞可被精准递送至靶点。然而,血肿腔内的毒性血液降解产物和反应性胶质增生微环境容易诱导移植细胞死亡,且过高的局部细胞密度可能反而阻碍其存活与分化。为提高细胞存活率,研究已开发出经过基因修饰的抗凋亡神经干细胞,或建议在注射时联合使用神经营养因子,但这些策略的临床有效性仍需进一步验证。
2. 经脑脊液途径移植
主要包括腰椎穿刺(鞘内注射)和脑室穿刺等方式。腰椎穿刺将神经干细胞注入蛛网膜下腔,使其随脑脊液循环广泛分布于脑和脊髓表面;脑室穿刺则将细胞直接送入侧脑室,促进其快速分布,并可能通过分泌营养因子刺激内源性神经干细胞增殖。此外,枕大池注射因存在脑干损伤风险,目前主要限于动物实验,尚未应用于临床。
3. 血管内注射
可通过静脉或动脉(如颈内动脉)进行。静脉注射操作简便,但大量细胞会滞留在肺、肝、脾等器官,到达脑部的效率低;动脉注射虽能提高脑部细胞递送率,但面临技术难度、操作风险以及因细胞聚集可能引发的微栓塞风险。
这两种方式均受到神经干细胞自身迁移能力有限、血脑屏障阻碍以及缺乏特异性靶向归巢信号的限制。使用靶向分子修饰或纳米材料载体包裹,是未来提高血管内递送精确度的研究方向。总体而言,尽管移植策略多样,寻找安全高效的途径仍是当前研究的重点。
4. 其他途径
包括鼻内给药,该方法利用嗅神经通路,可无创地将细胞递送至脑内,最大限度地减少继发性损伤。例如,Sun等人在动物模型中发现,鼻内给予缺氧预处理的间充质干细胞后,能在脑出血脑组织中检测到这些细胞。此外,腹腔注射以及结合生物材料或纳米技术的联合给药途径,也在探索中,旨在进一步提高移植细胞的存活、滞留和靶向效率(图1)。
神经干细胞修复神经的机制
神经干细胞移植治疗脑出血的机制复杂,主要可归纳为以下三个方面:
1、免疫调节与炎症抑制
移植的神经干细胞发挥治疗作用的核心机制之一是其强大的免疫调节能力。基础研究表明,它们能够显著抑制脑出血后过度激活的小胶质细胞/巨噬细胞,减少促炎细胞因子(如IL-1β、IL-6、TNF-α)的释放,并阻断NF-κB和JAK-STAT等关键炎症信号通路,从而减轻神经炎症、降低血脑屏障破坏和继发性损伤。此外,经过基因改造过表达特定神经营养因子(如BDNF)的神经干细胞,可进一步强化这种抗炎效应,并同时刺激内源性神经干细胞的增殖与分化。
2、神经元替代与神经营养支持
神经干细胞具备分化为成熟神经元和胶质细胞的潜能。移植后,部分细胞能在宿主脑内分化为表达NeuN、MAP2等神经元标志物的细胞,并与宿主神经元形成突触连接,直接替代丢失的神经细胞。然而,更多的证据表明,移植细胞的功能改善作用可能更多地来源于其分泌的多种神经营养因子(如BDNF、GDNF、NGF)。这些因子为受损的宿主神经元和内皮细胞提供营养支持,增强内源性神经发生、突触可塑性和轴突再生,创造有利于修复的微环境。
3、促进血管生成与血脑屏障修复
神经干细胞通过分泌血管内皮生长因子(VEGF)、血管生成素1(Ang1)等促血管生成因子,促进损伤区域的新生血管形成,增加微血管密度。这不仅有助于改善局部血流灌注和营养供应,还有助于重建完整的神经血管单元。同时,它们还能上调血脑屏障内皮细胞间的紧密连接蛋白(如claudin-5, occludin)的表达,增强血脑屏障完整性,减轻血管源性脑水肿。需要注意的是,在急性期,过强的VEGF信号可能加剧早期水肿,因此优化治疗时机至关重要。
以上三重机制——“免疫调节”、“替代与营养”、“促血管生成”——共同构成了神经干细胞治疗脑出血的多维修复网络(图2)。
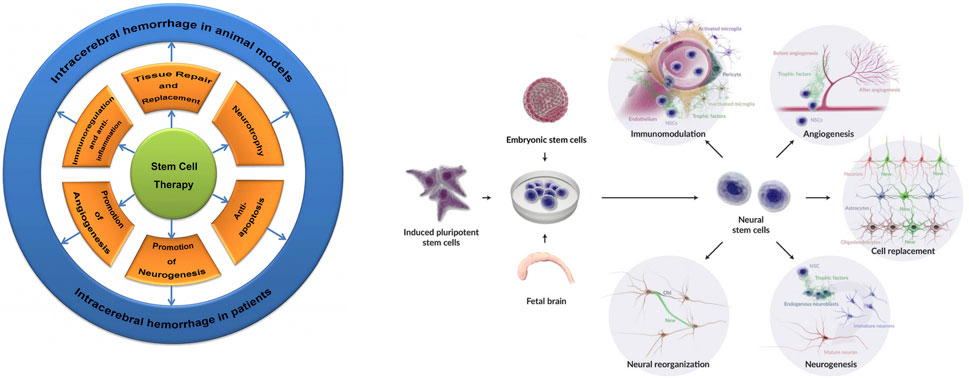
图2:干细胞和NSC在ICH中的治疗机制:阐明了其保护作用,包括修复、替代、神经营养支持、抗凋亡、抗炎、血管再生、神经发生、免疫调节、神经修复、分化为星形胶质细胞/神经元/少突胶质细胞以及宿主组织整合——最终增强组织修复和神经功能恢复。
神经干细胞治疗脑出血的临床试验
干细胞移植在卒中治疗中展现出巨大潜力,但现有研究主要集中在缺血性卒中,针对脑出血的临床试验数量有限。根据细胞类型和技术代际,神经再生疗法可大致分为三代:
- 第一代:使用成体干细胞,如造血干细胞、间充质干细胞及胎儿来源的神经干细胞,主要发挥免疫调节、抗炎、营养支持等“旁观者效应”。
- 第二代:利用具有无限自我更新能力的胚胎干细胞或诱导多能干细胞分化的细胞,侧重于细胞替代。
- 第三代:对上述干细胞进行工程化改造(如基因修饰),作为优化治疗的药物递送载体或增强其特定功能。
在ClinicalTrials.gov上注册的关于出血性卒中的干细胞移植试验仅有六项:两项已完成,两项正在进行,还有两项结果未报告。
2018年,韩国的一项I期试验表明,对于早产儿严重脑室内出血,MSC移植在某些情况下减少了室周损伤,无死亡或严重不良反应,显示了其安全性和可行性。

间充质干细胞治疗早产儿严重脑室内出血:I期剂量递增临床试验
2016年,Chang等通过一项“细胞疗法治疗脑出血:五年随访报告”研究发现,在患有中重度ICH后遗症(超过60个月)的患者中,骨髓或脐带MSC移植的功能恢复优于单独的手术血肿清除。
细胞疗法治疗脑出血:五年随访报告
2017年,Tsang等的自体骨髓间充质干细胞疗法治疗慢性卒中的I/II期随机对照试验显示,自体骨髓MSC移植相比安慰剂改善了神经功能恢复。

自体骨髓间充质干细胞疗法治疗慢性卒中的I/II期随机对照试验
相反,中国临床试验注册中心(www.chictr.org.cn)列出了16项NSC试验,大部分针对缺血性卒中,包括外泌体疗法、脑瘫、卒中后遗症和脊髓损伤,作为单中心或多中心研究进行。干细胞通常来源于易获取的脐带或骨髓,往往在较晚阶段(ICH后数周至一年多)而非急性期给药,这反映了初期生命救援措施的优先级。(见表2的关键临床试验总结)。

表2:脑出血干细胞治疗关键临床试验总结。
总体而言,胚胎干细胞和诱导多能干细胞虽分化潜能强,但分别面临伦理、免疫原性和致瘤性挑战;神经干细胞修复功能明确但获取困难;间充质干细胞则因易得性和良好的安全性被广泛研究。
推进脑出血的干细胞治疗需要整合生物材料、基因工程和预处理策略以提升疗效。尽管前景看好,但目前仍缺乏大规模、设计严谨的脑出血临床试验和长期安全数据(图3)。未来研究需着重优化给药途径、剂量、时机以及符合药品生产质量管理规范的大规模细胞制备工艺。
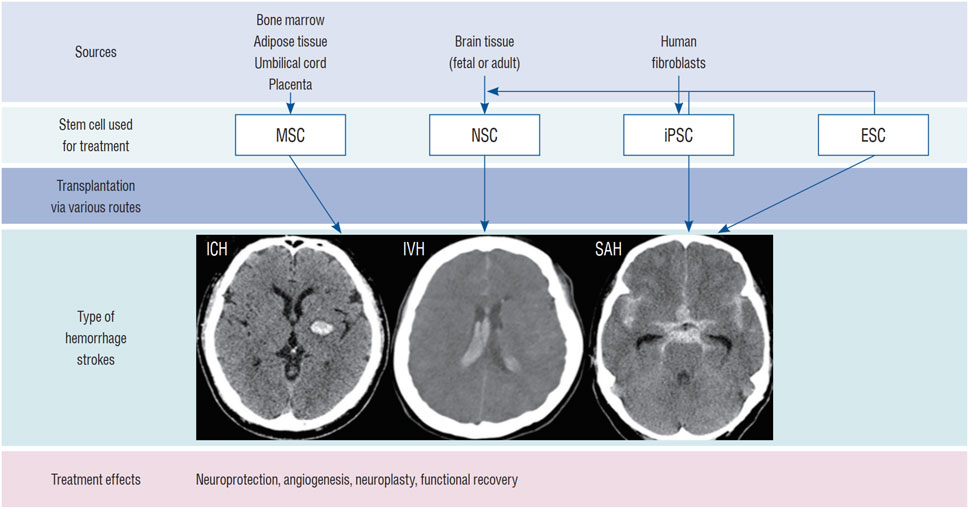
图3:用于治疗ICH的干细胞类型:该图显示了用于治疗ICH(脑实质出血、脑室内出血[IVH]和蛛网膜下腔出血[SAH])的干细胞类型,包括 NSC、间充质干细胞 (MSC)、诱导多能干细胞 (iPSC) 和胚胎干细胞 (ESC)。
神经干细胞治疗的前景与挑战
应用前景
神经干细胞移植为自发性脑出血的治疗带来了新希望。临床前研究证实其能通过多重机制促进神经功能恢复。尽管内源性神经干细胞安全性高,但受限于其数量与迁移效率,外源性移植仍是当前主流策略。通过生长因子组合(如EGF与bFGF)可在体外实现稳定、大规模的神经干细胞扩增。
此外,临床探索已开始,例如血肿清除术联合神经干细胞移植已显示出协同增效的潜力。尽管临床前研究的成功推动了临床试验的扩展——主要针对缺血性卒中——但仍需开展更多试验来证实NSCs在脑出血(ICH)中的疗效。
面临挑战
神经干细胞治疗仍面临机制、安全性与转化等多维挑战。其详细的分子机制和最佳治疗时间窗尚未完全明确,且现有动物模型难以完全模拟人脑出血的复杂病理进程。
安全性方面,免疫排斥(尤其同种异体移植)和致瘤风险(尤其是多能干细胞来源)是主要关切点,需要借助基因编辑、严格的质量控制和长期随访来监控。
伦理上,胚胎干细胞来源的争议持续存在。此外,符合临床级标准的大规模、标准化细胞生产、储存与运输体系,以及相应的监管法规和支付体系,都是实现广泛临床应用必须克服的瓶颈。
结论与展望
展望未来,该领域的发展将主要围绕临床转化和技术创新两个核心方向。
- 在临床转化层面,首要任务是推进设计严谨、规模合理的临床试验,以获取确凿的人体安全性与有效性数据,并建立从细胞制备、质量控制到治疗方案的完整标准体系。
- 在技术创新层面,研究重点将聚焦于提升治疗效果和安全性,例如开发基于磁性纳米颗粒的“靶向递送系统”以提高细胞归巢效率,探索细胞预处理(如缺氧预适应)或基因修饰策略以增强其存活与修复功能,并综合利用人工智能辅助决策和3D类器官模型等新技术来优化治疗方案及进行机制研究。
随着多学科交叉合作的深入以及转化医学的持续努力,神经干细胞疗法有望在未来五到十年内,为脑出血患者提供一种超越当前对症支持、具有真正修复价值的新型治疗选择。
参考资料:
[1] Song P, Shafiq Z, Jiang H, Cai Q (2025) 神经干细胞在脑出血治疗中的应用:系统评价。Front . Pharmacol. 16:1660614。doi: 10.3389/fphar.2025.1660614
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复