糖尿病(DM)是一种严重的慢性代谢性疾病,常引发心血管疾病、视网膜病变、神经病变和肾脏疾病等严重并发症。患者确诊后需长期依赖口服降糖药或胰岛素以控制血糖、延缓病情,这不仅严重影响日常生活、需持续监测药物副作用,也为患者、家庭及社会带来了沉重的经济负担。
脂肪干细胞治疗糖尿病及其并发症中的进展及应用
在此背景下,脂肪干细胞治疗糖尿病展现了巨大的潜力。干细胞凭借其自我更新、多向分化及免疫调节能力,为多种疾病提供了新的治疗策略。其中,脂肪干细胞(ADSC)因其来源广泛(如腹部、四肢等)、获取便捷且对机体损伤小,相较于其他干细胞更具应用优势。目前,ADSC已在糖尿病动物模型治疗中取得成效,部分人体临床试验(I/II期)也已开展,少数甚至进入III期试验阶段。本文将重点综述脂肪干细胞治疗糖尿病及其并发症的研究进展,并深入探讨其潜在的作用机制。

什么是脂肪间充质干细胞,脂肪间充质干细胞特点及优势,及脂肪间充质干细胞在治疗2型糖尿病的优势及特点
1. 什么是脂肪间充质干细胞(ADSCs)?
脂肪间充质干细胞(ADSCs)是一类存在于脂肪组织中的间充质干细胞(MSC)。它们具有自我更新和多向分化的潜能,能够在一定条件下分化成多种细胞类型,如脂肪细胞、成骨细胞和软骨细胞等。与其他来源的间充质干细胞(如骨髓来源BM-MSC)相比,ADSCs拥有相似的增殖和分化能力,但其获取方式更为便捷。
2. 脂肪间充质干细胞(ADSCs)的特点及优势
ADSCs之所以成为细胞治疗的优选来源,主要归功于以下几大特点和优势:
-
来源丰富,易于获取:ADSCs可以从脂肪组织中大量获得,通常通过抽脂术等常规美容外科手术即可获取,对供体损伤小,避免了骨髓提取的剧痛和感染风险。
-
增殖能力强,培养时间较长:ADSCs在体外表现出较强的增殖能力,可以在培养中维持较长时间,为临床治疗提供了充足的细胞数量。
-
免疫表型明确:ADSCs表达典型的间充质干细胞表面标志物(如CD29, CD44, CD73, CD105等),并且不表达造血细胞标志物(如CD45, CD34)。其中CD36和CD49d被认为是ADSCs所特有的标志物。
-
安全性较高:多数研究表明,ADSCs具有遗传和表观遗传稳定性,未表现出明显的免疫排斥反应和致瘤性,在动物模型和人体临床试验中均显示出良好的安全性。
-
多重修复机制:ADSCs能够分泌多种修复性分子,包括神经营养因子、趋化因子、免疫调节因子和炎症调节因子,通过这些因子参与组织修复和功能调节。
3. 脂肪间充质干细胞在治疗2型糖尿病中的优势及特点
在2型糖尿病的治疗中,ADSCs除了具备上述通用优势外,还展现出以下针对性的治疗潜力和特点:
-
改善胰岛功能与胰岛素敏感性:基于其他间充质干细胞(如BM-MSC)的研究已证实,此类细胞能减少患者胰岛素需求、增加胰岛素敏感性并改善β细胞功能。作为优秀的替代来源,ADSCs有望继承并实现这些疗效。
-
强大的免疫与炎症调节能力:2型糖尿病常伴随慢性炎症和免疫紊乱。ADSCs分泌的免疫调节因子和炎症调节因子能够调节机体免疫状态(例如提升调节性T细胞水平),有助于控制糖尿病相关的炎症反应,从根本上改善胰岛素抵抗。
-
潜在的细胞修复与替代作用:动物模型验证,移植的ADSCs不仅能在体内分化并整合,还可能通过其分泌的多种修复分子,直接或间接地促进受损组织(如胰岛、肾脏、心脏)的修复,这对于防治糖尿病并发症具有重要意义。
-
规避伦理问题:与胎儿附属物(如脐带、胎盘)来源的MSCs不同,ADSCs来自成人自体脂肪组织,不存在相关的伦理争议,使其临床转化路径更为顺畅。
综上所述,脂肪间充质干细胞(ADSCs)凭借其易获取、安全性高、兼具改善胰岛功能和调节免疫/炎症的双重潜力,成为治疗2型糖尿病及其并发症的一种极具前景的细胞治疗选择。
ADSCs在1型糖尿病中的应用
在 1 型糖尿病中,由于自身免疫反应,辅助性 T 细胞 1 (Th1) 攻击胰腺 β 细胞,导致胰岛素分泌细胞 (IPC) 的损失。巨噬细胞、树突状细胞、自然杀伤细胞和淋巴细胞的存在也会加速 1 型糖尿病的进展。CD4+ T 细胞和炎症因子,包括干扰素-γ (IFN-γ)、白细胞介素-2 (IL-2) 和肿瘤坏死因子-α (TNF-α),在 β 细胞损伤过程中发挥重要作用。由于胰腺β细胞是体内唯一的胰岛素产生细胞,它们的死亡会导致胰岛素分泌完全停止,最终导致糖尿病的发展。
目前的干预措施无法预防血管退化、肾衰竭、失明等长期并发症。临床上已应用的β细胞替代方法主要有全胰腺和胰岛细胞移植。然而,这些方法的发展仍面临诸多障碍,如缺乏合适的胰岛供体、移植后需要终生免疫抑制治疗、糖尿病患者移植器官和细胞耗竭等,这些都制约了该技术的发展。近年来,ADSCs因其具有自我更新、分化为其他细胞谱系以及调节免疫系统的能力,逐渐受到研究者的关注,希望利用ADSCs的特性来达到治愈1型糖尿病的目的。
脂肪间充质干细胞治疗1型糖尿病的人体临床试验
目前, ADSCs用于治疗1型糖尿病患者尚处于初步研究阶段,相关研究不多,且给药途径存在差异。目前常用的给药途径包括将ADSC分化为IPC,然后注射到门静脉、胸腺或皮下组织。或者,可以将ADSC诱导为具有胰岛素分泌功能的ADSC,并与未分级培养的骨髓细胞共同移植到糖尿病患者的门静脉 。通过门静脉输注给药是因为这样可以使细胞留在肝脏微循环中,而肝脏作为耐受性器官,不会排斥细胞植入。但目前尚无统一的给药方法可以达到更好的治疗效果。此外,关于移植的ADSC数量,目前各研究也存在差异。一些研究使用106个细胞的水平,而另一些研究使用108个细胞的水平,如表1所示。然而,达到治疗效果同时尽量降低ADSCs潜在风险所需的具体细胞数量仍需要进一步研究。
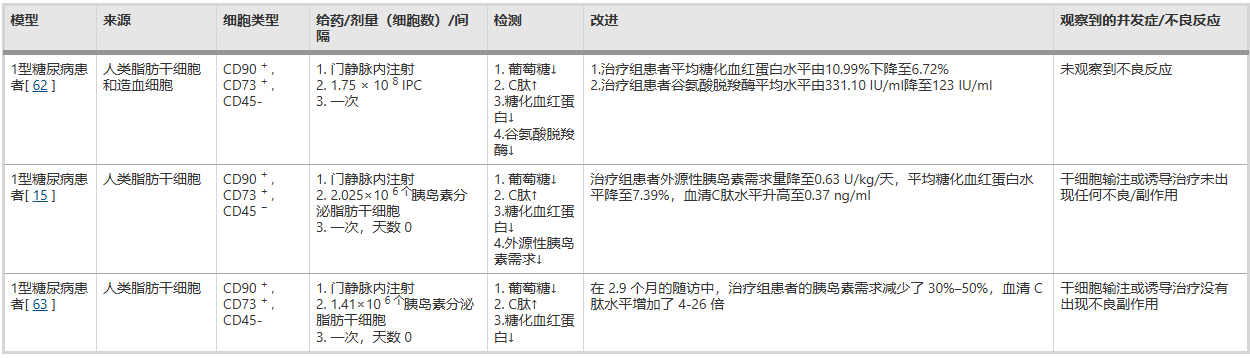
表1:使用ADSC治疗1型糖尿病的临床试验
脂肪间充质干细胞治疗1型糖尿病的三大作用机制
分化为胰岛素生成细胞,直接替代受损的β细胞功能。这是ADSC治疗1型糖尿病最直接的治疗机制。在特定因子诱导下,ADSCs能够成功分化为胰岛素生成细胞(IPCs),这些细胞具备以葡萄糖浓度依赖性方式分泌胰岛素和C肽的能力。当将这些分化的IPCs移植到糖尿病动物体内后,能够显著提升血清胰岛素水平,并使血糖恢复正常。其分化过程受Wnt、PI3K/Akt等多个关键信号通路的精密调控。
通过旁分泌作用保护与修复体内残留的胰岛。ADSCs不仅能够直接分化,更能通过分泌多种活性因子来支持和保护患者体内尚存的功能受损的胰岛。移植后的ADSCs可释放包括血管内皮生长因子(VEGF)、金属蛋白酶组织抑制剂1(TIMP-1)等在内的多种细胞因子,这些因子能有效防止β细胞凋亡并促进其增殖。同时,ADSCs还能调节自身免疫,通过降低促炎的Th1免疫应答和诱导调节性T细胞(Tregs)增殖,来改善攻击胰岛的自身免疫环境,从而保护残留的胰岛功能。
增强移植胰岛的活力与功能,提高移植成功率。在胰岛移植治疗中,ADSCs扮演着重要的“辅助”角色。无论是体外与胰岛共培养进行预处理,还是直接将ADSCs与胰岛共同移植,ADSCs都能通过分泌大量血管生成因子(如VEGF)促进移植胰岛内的新生血管形成,为其提供充足的营养和氧气。此外,ADSCs还能显著抑制促炎细胞因子产生并减少炎症细胞浸润,为移植的胰岛创造一个免疫豁免、低炎症的有利微环境,从而显著延长其存活时间并改善其功能。
ADSCs在2型糖尿病中的应用
2型糖尿病的特征是胰岛素反应组织出现胰岛素抵抗,胰腺β细胞胰岛素分泌受损。这类糖尿病占所有糖尿病病例的85%-95%。此外,营养过剩可导致脂肪组织炎症,影响多个组织,并降低胰岛素敏感性和β细胞功能。
目前,利用脂肪干细胞(ADSC)治疗2型糖尿病的临床试验较少,大多数应用仍在动物实验中进行验证。动物实验表明,通过小鼠尾静脉、腹膜和肾包膜注射ADSC,可通过恢复胰腺β细胞、减轻炎症、增加胰岛素敏感性等方式改善高血糖。部分机制的探索为ADSC的临床应用提供了新的方向。 详见表2。
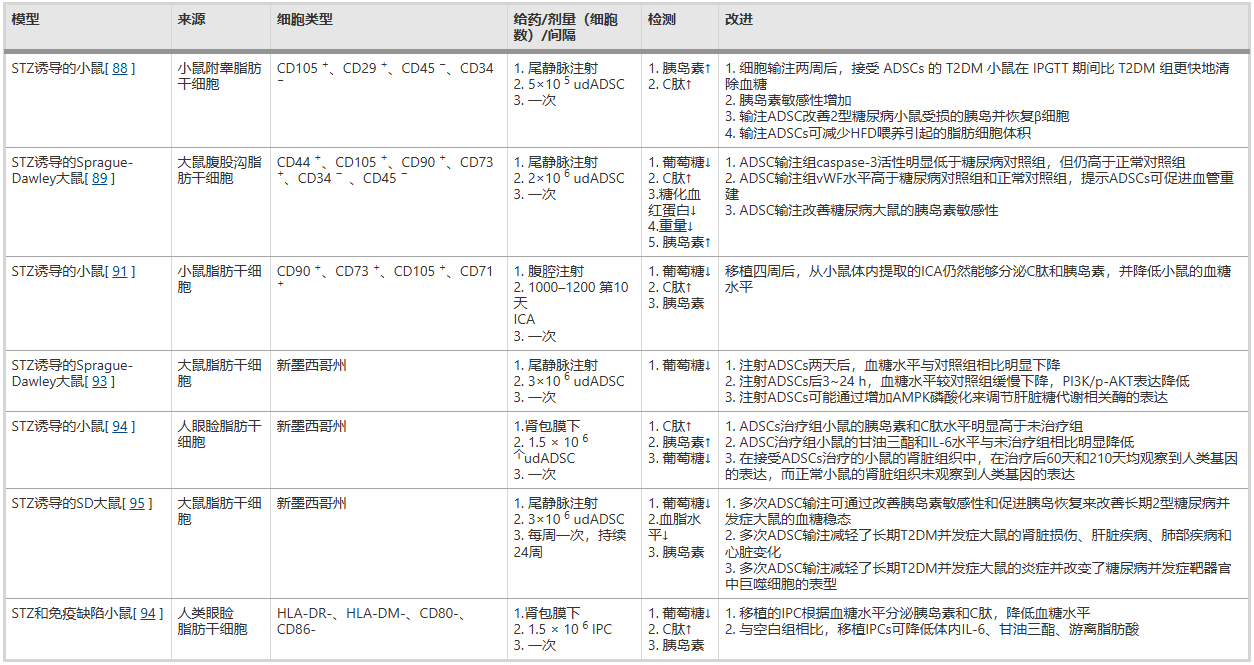
表2:ADSCs应用于T2DM的动物实验
脂肪间充质干细胞治疗2型糖尿病的三大作用机制
改善胰岛素抵抗。 这是ADSCs治疗2型糖尿病的关键机制。在糖尿病模型中,移植的ADSCs能够作用于骨骼肌、肝脏和脂肪等胰岛素敏感组织,恢复其细胞膜上的葡萄糖转运蛋白4和胰岛素受体数量,并增强胰岛素信号通路中胰岛素受体底物的磷酸化,从而直接改善细胞对胰岛素的响应。更重要的是,ADSCs能显著降低TNF-α、IL-6等关键促炎因子的水平,通过抑制肥胖相关的全身性慢性炎症来解除其对胰岛素信号通路的阻碍,从根本上缓解胰岛素抵抗状态。
促进胰岛素的产生与保护胰岛β细胞。 ADSCs通过双重途径提升机体胰岛素水平。一方面,它们可以在体外被诱导分化为胰岛素生成细胞,移植后直接分泌胰岛素以降低血糖。另一方面,ADSCs能通过旁分泌作用促进体内残留胰岛功能的恢复,通过分泌VEGF、肝细胞生长因子等多种血管生成因子促进胰岛血管化,为β细胞提供营养支持,并通过降低caspase-3活性来抑制β细胞凋亡,从而增加有功能的β细胞数量,助力其再生。
调节肝脏葡萄糖代谢。 ADSCs展现出一种快速降糖的独特能力。研究发现,在输注ADSCs后24小时内,糖尿病模型动物的高血糖状态就能得到迅速缓解,这无法完全用改善胰岛素抵抗和β细胞功能来解释。证据表明ADSCs能快速影响肝脏中与糖代谢相关酶的活性,提示其可能通过调节肝脏的糖原合成与糖异生等关键代谢途径,直接、快速地恢复机体的血糖稳态。尽管该机制尚待完全阐明,但它揭示了ADSCs作用的多效性与速效性(图1)。
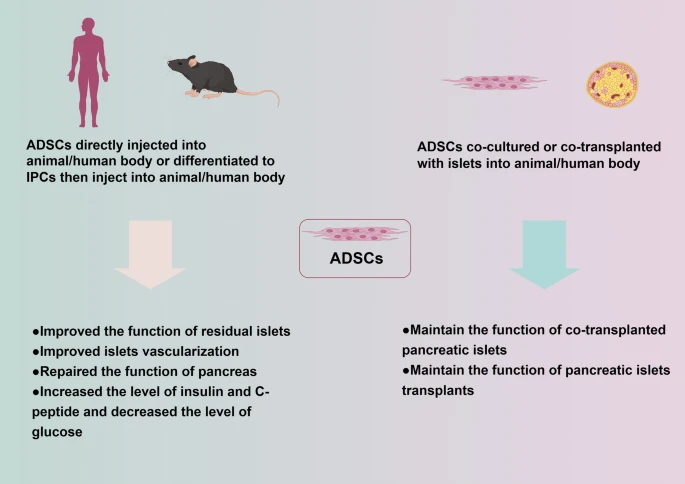
图1:ADSCs在DM中应用的潜在机制总结于图1中
脂肪间充质干细胞在糖尿病并发症中的应用
脂肪间充质干细胞治疗糖尿病伤口中的应用
根据现有研究,脂肪间充质干细胞在治疗糖尿病伤口(尤其是严重的糖尿病足溃疡)中展现出显著的应用潜力。糖尿病伤口因高血糖环境导致血管损伤、神经病变及免疫细胞功能异常,使得传统治疗困难重重,甚至面临截肢风险。而临床研究证实,ADSCs疗法能有效应对这一难题,例如一项研究显示ADSCs治疗组在第8周伤口完全闭合率达到73%,显著高于对照组的47%,且伤口闭合的中位时间(28.5天)较对照组(63.0天)大幅缩短,证明了其促进愈合的明确效果(表3)。
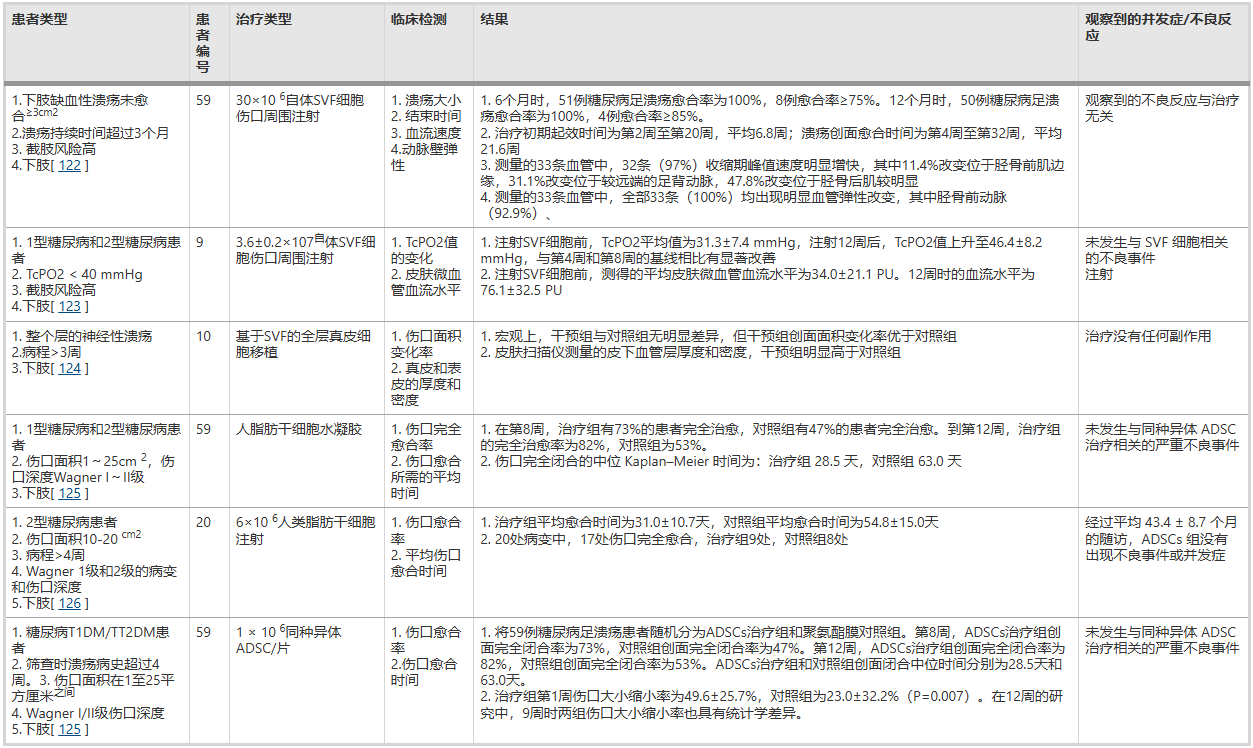
表3使用ADSC治疗糖尿病伤口的临床试验
ADSCs促进糖尿病伤口愈合主要通过三大机制协同作用。首先,其强大的旁分泌功能是核心,能分泌VEGF、成纤维细胞生长因子、血小板衍生生长因子等多种关键细胞因子,有效促进伤口局部的新血管生成,为组织修复提供营养。其次,ADSCs具备直接分化能力,能够分化为上皮细胞和内皮细胞,直接参与真皮重塑与上皮形成。最后,它们还能显著抑制局部炎症反应,通过下调IL-6、TNF-α等促炎因子并减少炎症细胞浸润,为伤口愈合创造有利的微环境。
综上所述,ADSCs通过促进血管新生、直接参与组织修复与调控炎症这三重机制,为难以愈合的糖尿病伤口提供了突破性的治疗策略。尽管当前人体临床试验数量仍有限,但现有证据已充分表明,基于ADSCs的疗法在加速伤口闭合、改善愈合质量方面具有巨大价值,代表了再生医学在这一临床难题上的一个重要发展方向。
脂肪间充质干细胞治疗糖尿病视网膜病变的应用
脂肪间充质干细胞(ADSC)为糖尿病视网膜病变(DR)的治疗提供了全新的神经血管保护策略。传统上,DR被视为一种微血管疾病,但近年研究揭示其早期即存在神经退行性变。ADSCs的核心应用潜力在于其能够分化为周细胞——这是一种在糖尿病环境下易受损且自我更新能力下降的关键血管支持细胞。通过移植ADSCs,它们可以整合到受损的视网膜血管结构中,直接补充和修复退化的神经血管单元,从而从源头上延缓血视网膜屏障的破坏和毛细血管的丢失,这超越了传统疗法仅能控制症状或破坏视网膜以减耗氧量的局限。
ADSCs的治疗机制主要体现在三个方面:首先,它们通过直接分化为周细胞来修复和稳定视网膜微血管系统,动物实验表明,玻璃体内注射的ADSCs能够整合到血管壁,延缓血视网膜屏障的破坏,防止高达80%的毛细血管丢失;其次,ADSCs通过旁分泌作用保护视网膜内皮细胞,体外共培养实验证实其能显著提高内皮细胞存活率;此外,ADSCs还能下调糖尿病视网膜病变相关的炎症基因表达,减轻视网膜血管渗漏和细胞凋亡,从多途径发挥神经血管保护作用。
总体而言,ADSCs通过修复微血管、保护内皮细胞和抗炎等多重机制,为糖尿病视网膜病变提供了有前景的治疗策略。尽管动物实验成果显著,显示其能有效延缓疾病进展,但目前研究仍处于临床前阶段,最佳移植方法、细胞精准定位及具体作用机制尚不完全明确,距离真正临床应用尚有较长距离,需要进一步的深入研究来推动其向临床治疗方案的转化。
脂肪间充质干细胞治疗糖尿病肾病的应用
脂肪间充质干细胞在治疗糖尿病肾病中的应用,主要体现在其分泌的外泌体所介导的多重保护机制。
糖尿病肾病的主要特征是肾小球滤过率下降、蛋白尿以及进行性的肾纤维化,其病理过程涉及高血糖引发的足细胞损伤、氧化应激、炎症反应及ECM过度积聚。而ADSCs来源的外泌体作为一种纳米级囊泡,能够将生物活性物质如微小RNA递送至肾脏靶细胞,为干预这一复杂过程提供了新策略。
ADSCs治疗糖尿病肾病的核心机制在于其外泌体对足细胞的关键保护作用。研究证实,ADSCs-Exos可通过携带特定的miRNA,精准调控多个信号通路,从而减轻肾损伤。例如,外泌体中的miR-26a-5p可通过靶向TLR4/NF-κB通路,下调VEGFA表达并抑制氧化应激,防止高糖诱导的足细胞凋亡;miR-486则通过抑制Smad1/mTOR通路来促进自噬,减少足细胞凋亡;而miR-215-5p能通过抑制ZEB2表达,延缓上皮-间质转化进程。这些机制共同作用,有效稳定了肾小球滤过屏障的核心结构。
综上所述,基于外泌体的ADSCs疗法通过递送多种保护性miRNA,在多环节上延缓了糖尿病肾病的进展,展现出巨大的治疗潜力。然而,该技术走向临床仍面临挑战,包括需要优化外泌体的制备工艺、明确其内的关键活性分子、并开发能将外泌体精准递送至肾脏病灶的方法。解决这些问题将是推动其从基础研究向临床应用转化的关键。
近年来的研究表明,肝脏改变是糖尿病的另一项并发症。糖尿病引起的高血糖会增加肝损伤和肝纤维化的风险,严重影响患者的健康和生活质量。糖尿病与肝脏疾病密切相关,但糖尿病肝脏改变的病理生理基础和进展尚不完全清楚,缺乏有效的早期干预措施。一些研究尝试将ADSC移植到动物体内,以减轻糖尿病引起的肝损伤和纤维化,并取得了一定的积极成果。这为进一步研究和开发ADSC用于治疗糖尿病相关肝病提供了重要的理论和实验基础。但尚未开展临床试验,对ADSC的治疗机制和途径的阐述也不够详细,需要进一步的研究来阐明。
ADSCs在糖尿病并发症中应用的潜在机制总结于图2中。
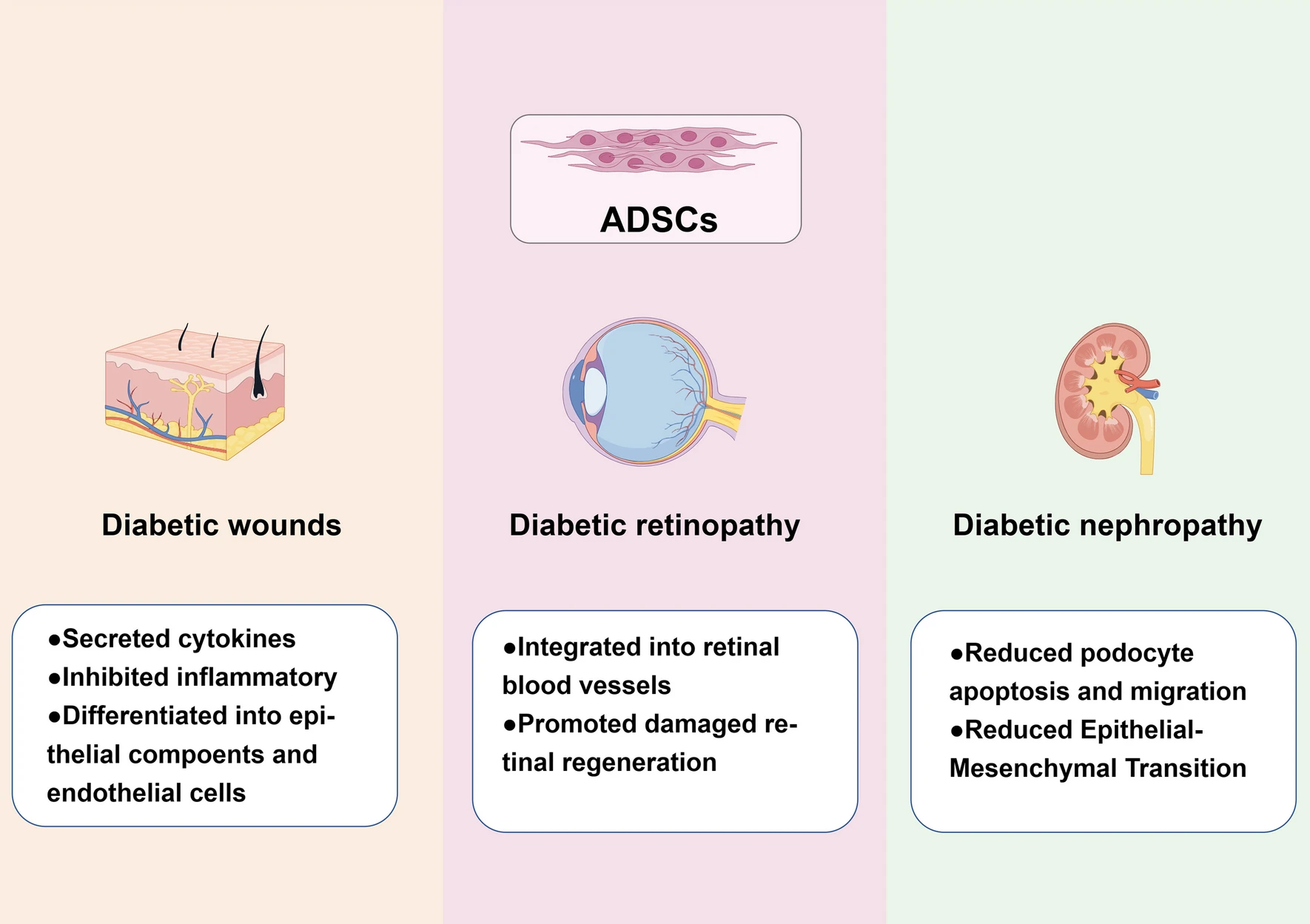
图2脂肪间充质干细胞( ADSCs)在糖尿病并发症中的应用及机制。
结论
综上所述,越来越多的研究表明,ADSCs或可成为治疗糖尿病的新途径。ADSCs治疗有望改善动物和人类的高血糖水平,并缓解相关并发症的症状。然而,要将ADSCs 转化为实际的临床应用,仍有许多工作要做。需要进一步的研究和临床观察,以评估ADSCs治疗的长期效果,并最大限度地降低其使用的潜在风险,从而在未来的临床应用中取得更可靠、更有效的疗效。
主要参考资料:
[1]:Yan, D., Song, Y., Zhang, B. et al. Progress and application of adipose-derived stem cells in the treatment of diabetes and its concomplications. Stem Cell Res Ther 15 , 3 (2024). https://doi.org/10.1186/s13287-023-03620-0
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复