摘要:帕金森病作为一种进行性加重的神经退行性疾病,目前以左旋多巴为代表的传统疗法虽能缓解运动症状,但难以逆转长期的神经退行性变,且常伴随显著副作用。近年来,干细胞治疗帕金森病的方式为帕金森病治疗提供了新思路,其中,将干细胞疗法与脑源性神经营养因子(BDNF)增强策略相结合,展现出通过协同作用恢复多巴胺能功能并促进神经元存活的巨大潜力。本综述旨在系统评估该联合策略的有效性,深入探讨其协同机制、技术实现路径及临床转化前景,以期为开发帕金森病的综合治疗方案提供理论依据。
干细胞治疗帕金森病的新路径:干细胞修复多巴胺神经元+BDNF提供神经保护的双重干预
引言:帕金森病的病理核心是中脑黑质多巴胺能神经元的进行性丢失,导致纹状体多巴胺水平下降及运动功能障碍。现有治疗手段主要围绕多巴胺替代(如左旋多巴)、器械辅助(如深部脑刺激)及手术策略展开,虽能一定程度缓解症状、延缓进展,但均难以从根本上修复受损的神经环路,且长期应用易出现疗效波动和并发症。

近期发表于《中国神经外科杂志》的一篇综述重点探讨了将干细胞疗法与BDNF调节联合应用,作为帕金森病综合治疗方案的潜力[1]。该策略表明在帕金森病治疗中,干细胞疗法扮演着“种子”的角色,旨在替代丢失的多巴胺能神经元以进行结构性修复;而BDNF则扮演着“肥料”的角色,通过提供神经营养支持以促进神经元存活、功能整合及回路修复。
目前帕金森病的治疗方法
目前帕金森病的治疗主要仍以对症治疗为主,通常需要多种药物联合治疗,且副作用显著。这些疗法仅针对症状,而未针对潜在的神经元退行性病变。
帕金森病目前的治疗方法旨在通过药物、器械辅助和手术策略来缓解运动症状、延缓疾病进展并提高患者的生活质量。这些疗法主要针对多巴胺缺乏和异常蛋白积累,治疗方法涵盖了从传统的左旋多巴方案到先进的神经调控和持续给药系统等多种途径。
表1对这些治疗方式进行了全面的总结,包括其作用机制、优势和局限性。
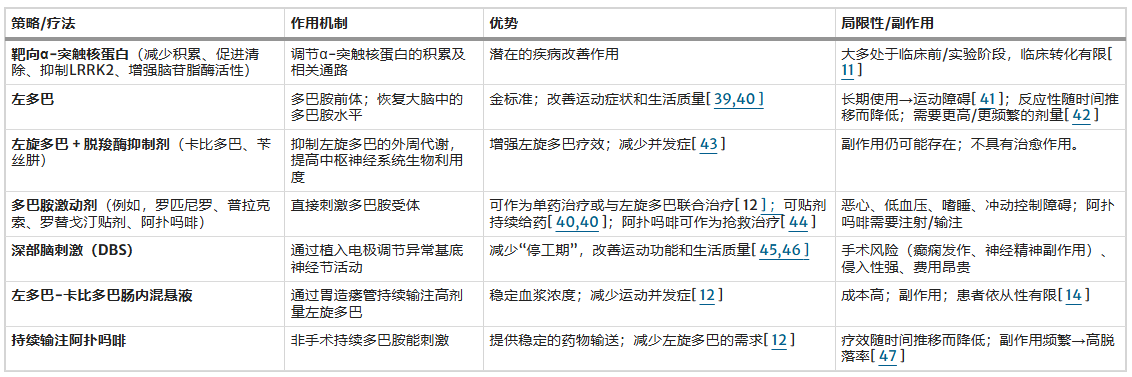
表1:帕金森病目前的治疗策略
如表1所示 ,帕金森病的治疗涵盖了一系列药物和先进的治疗策略。左旋多巴仍然是治疗的基石,但长期并发症,例如运动障碍和运动波动,凸显了辅助药物和器械辅助治疗的重要性。包括深部脑刺激和持续输注系统在内的先进干预措施,为口服药物治疗无效的患者提供了更多选择。
然而,这些方法通常受限于其侵入性、高昂的费用和不良反应,因此亟需开发疗效更高、安全性更强的新策略。
干细胞替代疗法治疗帕金森病的机制、优势及可行性
干细胞替代疗法治疗帕金森病的机制主要涉及通过干细胞分化为多巴胺能神经元来替代因疾病退化而丢失的细胞,从而恢复大脑中的多巴胺水平。具体而言,该疗法通过直接修复途径,如将人类多能干细胞(hPSCs)或诱导多能干细胞(iPSCs)分化为中脑多巴胺能祖细胞(mDAPs),移植后这些细胞能够整合到宿主神经回路中,生理性地释放多巴胺,并促进纹状体再支配和神经回路修复。
同时,间接修复机制也发挥作用,包括神经营养因子(如GDNF和BDNF)的分泌,这些因子支持多巴胺能神经元的分化、存活和维持,从而增强神经修复和功能恢复。
该疗法的优势在于其多能性和个性化潜力,例如iPSCs可用于自体移植,与供体基因匹配,显著降低免疫排斥风险;此外,干细胞不仅能提供细胞替代,还具有免疫调节和神经营养支持功能,从而改善运动功能并减少对传统药物如左旋多巴的依赖。
临床前和早期临床试验已初步证实其益处,包括安全移植、多巴胺释放和功能恢复,且与基因疗法联合应用可能进一步增强疗效。
从可行性角度看,近期临床研究进一步凸显了干细胞疗法在帕金森病治疗中的转化潜力。已成功制备出个性化的诱导多能干细胞(iPSC)衍生多巴胺能祖细胞,用于患者特异性再生治疗。

在一项I/II期临床试验中,iPSC衍生的多巴胺能祖细胞成功植入,释放多巴胺,且未发生肿瘤发生。
同样,在一项I期临床试验中,人胚胎干细胞(hESC)衍生的多巴胺能神经元也安全移植,整合到宿主神经回路中,并促进了功能恢复。这些发现强调了基于干细胞的神经再生策略在帕金森病治疗中的可行性和前景。
BDNF在帕金森病中的作用和治疗潜力是什么?
在作用机制方面,BDNF在帕金森病中扮演着关键的神经保护角色,它通过与TrkB受体结合激活PI3K/Akt、MAPK/ERK和PLC-γ信号通路,显著增强多巴胺能神经元的存活率、突触可塑性和抗凋亡能力。研究表明,帕金森病患者黑质和纹状体中的BDNF水平显著降低,且与运动障碍和非运动症状密切相关。
-
BDNF不仅支持多巴胺能神经元的存活,还能保护黑质中GABA能神经元免受兴奋性毒性损伤,并通过调节多巴胺受体和酪氨酸羟化酶表达来优化多巴胺信号传导,为帕金森病的病理机制提供重要靶点。
BDNF的治疗潜力主要体现在其多维神经保护作用上,临床前研究显示外源性BDNF或内源性BDNF上调可减少多巴胺能神经元丢失并改善运动功能。为克服BDNF难以穿透血脑屏障的局限性,研究人员开发了基因工程化干细胞策略——通过慢病毒载体或CRISPR/Cas9技术将BDNF基因整合到MSCs或iPSCs中,使其在移植后持续分泌BDNF。
- 这种联合策略不仅能提供结构修复(干细胞分化为多巴胺能神经元),还能提供功能调控(BDNF增强神经元存活和突触整合),实现”细胞替代+神经营养支持”的双重治疗优势,显著优于单一疗法。
尽管BDNF治疗前景广阔,但在可行性上面临着显著的递送挑战:BDNF分子较大、半衰期短,难以穿透血脑屏障,直接给药需要侵入性操作且存在癫痫等风险。为解决这些问题,研究人员正探索纳米颗粒递送系统、可诱导基因表达系统(如四环素响应启动子)以及CRISPR精准整合技术,以实现BDNF的靶向、可控表达。
同时,BDNF与干细胞疗法的联合应用已展现出显著优势,不仅延长了药效持续时间,还改善了”剂末现象”,为帕金森病从”症状控制”向”神经修复”的转变提供了关键突破点。
干细胞替代疗法与脑源性神经营养因子(BDNF)的联合应用
1. 协同增效的机制:为何要联合?
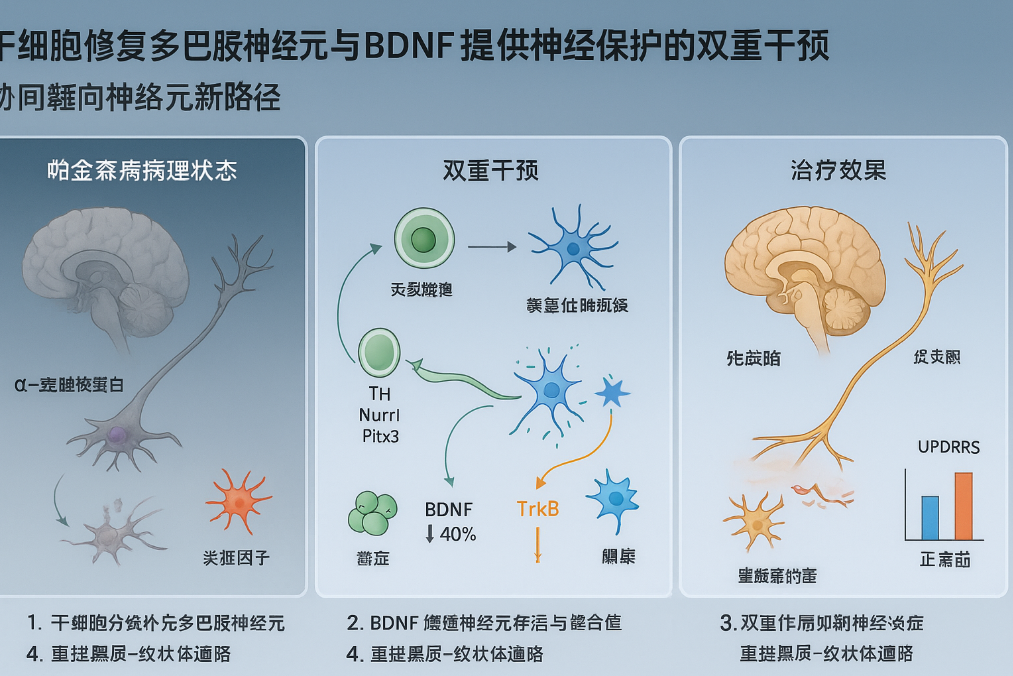
帕金森病的核心病理是黑质多巴胺能神经元的退行性丢失,导致纹状体多巴胺水平下降。细胞替代疗法通过移植干细胞分化为功能性多巴胺能神经元,直接补充缺失的神经元;而BDNF作为关键神经营养因子,通过激活TrkB受体下游的PI3K/Akt、MAPK/ERK等信号通路,促进神经元存活、突触可塑性及抗凋亡,同时抑制神经炎症反应。两者的联合实现了“结构修复”与“功能调控”的双重作用:
- 互补性:干细胞移植解决神经元数量不足的问题,而BDNF通过营养支持和抗炎作用维持移植神经元的长期功能整合。
- 信号级联增强:BDNF的旁分泌作用可激活移植神经元的存活信号(如上调Bcl-2、抑制Bax),同时通过抑制NF-κB通路降低小胶质细胞介导的炎症损伤,为移植细胞提供再生微环境。
- 突触重塑:BDNF的轴突引导效应促进移植神经元与宿主神经网络的连接,加速功能回路重建,弥补单纯细胞替代可能存在的整合障碍。
总而言之,这些机制阐明了干细胞疗法与BDNF联合应用如何增强帕金森病的神经再生和功能恢复,如图1所示。

图1:干细胞和脑源性神经营养因子(BDNF)的作用机制
2. 技术实现的策略:如何实现联合?
联合策略的关键在于基因工程化干细胞的设计与精准调控:
- 基因修饰干细胞:通过慢病毒载体或CRISPR/Cas9技术将BDNF基因整合到干细胞(如iPSCs或MSCs)中,使其分化为多巴胺能祖细胞的同时持续分泌BDNF。例如,Nurr1/Pitx3转录因子的共表达可定向诱导干细胞生成TH阳性神经元,而BDNF的过表达进一步增强其存活和突触功能。
- 动态调控系统:引入四环素响应启动子(Tet-On/Tet-Off)等可诱导系统,通过强力霉素控制BDNF的表达水平,避免兴奋性毒性或过度激活带来的风险。
- 安全机制:在工程化干细胞中整合“自杀基因”(如HSV-tk),在出现异常增殖或免疫排斥时,通过前药(如更昔洛韦)选择性清除移植细胞,提升治疗安全性。
- 递送优化:利用微流控芯片等技术模拟体内环境,验证BDNF浓度梯度对轴突生长方向的引导作用,为体内移植提供预实验支持。
3. 临床转化的优势与前景:联合应用带来什么价值?
联合疗法相较于单一策略具有显著优势,并推动帕金森病治疗向“神经修复”迈进:
- 疗效提升:临床前研究显示,BDNF修饰的MSC移植可使帕金森动物模型的旋转行为减少、纹状体多巴胺水平升高,且高剂量组影像学改善更显著。结合2025年《Nature》报道的干细胞移植试验,联合BDNF的策略可能延长药效持续时间,减少“剂末现象”,并改善非运动症状(如抑郁)。
- 安全性增强:通过基因编辑技术(如CRISPR精准整合BDNF至“安全港”位点)降低插入突变风险,同时动态调控系统减少过度表达副作用,使疗法更符合临床转化标准。
- 标准化潜力:BDNF修饰的干细胞疗法可标准化生产,尤其是hESC衍生的细胞具备批次一致性,为“现货型”细胞药物开发奠定基础。
- 多靶点干预:BDNF不仅作用于多巴胺能神经元,还通过TrkB受体广泛调节突触可塑性和神经发生,覆盖帕金森病中的神经退行性变及神经炎症等多重病理机制,为晚期患者提供更全面的治疗选择。
总结:干细胞与BDNF的联合策略通过结构修复与功能调控的协同作用,克服了传统疗法的局限性,代表了帕金森病治疗从“症状控制”向“神经再生”的范式转变。随着基因工程、递送技术和临床试验的推进,这一联合疗法有望成为未来神经退行性疾病的核心治疗模式。
结论
干细胞疗法与脑源性神经营养因子(BDNF)增强疗法的结合,代表了帕金森病治疗领域一个充满希望且极具创新性的方向。这种协同疗法通过同时解决神经元丢失和营养支持问题,不仅有望改善症状,还有望延缓疾病进展。
随着不断完善和验证,该策略有望为更有效、更持久的疗法铺平道路,为面临帕金森病挑战的患者带来希望。
参考资料:
[1] Jonny, J., Larasati, AD, Sunjaya, QA 等. 干细胞疗法与脑源性神经营养因子 (BDNF) 在帕金森病中的协同作用:联合神经再生策略的简要综述. 中华神经外科杂志 11 , 29 (2025). https://doi.org/10.1186/s41016-025-00415-5
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复