近年来,生物医学新技术呈现爆发式发展,细胞与干细胞治疗正逐步逼近临床转化门槛。10月10日,国务院正式发布第818号令——《生物医学新技术临床研究和临床转化应用管理条例》(以下简称《条例》),该条例将于2026年5月1日起施行。《条例》系统界定了从研究开展、临床转化到收费机制、责任归属等全流程管理规则,为细胞治疗领域构建了一套可执行、可追溯、可监管的规范化路径。
一、管理范围明确:厘清“药”与“术”的边界
《条例》将“生物医学新技术”定义为:以健康或治疗为目的,作用于人体细胞或分子层面,且在国内尚未进入常规临床应用的医学手段。其与药品、医疗器械的管理边界,由国家卫健委会同药监部门进一步明确。通俗理解:
-
标准化产品(如同种异体细胞制剂)更接近“药品”,走药监审评通道;
-
医院实施型流程或术式(如细胞联合影像导航技术)则适用本《条例》,按“医疗新技术”路径管理。
二、实施路径清晰:构建“研究—转化—应用”闭环
整个流程可概括为:学术与伦理审查 → 向国家卫健委备案 → 按备案方案开展研究(研究期零收费) → 研究结束申请“临床转化应用” → 获批后公布技术名称、准入条件与操作规范 → 符合条件的医院按规范开展临床应用(可收费) → 动态再评估,必要时暂停或叫停。
该闭环机制不仅使项目进展公开透明,也让患者明确知晓哪些阶段可以收费。

三、研究期三大硬性要求
-
零收费:不得向受试者收取与研究相关的任何费用。
-
依方案执行:严格按备案内容实施,如变更影响受试者权益,须重新获得知情同意。
-
全程可追溯:研究记录与原始材料须长期保存(一般不少于30年,涉及子代健康则永久保存),以备评估与抽查。
四、收费条件明确:两项前提缺一不可
收费并不等同于“通过伦理审查”或“完成备案”。必须同时满足:
- 获得“临床转化应用”批准;
- 国家层面已公开该技术的名称、准入条件与操作规范。
此后,符合条件的医疗机构方可按规范收费。此步骤是项目从“研究”转向“临床应用”的关键分水岭。

五、机构准入:三甲医院为主,保障实施质量
实施机构原则上为三级甲等医院,并须具备学术委员会、伦理委员会,以及与所开展技术相匹配的人员、场地、设备、制度和经费保障。此举旨在同步提升项目执行能力与监管可见度。
六、加速机制:优先审查与紧急应用
-
优先审查:针对危及生命且缺乏有效治疗手段的疾病,以及公共卫生急需的技术,评审流程提速但标准不降低。
-
紧急应用:在发生特别重大突发公共卫生事件时,经科学论证后,可在限定范围与期限内紧急使用在研技术。
这两类通道旨在加速确有需要且风险可控的技术落地,兼顾效率与安全。
七、持续监管:再评估机制作为“安全阀”
即便技术已获批进入临床应用,一旦出现新的风险证据或失控情况,将随时启动再评估。评估不达标者,临床应用将被暂停或终止,形成常态化退出机制。

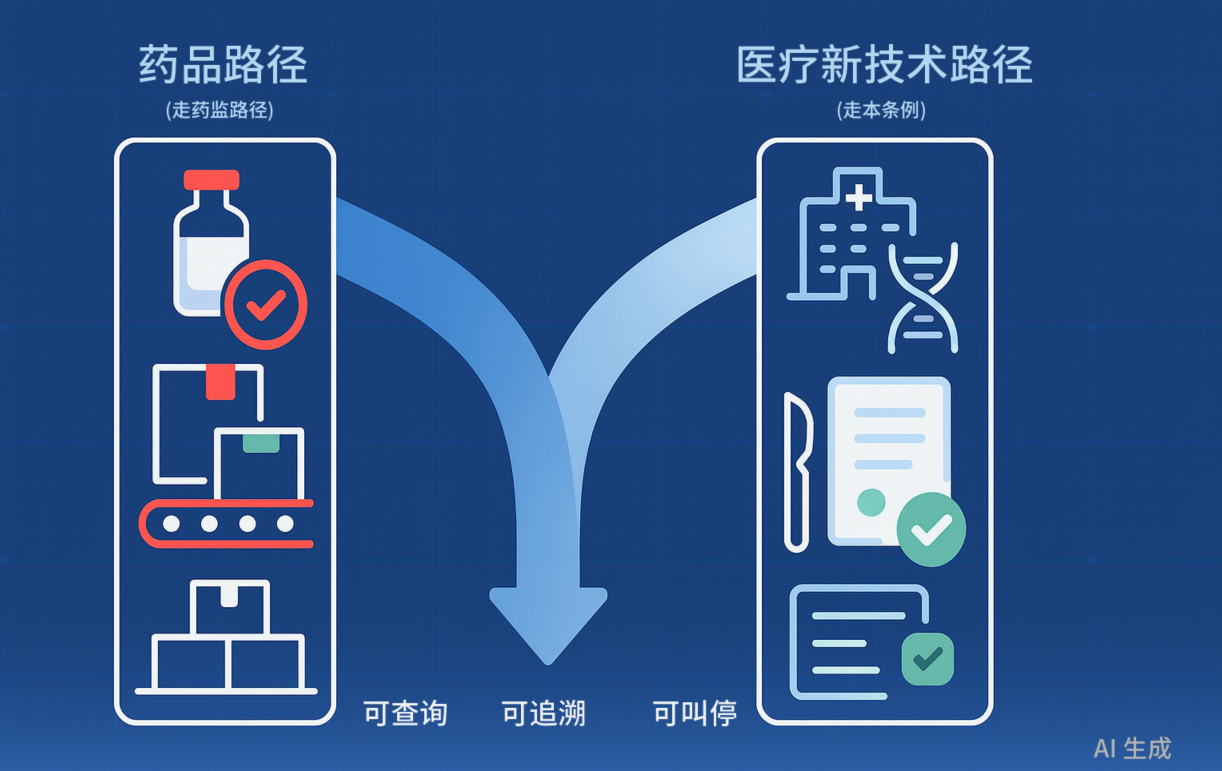
八、产业与科研路径进一步厘清
-
药品路径:适用于可标准化、跨院同质的细胞制品(如通用型异体细胞),强调CMC(化学、制造与控制)与注册临床。
-
新技术路径:适用于院内制备、流程化术式(如细胞联合外科/康复等),按备案—研究—转化流程推进。
九、三问三答:关键问题一目了然
为何有的项目免费,有的收费?
研究期内零收费;获“临床转化应用”批准并公布规范后,符合条件医院可收费。
如何核实某技术是否可收费?
查询国家是否已公开该技术的名称、准入条件和操作规范。仅有备案或伦理批文不代表可收费。
参加研究后医院是否继续联系?
是。研究机构须开展长期随访,评估安全性与有效性,相关记录按规定长期保存。

十、总结与展望
《条例》将“证据链”与“应用场景”整合为一条清晰路径:既能加速推进,也能及时刹车;既鼓励转化,也强化追溯。
-
对患者而言,就医选择更加明确可及;
-
对医院与研究团队,则提供了更清晰的合规发展路径。
未来,值得关注的焦点包括:急性期治疗窗口的规范加速,以及长期随访与真实世界数据(RWE)质量的持续提升。随着数据日益扎实、路径更加透明,细胞治疗有望更快、更稳地惠及真正需要的患者。
信息来源:国务院令第818号、司法部、国家卫健委负责人就《条例》答记者问、科技教育司专家解读
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复