
然而,干细胞疗法因其产品来源、类型及制备工艺的多样性,其作用机制远比传统药物复杂,这也为其临床转化带来了系列挑战。这些挑战主要包括长期安全性评价、定向分化效率、明确的临床转化路径以及高昂的研发成本,它们共同构成了产业进一步发展的制约因素。
尽管如此,国内外的企业与科研机构正持续投入研发。随着技术的不断成熟与产业生态的完善,这些挑战有望被逐步克服,从而使干细胞疗法成为解决众多未满足临床需求、推动医疗健康领域进步的关键力量。
在此背景下,国际期刊《Stem Cell Research&Therapy》上发表了一篇题为“干细胞革命:弥合研究与临床应用之间的差距”的文献综述[1]。

该综述系统阐述了全球干细胞的发展进展、临床应用、产业市场分析以及干细胞疗法临床转化面临的挑战与机遇,为本领域的从业者提供了重要参考。
全球干细胞发展进展
目前,全球共有16种间充质干细胞(MSC)产品获准上市,其中包括一种来自澳大利亚的自体间充质前体细胞(表1)。获准上市的产品主要利用MSC的组织修复和免疫调节功能,其适应症包括急性心肌梗死、退行性关节炎、肌萎缩侧索硬化症、骨修复、移植物抗宿主病、克罗恩病和肛周瘘、COVID-19、严重肢体缺血等。
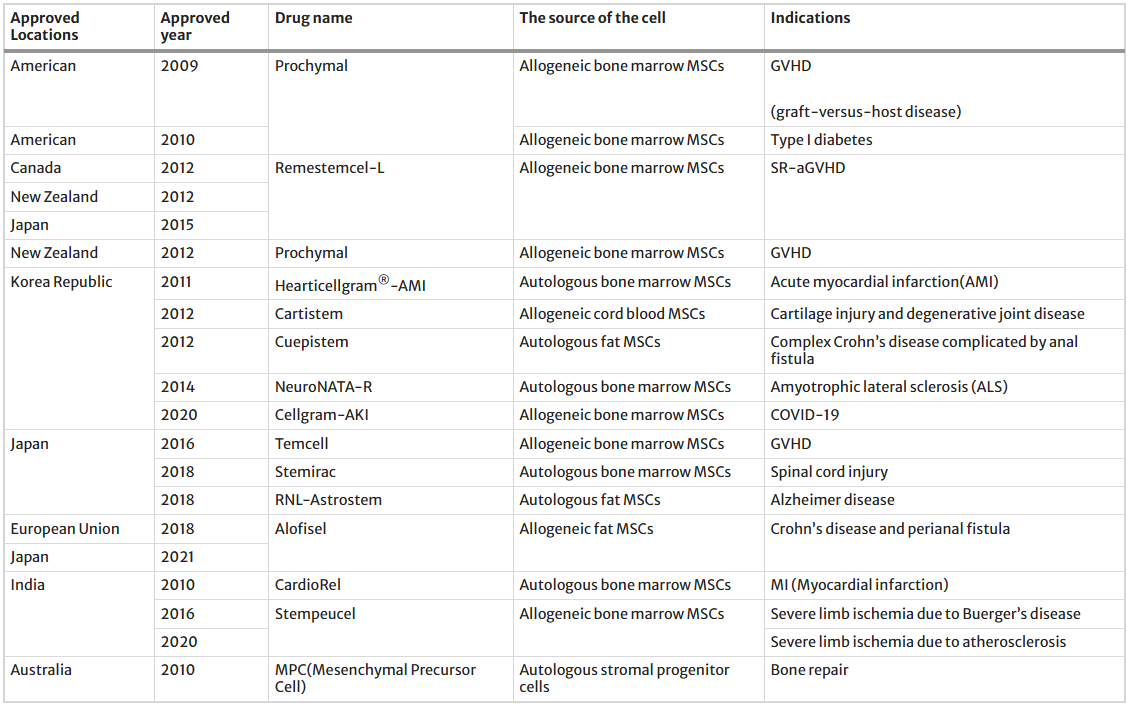
表1:目前市售的干细胞产品
新增:
2024年12月18日,美国食品药品监督管理局(FDA)正式批准了remestemcel-L(商品名Ryoncil,Mesoblast公司),这是一种异体骨髓来源的间充质基质细胞(MSC)疗法,用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。Ryoncil是首个获得FDA批准的MSC疗法,标志着干细胞药物监管的重要突破。

回顾其审批历程,该疗法曾经历曲折。
- 在2023年8月,FDA曾就其生物制品许可申请(BLA)发出完整回应函,指出数据不足并要求解决化学、生产和控制(CMC)相关问题。此后,Mesoblast公司补充了数据并重新提交申请。
- 2024年7月,FDA接受了重新提交的BLA,并最终于年底予以批准。其疗效得到了一项在54名儿科患者中进行的临床试验的支持,第28天的客观缓解率达到70%。
与此同时,由Brainstorm公司开发的用于治疗肌萎缩侧索硬化症(ALS)的间充质干细胞药物NurOwn,其开发路径则有所不同。该产品此前在2023年的BLA审评中因疗效证据不足未获批准。最新进展显示,BrainStorm公司已与FDA就一项新的3b期临床试验设计达成特别协议评估(SPA),并于2025年获得了FDA批准启动该试验。这表明NurOwn仍在通过后续临床试验继续寻求上市批准,而非已进入最终的上市许可阶段。
Ryoncil的最终获批与NurOwn仍需进行确证性试验的对比,清晰地反映了干细胞药物在证明疗效一致性和满足监管要求方面所面临的挑战,以及通过充分临床数据解决这些挑战后的成功可能。
相比之下,中国干细胞治疗市场在过去两年增长显著。截至2025年11月,中国已获得近202项研究性新药(IND)批准,涉及55款干细胞药物临床试验申请获得受理,覆盖20多种适应症。
2025年11月,国家药品审评中心(CDE)共受理了156项干细胞药物临床试验申请,涉及78家企业(不含子公司),其中多数为脐带间充质干细胞产品,适应症主要包括肝病、退行性疾病及自身免疫性疾病等。这表明中国干细胞临床转化已开启“黄金时期”,前景广阔。
全球监管政策比较
干细胞疗法的监管框架因地区而异,系统比较各大地区的政策有助于理解其对临床转化的影响。
- 美国FDA:根据《公共卫生服务法》第351(a)条,将大多数干细胞疗法归类为生物制品,要求严格的CMC和长期安全性数据。以NurOwn为例,2023年其BLA因疗效证据不足被拒,体现了FDA对证据标准的高要求。
- 欧盟EMA:将干细胞纳入“先进疗法药品”(ATMP)监管,细分组织工程、基因治疗和细胞治疗产品,采用集中审批流程,并强调基于风险的分类。
- 日本PMDA:实施《再生医学安全法》,允许针对未满足医疗需求进行“有条件和有时限的批准”,如2014年批准iPSC衍生的RPE细胞治疗黄斑变性,在加速药物可及的同时要求上市后监测。
- 中国NMPA:实行“双轨制”监管,即药物IND途径与技术应用临床研究途径并行,既鼓励创新(如2025年批准202项IND),又严格控制风险(如对异体MSC供体资格设严格要求)。
干细胞治疗在6大疾病中的临床应用
干细胞疗法是将健康的干细胞移植到患者体内或患者自身体内,以促进病变细胞的修复或功能性细胞和组织的再生。这种治疗方法被认为是治疗多种疾病的基石。
目前,干细胞疗法的主要临床应用涵盖多种疾病,如图1所示。干细胞临床研究主要针对的疾病包括溃疡性结肠炎、卵巢功能不全、骨关节炎、狼疮性肾炎、银屑病、脊髓损伤和急性心肌梗死等。
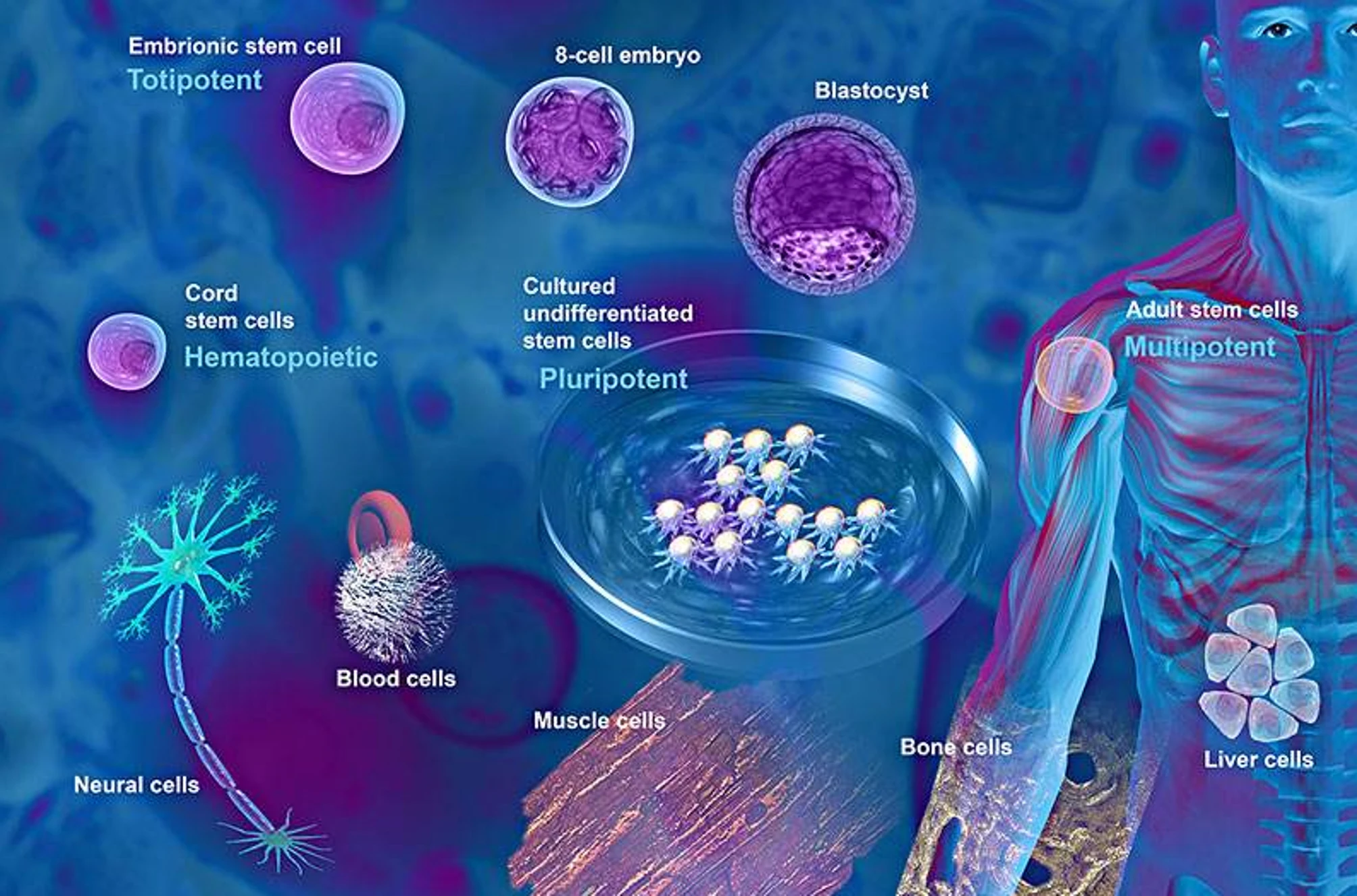
图1:干细胞疗法是一种新兴的治疗方法。它利用干细胞的自我更新能力和多向分化潜能,通过将健康的干细胞移植到患者体内以替代受损或病变的细胞,从而治疗多种疾病。这种治疗方法适用范围广泛,可用于治疗神经系统疾病、血液系统疾病、免疫系统疾病和内分泌系统疾病。
01、血液系统疾病
干细胞在治疗血液系统疾病中的应用核心是造血干细胞移植,该方法已成为治愈多种恶性与非恶性血液病的标准手段。其原理基于造血干细胞卓越的自我更新与多系分化能力,能重建患者受损的造血与免疫系统。移植适用于急性白血病、淋巴瘤、骨髓增生异常综合征等恶性疾病,以及重型再生障碍性贫血、地中海贫血等非恶性疾病,直接替换病变的造血系统。
当前该领域的前沿突破在于基因编辑技术的临床应用。通过 CRISPR/Cas9 或慢病毒载体等技术对患者自身的造血干细胞进行体外基因改造,可从根本上纠正遗传缺陷。例如,Casgevy疗法通过编辑BCL11A基因来治疗镰状细胞病,而Lyfgenia疗法则利用慢病毒载体递送功能性血红蛋白基因。不过,这类个体化疗法成本极高(如Casgevy约220万美元/人),其可及性是目前全球推广的主要障碍。

社论:CRISPR-Cas9基因编辑疗法首次获批用于治疗镰状细胞病和输血依赖型β-地中海贫血
在国内,多家生物科技公司正积极推动干细胞基因治疗产品的研发与转化。针对β-地中海贫血等遗传性血液病,邦耀生物、博雅基因、瑞丰生物等企业已进入临床研究阶段,主要采用的技术路径同样是CRISPR/Cas9基因编辑或慢病毒载体转导。这标志着中国在该领域已步入国际前沿赛道,但后续的商业化路径与可及性仍是产业面临的关键考验。
02、神经系统疾病
神经系统疾病涵盖一系列影响中枢神经系统和周围神经系统的障碍,包括但不限于神经免疫性疾病、中枢神经系统感染、周围神经病变、运动障碍以及癫痫等。干细胞具有通过细胞替代机制替换死亡或受损的神经细胞的潜力,可促进受损神经网络的修复,并分泌多种神经营养因子和营养性因子,从而激活神经细胞、促进新细胞的再生与重建。近期报道表明,干细胞已被用于多种神经系统疾病的治疗。
帕金森病(PD)是一种中枢神经系统的退行性疾病,其病因尚不明确。研究表明,该病可能源于大脑黑质细胞退化,无法产生足够的多巴胺。干细胞治疗PD具有一定优势,被认为是一种可行的细胞替代疗法,也是当前干细胞研究的热点方向之一。相关研究涉及的干细胞类型包括诱导多能干细胞(iPSCs)、间充质干细胞(MSCs)、神经干细胞、胚胎干细胞等。
2023年5月,拜耳公司公布了其干细胞衍生疗法BRT-DA01用于治疗帕金森病的I期临床研究结果(NCT05897957)。该疗法在低剂量组和高剂量组共12名受试者中均表现出良好的安全性和耐受性。一年内未发生与治疗相关的严重不良事件,部分患者症状得到缓解。

对先前接受过BRT-DA01治疗的帕金森病患者进行持续评估
BRT-DA01(由iPSC分化的多巴胺能神经元)I期扩展研究数据显示,在18个月随访期内,12名患者中有7人维持了UPDRS III评分(运动症状)至少30%的降低,且未出现运动障碍(左旋多巴常见副作用)。然而,目前仍面临“神经元整合”的挑战——仅有15–20%移植的iPSC来源神经元能与宿主组织形成功能性突触连接,限制了长期疗效。
在视神经脊髓炎谱系疾病(NMO)方面,Fu等人报道了15例接受骨髓间充质干细胞治疗的NMO谱系疾病患者。这些患者静脉输注约1×10⁸个自体骨髓MSCs,并随访2年。其中13例患者未出现临床复发,EDSS评分显著改善。另一项研究纳入12例使用自体MSCs治疗NMO的患者,经精心护理和临床干预后,所有患者病情均有所好转并出院,其中2例完全康复。
在多发性硬化症(MS)领域,Riordan等人观察并报告了干细胞对20例MS患者的临床疗效:其中15例为复发缓解型MS,4例为原发进展型MS,1例为继发进展型MS。随访结果显示,所有患者临床症状均有所缓解,EDSS评分显著改善,且未出现病情恶化或复发。
另外,干细胞在自身免疫性脑炎、重症肌无力、阿尔茨海默病、脊髓损伤等疾病的治疗中也取得了一定进展。此外,中生源创、跃赛生物、睿健再生医学等企业也在针对中枢神经系统疾病的iPSC细胞药物领域积极布局,并加速推进相关研发进程。
03、内分泌系统疾病
内分泌及代谢性疾病通常由内分泌腺体病变引起,并常累及多个其他系统的器官功能障碍。干细胞具有分化为人体内分泌系统中多种功能性细胞类型的能力,包括甲状腺滤泡上皮细胞、肾上腺皮质上皮细胞、肾上腺髓质细胞等。这些新生成的功能性细胞能够替代坏死的细胞,从而恢复内分泌系统、神经系统与免疫系统之间相互依赖的调节机制,共同维持机体的内环境稳态。
最常见的内分泌系统疾病是糖尿病,这也是干细胞在内分泌疾病领域应用最为广泛的治疗方向。基于干细胞的疗法有望从根本上治愈糖尿病,例如移植由干细胞分化的胰岛细胞或胰岛类器官、利用间充质干细胞或诱导多能干细胞(iPSCs)治疗糖尿病等,为该疾病提供了全新的治疗思路。
2023年7月,根据国家卫生健康委员会备案的干细胞临床研究项目,天津市第一中心医院与北京大学干细胞研究中心合作,成功完成了全球首例将犬源重编程诱导多能干细胞(CiPSC)分化而来的胰岛样细胞移植用于1型糖尿病患者的手术。该治疗技术有望成为彻底治愈1型糖尿病(T1DM)的理想方案。
目前,全球范围内主要开展iPSC治疗糖尿病临床试验的企业是Vertex公司。
2023年3月,Vertex宣布其VX-264的新药临床试验申请(IND)已获得美国FDA批准。VX-264是一种源自干细胞、完全分化的胰岛细胞疗法,封装于免疫保护装置中,用于治疗1型糖尿病,且无需使用免疫抑制剂。
2024年12月,Vertex公布了其另一款产品VX-880(iPSC来源的胰岛细胞)在I/II期临床试验(NCT04786262)中的24个月随访数据:3名患者中有2人实现了胰岛素脱离,糖化血红蛋白(HbA1c)水平在不使用免疫抑制剂的情况下持续维持在7%以下(得益于该装置提供的免疫保护)。然而,iPSC来源胰岛细胞的持久性仍有限——其中1名患者在18个月后因装置逐渐发生纤维化而重新依赖胰岛素,这凸显了开发更优生物相容性材料的迫切需求。

VX-880在1型糖尿病受试者中的安全性、耐受性和有效性研究
04、肌肉骨骼系统疾病
肌肉骨骼系统疾病主要包括肌肉、韧带、关节和骨骼的损伤或病变,可由创伤、炎症或其他因素引起。干细胞在运动医学领域具有广阔的应用前景,可用于治疗韧带损伤、肌腱炎、软骨缺损、肌肉损伤、骨折及神经损伤等,能够加速愈合、减轻炎症与疼痛、促进组织再生并改善运动功能。
针对骨关节炎,Vega等人将30名患有慢性膝关节疼痛、保守治疗无效且影像学证实存在骨关节炎的患者分为两组:实验组接受关节腔内注射异体骨髓间充质干细胞,对照组则接受透明质酸注射。随访1年以评估其疼痛程度、功能障碍及生活质量。结果显示,治疗组的疼痛指数显著改善,软骨质量也明显提升。
2023年4月,士泽生物正式宣布启动其AlloJoin®(异体人源脂肪间充质祖细胞注射液)的III期临床试验。II期初步数据显示,AlloJoin®通过分泌抗炎细胞因子(如IL-4)和营养因子(如BMP-7),激活内源性软骨细胞修复机制(而非大量分化为软骨细胞),在膝骨关节炎治疗中展现出良好的安全性和有效性。
AlloJoin®是首个由中国自主研发、获得国家药监局药品审评中心(CDE)默示许可进入II期临床试验的创新干细胞药物,也是中国首个进入III期临床试验的膝骨关节炎干细胞药物。

异体脂肪间充质干细胞治疗膝骨关节炎
05、心血管疾病
心血管疾病种类繁多,包括心力衰竭、急性心肌梗死(MI)、心律失常等。干细胞具有修复受损心肌的潜力,并可分化为相关细胞类型,为心血管疾病的治疗提供了新思路。
2023年9月,Heartseed公司公布了其干细胞衍生疗法HS-001在两项晚期心力衰竭患者中的I/II期临床试验个案报告。报告显示,两名初始病情严重的患者在给药后26周均出现心脏逆向重构,心功能显著改善。数据显示,治疗26周后,患者的左心室舒张末期容积(LVEDV)减少,左心室射血分数(LVEF)显著提高,同时N末端B型利钠肽前体(NT-proBNP)水平显著下降。
2023年8月,国内艾尔普再生医学“人iPSC来源心肌细胞注射液(HiCM-188)经心外膜注射治疗重度慢性缺血性心力衰竭的临床研究”项目启动会在泰达国际心血管病医院举行。该研究为一项I/IIa期临床试验,旨在探索HiCM-188心肌内注射在重度慢性缺血性心力衰竭患者中的安全性与有效性。

此前,《美国心脏病学会杂志》(Journal of the American College of Cardiology)发表的一项研究指出,使用间充质祖细胞(MPCs)治疗慢性心力衰竭患者可在长期内改善预后,显著降低心肌梗死或卒中的发生率,且MPC疗法与现有心衰治疗手段具有协同增效作用。
06、抗衰老
在衰老过程中,人体内干细胞的数量和功能会逐渐下降,导致组织和器官功能逐步衰退。干细胞抗衰老的基本原理是向机体补充高活性的外源性成体干细胞,使其在体内发挥细胞更新、组织修复和免疫调节等作用,从而修复和再生衰老的组织与器官,恢复其年轻状态下的生理功能,最终实现抗衰老效果。
此外,新兴研究表明,干细胞可能对皮肤抗衰老具有潜在益处,其机制可能包括激活表皮细胞功能、恢复细胞正常生理活性,从而改善皮肤紧致度与弹性,实现面部年轻化。目前,干细胞药物在抗衰老领域的应用仍处于研究与探索阶段,尚需进一步的临床试验验证。不过,相关技术已在医疗美容领域得到初步应用。
干细胞产业市场分析
经过多年的发展,国内干细胞产业已形成较为完整的干细胞产业链。该产业链主要由上游的采集和储存、中游的技术研发和药物研发以及下游的治疗和应用组成。产业主要包括干细胞治疗服务业务、干细胞储存业务和干细胞制药业务。
其中,上游环节最为成熟,是干细胞医疗产业中最基础、最前沿的业务;中下游环节则有待进一步拓展,目前大多仍处于早期临床前或临床前阶段,市场仍处于发展初期,需要进一步开发。干细胞应用范围广泛,虽然产业链仍需逐步完善,但其市场前景较为广阔。
根据Precedence Research的数据,2023年全球干细胞治疗市场规模为148亿美元,预计2022年为112.2亿美元,到2030年将达到约314.1亿美元(图2A)。在2023年至2030年的预测期内,其复合年增长率将达到13.73%(图2B)。公开数据显示,我国干细胞医疗市场规模已从2012年的62亿元人民币增长到2019年的785亿元人民币,复合年增长率为32.59%,远高于全球平均水平(图2C)。
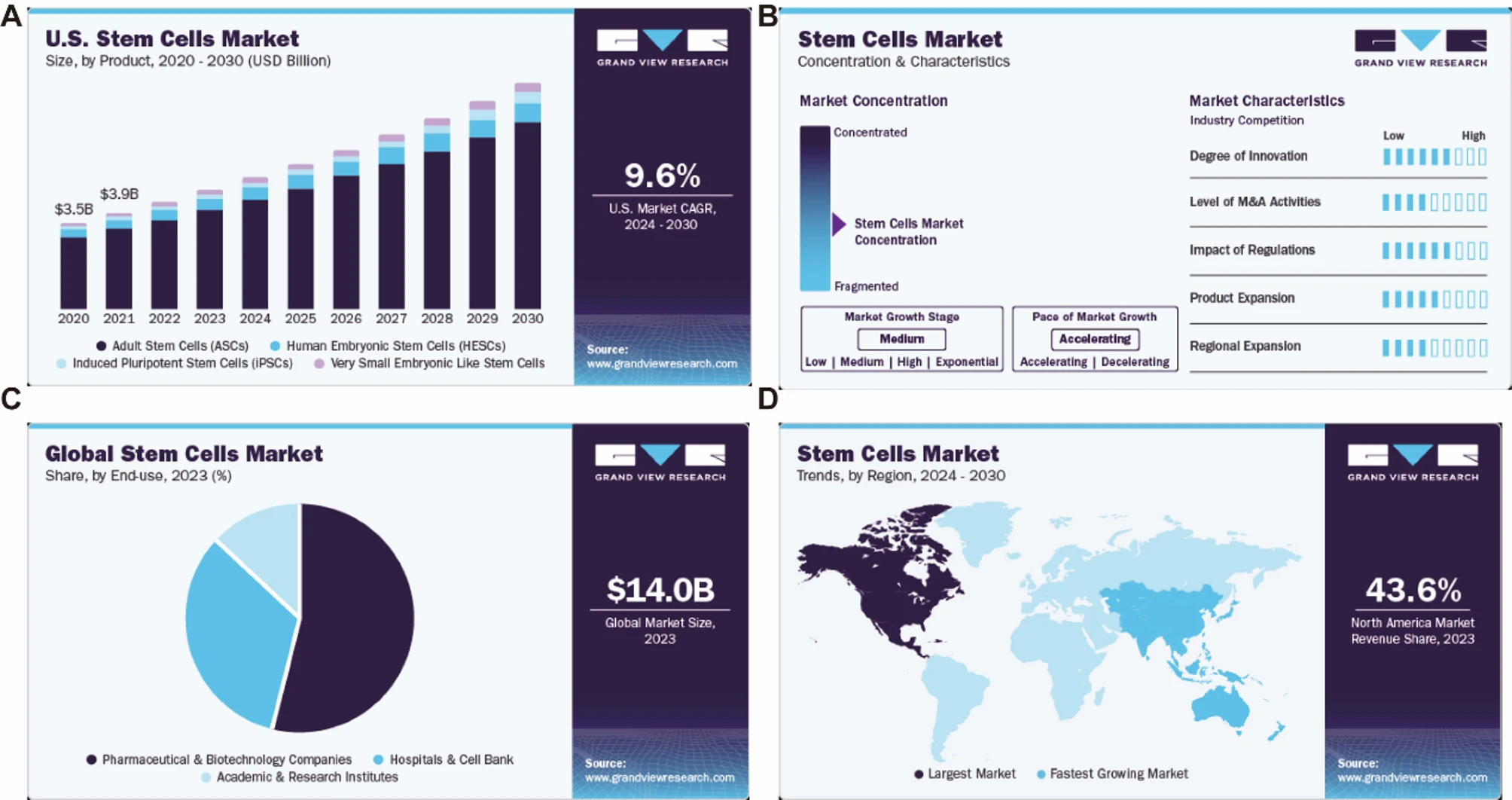
图2:干细胞产业市场分析:(A) 2023年全球干细胞市场规模为148亿美元,预计2024年至2030年将以11.43%的复合年增长率(CAGR)增长。(B) 市场增长阶段为温和型,但增长速度正在加快。(C) 2023年,制药和生物技术公司占据了最大的市场份额,达到53.76%。(D) 2023年,北美地区占据了最大的收入份额,达到43.56%。该地区创新者和主要市场参与者的存在,使得市场产品的渗透率更高。
根据市场研究,2023年中国干细胞市场销售收入达到140亿美元,预计到2030年将达到30.3亿美元,2022年至2030年复合年增长率(CAGR)为43.56%(图2D)。
干细胞产业链上中下游结构清晰,各环节特点与发展状况如下:
上游——采集与储存业务:这是产业链的基础环节,核心商业模式是采集脐带血、脐带、脂肪、牙髓等多种组织来源的干细胞(主要为间充质干细胞和造血干细胞),并提供长期储存服务。
目前全国有超过4万家企业参与,运营模式分为公共库与自体库。脐带血库与脐带间充质干细胞库已较为成熟,而牙髓、脂肪等储存业务处于上升期。此外,极少量胚胎样干细胞(VSELs)和诱导多能干细胞(iPSC)库被视为具有潜力的新兴方向(图3)。

图3:上游PSC处理的工作流程、典型活动和主要痛点
据报道,上市干细胞公司在细胞储存和制备业务的收入方面具有三大特点:相关业务收入占比逐年下降;该业务的毛利率常年保持在80%左右;以及区域领先效应较为明显。
中游——干细胞药物研发:中游企业主要包括从事干细胞制备、干细胞药物研发以及其他干细胞技术和产品研发的各类企业,也是整个产业链的核心。国内已有60多家企业部署了干细胞(包括诱导多能干细胞),并通过持续创新推动干细胞技术的发展。
在干细胞增殖方面,中游企业利用先进的细胞培养技术,确保干细胞在体外环境下保持良好的生长状态和增殖能力。这为后续的临床研究和下游应用提供了大量的细胞资源,也为干细胞药物的研发奠定了坚实的基础。
在干细胞药物的研发方面,中游企业不断探索其在疾病治疗中的潜在应用,并致力于将科研成果转化为临床应用。未来,随着干细胞技术的不断发展和成熟,中游企业在干细胞产业中的作用将日益凸显,为整个产业的发展注入更多动力和活力。
此外,随着诱导多能干细胞(iPSC)和干细胞来源外泌体的普及,一些基于iPSC和外泌体的创新型科技公司开始涌现,并带动了新一轮投资,它们纷纷进入这一新兴领域。除了药物研发之外,用于医疗美容的干细胞技术(例如,用于皮肤再生的干细胞来源外泌体、用于伤口修复的间充质干细胞条件培养基)也将成为未来干细胞发展的热点之一。
下游——临床应用与消费市场:此环节是价值实现端,干细胞产业链的下游环节包括医院和已拓展至下游消费领域的企业。目前,从事干细胞治疗的医院主要为军队医院,如北京302医院、海军总医院、武警总医院等。在消费应用领域,干细胞主要应用于医美和抗衰老保健。
因此,下游企业主要以干细胞保健为主,主要分布在北京、上海、广州、深圳等主要城市,以及博鳌、海南、秦皇岛、河北等具有试点政策优势的地区。下游市场的发展与政策环境紧密相关,预计随着监管政策的逐步明晰和开放,其规模将进一步扩大。
干细胞疗法临床转化的挑战与机遇
干细胞疗法的临床转化承载着治疗多种难治性疾病的希望,但其过程仍面临科学、技术及产业化等多重挑战。
- 科学挑战:主要包括致瘤性、异质性与免疫原性。通过优化重编程技术、完善分化纯化流程、利用基因编辑工具修饰风险基因,可提升安全性;建立“超级供体”干细胞库则有助于开发通用型产品,降低免疫排斥风险。
- 生产与质控挑战:规模化生产与质量控制是产业化的关键瓶颈。推动自动化、封闭式生产体系,结合动态培养与实时监测,有助于提升产品均一性与稳定性。严格的质量标准必须贯穿全程,确保细胞活性、纯度与功能符合要求。
尽管挑战众多,但每一项都对应明确的研发与产业化机遇。通过整合基因编辑、自动化制造、单细胞分析等创新平台,依托“超级供体”库优化免疫匹配,干细胞疗法正逐步突破瓶颈。随着全球监管体系完善与技术迭代加速,安全、高效、可及的干细胞治疗产品有望在未来成为常规医疗手段,深刻改变临床治疗格局。
结论
作为一种新兴的治疗技术,干细胞具有复杂性和特异性,其临床疗效仍需更多临床数据来验证。在监管方面,各国根据自身的研究基础和发展理念,探索并制定了相应的监管政策,且仍在不断完善中。
我们回顾了近年干细胞治疗的发展领域,涵盖抗衰老、整形修复、心血管疾病、自身免疫性疾病等多个医学领域,并涉及具体的临床应用和研究重点。干细胞治疗的潜力和应用价值已得到充分肯定和展望。
干细胞作为一种具有自我更新和多向分化潜能的细胞,为许多疑难杂症提供了新的治疗策略。随着研究的深入和技术的进步,我们有理由相信,干细胞治疗将在未来的医学领域发挥日益重要的作用。
参考资料:
[1] Li, F., Fu, C. 干细胞革命:弥合研究与临床应用之间的差距。 干细胞研究与治疗 16 , 661 (2025). https://doi.org/10.1186/s13287-025-04784-7 免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复