脐带、脂肪、骨髓间充质干细胞治疗1型糖尿病的优势、局限性与研究结果
1型糖尿病(T1D) 是一种慢性疾病,其特征是由于胰腺β细胞自身免疫性破坏导致胰岛素分泌不足或缺失。由于该疾病常见于儿童,但成人也可患上,因此曾被称为“青少年糖尿病”。据国际糖尿病联合会(International Diabetes Federation) 估计,到2045年,将有7亿成年人患上糖尿病。尽管糖尿病的确切病因尚不清楚,但据推测,遗传因素、环境因素以及接触某些病毒在1型糖尿病的发展中起着一定作用。
迄今为止,外源性胰岛素是1型糖尿病最常见的治疗方法,但它并不能治愈该疾病。胰岛细胞移植和胰腺移植是近年来越来越流行的两种治疗方法,但由于需要高剂量的免疫抑制剂、人类尸体胰岛的稀缺以及胰腺移植需要进行大规模手术,其临床应用可能受到限制。

干细胞因其能够分化成多种细胞类型以及具有再生潜能,成为治疗1型糖尿病的一种极具前景的新型疗法。根据其来源,干细胞可分为四大类,如图1所示。
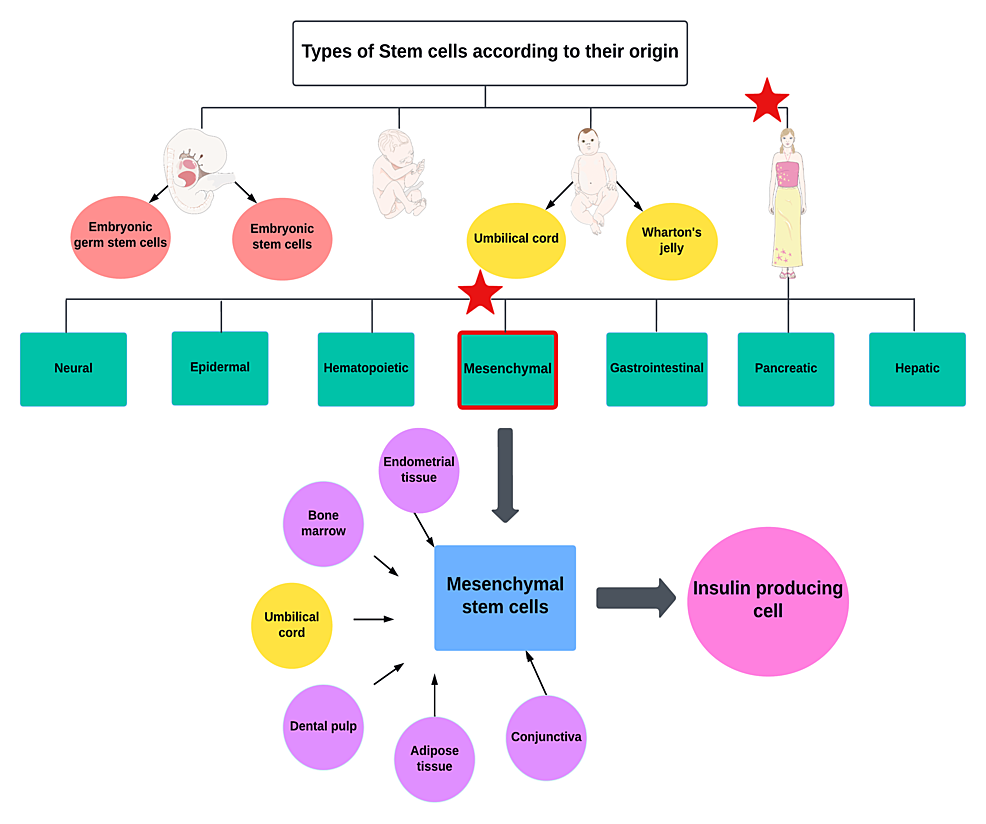
图1:根据来源对干细胞进行分类
间充质干细胞(MSCs),也称为间充质基质细胞,是非造血来源的多能干细胞。它们可以从多种组织来源提取,包括骨髓、肝脏、肾脏、脂肪组织、尿液、脐带血、脐带组织、华通氏胶、胎盘,甚至子宫内膜组织(月经血来源的子宫内膜干细胞- MenSC)。多种表面标志物,包括CD73、CD90和CD105,可用于鉴定MSCs。由于其能够分化成多种细胞类型,因此可用于修复受损组织。
MSCs因其能够调节纤维化和组织再生以及调节免疫功能,在1型糖尿病(T1D)的治疗中获得了广泛应用。此外,它们还产生多种分泌分子,例如细胞因子和外泌体,这些分子在1型糖尿病(T1D)的治疗中发挥着至关重要的作用。对接受间充质干细胞(MSCs)治疗的动物进行的研究表明,高血糖症显着降低,表现为血清葡萄糖水平下降以及胰岛素和C肽水平升高。此外,MSCs还能恢复正常的血脂水平。在糖尿病大鼠模型中,MSCs降低了肝肾功能标志物的血清水平,表明其对1型糖尿病具有肝肾保护作用。
人们已经发现多种机制在MSC治疗1型糖尿病中发挥作用(图2)。
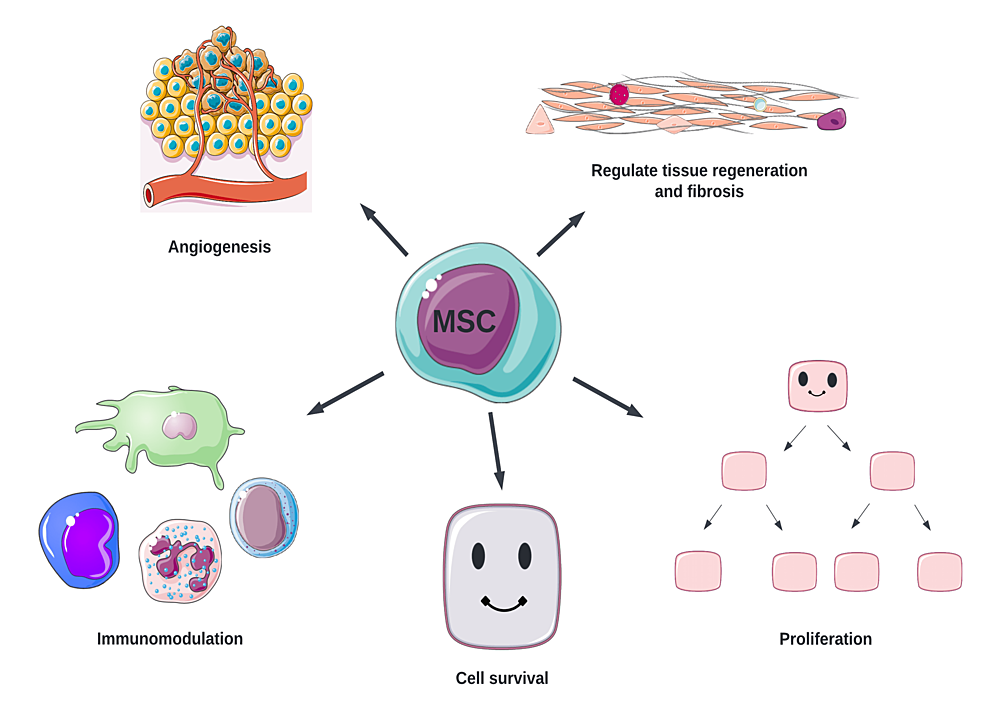
图2:间充质干细胞的作用机制
间充质干细胞治疗1型糖尿病是一种极具前景的新型治疗策略。这一领域的发现,通过改变细胞命运和构建更高级的细胞结构,推动了再生医学的快速发展。大量研究表明,间充质干细胞治疗1型糖尿病在降低患者空腹血糖、糖化血红蛋白水平,并改善C肽分泌方面发挥着关键作用,同时对于相关的微血管并发症也展现出治疗潜力。然而,间充质干细胞治疗1型糖尿病在临床转化中仍面临一些挑战,包括采集方法的侵入性、细胞增殖速度、其活性随供体年龄增长而下降,以及部分研究中观察到的潜在成瘤风险。因此,亟需开展大规模深入研究,以明确其作用机制,并确定最佳的治疗途径、剂量和时机,从而最大化患者的临床获益。本文将重点探讨脐带、脂肪与骨髓这三种不同来源的间充质干细胞治疗1型糖尿病中的应用,并系统比较其可行性及各自的优缺点[1]。
01、脐带组织来源的间充质干细胞的提取方法及治疗1型糖尿病的优势、局限性和研究结果
脐带组织来源间充质干细胞的提取方法
脐带组织来源的间充质干细胞主要存在于脐带的血管周围区域、皮下内皮以及华通氏胶中。
-
来源与产量:一段约20厘米长的人脐带,平均可以提取出约1×10⁶个UC-MSC,显示出较高的细胞产出效率。
-
核心提取部位:其中,从华通氏胶中分离MSCs是常见且成功的方法。由此获得的UC-MSCs展现出卓越的体外扩增能力,研究表明它们可经历超过80次群体倍增而依然保持活力,未出现衰老迹象或分化能力的明显改变。
-
收集伦理:所有脐带组织均在新生儿分娩后采集,该过程对母婴无任何伤害,且利用了本将被废弃的医疗组织,因此不存在伦理争议。
间充质干细胞治疗1型糖尿病的优势、局限性与研究结果
1. 核心优势
-
低免疫原性:UC-MSCs不表达或低表达主要组织相容性复合体II类分子及CD80、CD86等关键共刺激分子。这使得它们在异体移植时不易被受体免疫系统识别和攻击,因此在进行异种或同种异体移植时,可能无需使用强效的免疫抑制方案,大大降低了治疗的相关风险。
-
强大的增殖与分化潜能:如前所述,UC-MSCs能够在体外大量扩增,并具有被诱导分化为功能细胞的能力。研究已成功将其诱导为胰岛样细胞簇,这些细胞不仅表达胰岛素及Pdx1等β细胞关键基因,移植至糖尿病模型动物体内后,还能显着控制高血糖。
-
多重治疗机制:除了直接分化为胰岛素分泌细胞替换受损的β细胞外,UC-MSCs还能通过免疫调节功能保护患者体内残存的胰岛细胞(临床研究显示可改善新诊断患者餐后C肽水平),并有效治疗糖尿病慢性并发症(如改善动物模型的肾损伤、神经病变和血管性功能障碍)。
-
无伦理争议的来源:源于分娩废弃物的特性,使其成为易于获取且伦理友好的理想细胞来源。
2. 现有局限性
-
疗效的不稳定性:治疗效果可能呈现剂量依赖性,并且并非对所有患者均等有效。例如,临床研究观察到,在青少年发病的1型糖尿病患者中,UC-MSCs治疗未能显著提升C肽水平,暗示患者年龄与疾病阶段可能是影响疗效的关键变量。
-
治疗方案待优化:目前,关于UC-MSCs治疗的最佳细胞剂量、输注频率和治疗周期仍未形成共识,这是未来研究需要重点明确的方面。
-
长期安全性与机制需进一步验证:尽管初步研究显示了良好的安全性,但其长期效应和在人体内的精确作用机制仍需更多、更严谨的临床试验来证实。一些有潜力的联合疗法(如UC-MSCs与白藜芦醇联用),也尚处于动物研究阶段,距离临床转化还有距离。
3. 重要研究结果
-
动物模型:在糖尿病大鼠模型中,移植由人UC-MSCs分化而来的胰岛样细胞簇,实现了显著的高血糖控制。
-
人体临床:对新诊断的1型糖尿病患者重复静脉输注同种异体UC-MSCs后,观察到胰岛功能得到更好的保存,具体表现为餐后C肽水平的显著升高。
-
并发症治疗:临床前研究显示,UC-MSCs能有效改善糖尿病肾病模型的肾功能,并且在与白藜芦醇联合使用时展现出协同保护效应。此外,它们还能通过特定分子机制,帮助糖尿病模型小鼠恢复受损的勃起功能。
综上所述,脐带来源的间充质干细胞凭借其独特的生物学特性,为1型糖尿病及其并发症的治疗提供了充满希望的新策略。然而,要将这一潜力完全转化为成熟的临床疗法,仍需在剂量方案、人群选择和长期随访等方面开展更深入的研究工作。
02、脂肪组织来源的间充质干细胞的提取方法及治疗1型糖尿病的优势、局限性和研究结果
脂肪组织来源间充质干细胞的提取方法
脂肪组织来源的间充质干细胞主要从皮下白色脂肪组织中提取,因其易于获取且采集过程创伤较小,被认为是最具临床意义的来源。
-
提取技术:通常通过脂肪抽吸术获取脂肪样本。虽然该技术不会损害ADSCs的功能,但其涉及的真空过程可能会对成熟的脂肪细胞造成损伤。
-
目标细胞群:所需的干细胞存在于脂肪组织的基质血管成分中,提取后被称为“处理后的脂肪抽吸物”。这些细胞是成纤维细胞样的干细胞,具备在体外分化为脂肪细胞、肌细胞、软骨细胞和成骨细胞等多系细胞的能力。
间充质干细胞治疗1型糖尿病的优势、局限性与研究结果
1. 核心优势
-
来源丰富与获取便捷:与骨髓采集相比,脂肪抽吸术相对无痛,且能从少量组织中获得极高的细胞产量,解决了细胞来源的瓶颈问题。
-
无伦理问题与低致瘤风险:使用ADSCs有效避免了胚胎干细胞所面临的伦理争议,并且与诱导多能干细胞相比,其致瘤风险显著更低。
-
低免疫原性:ADSCs不表达HLA-DR,这一特性使其在进行异体移植时可能无需使用强效的免疫抑制剂,这为1型糖尿病这种自身免疫性疾病的治疗提供了巨大便利。
-
多向分化潜能:研究已证实,ADSCs能够被有效诱导分化为胰岛素分泌细胞,为替代被破坏的胰岛β细胞提供了可能。
2. 现有局限性
-
无法完全摆脱外源性胰岛素:目前的研究表明,移植ADSCs或其分化的胰岛素分泌细胞后,尚无法实现1型糖尿病的彻底治愈,患者通常仍需依赖外源性胰岛素。
-
细胞数量与功能瓶颈:要实现血糖的长期稳定,可能需要更大剂量的功能性胰岛素分泌细胞。因此,如何提高ADSCs分化为IPC的效率,以及如何提升所获细胞的胰岛素分泌能力,是当前研究的重点和难点。
-
技术工艺待优化:从脂肪抽吸到细胞诱导分化的整个流程,仍需进一步标准化和优化,以确保治疗的可重复性与有效性。
3. 重要研究结果
-
临床研究证据:一项2015年的前瞻性临床研究显示,20名1型糖尿病患者在接受自体ADSCs移植后,血糖控制得到改善(表现为糖化血红蛋白、空腹及餐后血糖水平下降),并且C肽水平持续升高,表明其自身胰岛功能有所恢复。研究报道ADSCs与维生素D联合使用,无需免疫抑制即安全有效,可能在诊断初期起到保护β细胞的功能。
-
动物模型证据:在非肥胖糖尿病小鼠模型中,全身性注射ADSCs被证明可以保护胰腺β细胞免受免疫攻击,维持胰岛素含量,延缓糖尿病的发生。移植由ADSCs分化而来的胰岛祖细胞簇后,仅两个月即可观察到胰岛功能和形态的显著改善。
-
并发症治疗:研究表明,ADSCs疗法还能有效减轻糖尿病肾病等慢性并发症,其作用机制与核因子κB通路失活和VEGF-A下调等有关。
综上所述,脂肪组织来源的间充质干细胞因其获取方便、安全性高和具有多重治疗潜力,成为1型糖尿病细胞治疗中一个非常有前景的方向。然而,要将其广泛应用于临床,仍需在细胞剂量、功能优化和长期疗效验证等方面取得进一步突破。
03、骨髓间充质干细胞的提取方法及治疗1型糖尿病的优势、局限性和研究结果
骨髓组织来源间充质干细胞的提取方法
骨髓间充质干细胞源自骨髓,通常通过骨髓穿刺术从髂骨等部位抽取骨髓液获取。作为最早被研究和应用的间充质干细胞,BM-MSCs是骨髓中除造血干细胞外的一类重要成体干细胞。
骨髓间充质干细胞治疗1型糖尿病的优势、局限性与研究结果
1. 核心优势
-
明确的免疫调节与诱导免疫耐受能力:这是BM-MSCs治疗1型糖尿病最核心的优势之一。研究表明,它们不仅能调节异常的T细胞和B细胞功能,更能诱导对自身抗原的免疫耐受,从而从根源上阻止胰岛β细胞的自身免疫性破坏。
-
强大的多向分化潜能:BM-MSCs已被证实能够在体内外分化为有功能性的胰岛素分泌细胞,直接替代被破坏的β细胞。
-
低免疫原性与自体移植可行性:BM-MSCs同样具有低免疫原性。更重要的是,可以进行自体移植(使用患者自身的细胞),这能完全避免免疫排斥反应,安全性高。
-
改善糖尿病并发症:研究证实,BM-MSCs对多种糖尿病并发症(如糖尿病肾病、糖尿病相关的肝损伤、伤口愈合不良及勃起功能障碍)也具有治疗潜力,展现了其多重获益的可能。
2. 现有局限性
-
采集过程具有侵入性:与脂肪或脐带来源相比,骨髓穿刺是一种有创操作,会给供者带来更多不适和创伤。
-
异体移植存在排斥风险:虽然BM-MSCs免疫原性低,但异体移植(使用他人捐献的细胞)仍存在引发免疫排斥反应的风险。
-
细胞数量与活性随年龄下降:BM-MSCs的数量和增殖分化能力会随着供者年龄的增长而显著下降,这可能影响其对老年患者的治疗效果。
-
治疗时机要求高:研究强调,在确诊1型糖尿病后尽早进行干细胞输注至关重要,晚期患者因胰岛功能丧失严重,治疗效果可能有限。
3. 重要研究结果
-
临床研究证据:一项针对伴有糖尿病酮症酸中毒的1型糖尿病患者的研究发现,BM-MSCs输注能够保护患者的β细胞功能。其中一名患者甚至在移植后3个月内实现了不依赖胰岛素治疗。一项I期临床试验表明,通过阴茎海绵体内注射自体BM-MSCs治疗糖尿病性勃起功能障碍,被证明是安全且有效的。
-
动物模型证据:在非肥胖糖尿病小鼠模型中,BM-MSCs移植被证实可以预防胰岛破坏并恢复免疫平衡。在糖尿病大鼠中,BM-MSCs治疗能改善血脂代谢和肝功能,并促进角膜上皮伤口的愈合。
-
创新疗法探索:研究人员正在探索将BM-MSCs作为“载体”进行自杀基因疗法,旨在精准清除导致自身免疫的异常免疫细胞,为根治1型糖尿病提供了全新思路。
综上所述,骨髓来源的间充质干细胞凭借其坚实的科研基础、强大的免疫调节功能以及多器官保护潜力,在1型糖尿病治疗领域占据重要地位。其自体移植的路径尤为安全可行,但采集过程的侵入性和对治疗时机的严苛要求是其临床应用需考虑的关键因素。
表1 比较了源自骨髓、脐带和脂肪组织的 MSC 的特性。
| 特性 | 脐血间充质干细胞 | 骨髓间充质干细胞 | 脂肪干细胞 |
| 增殖率 | 中等的 | 高于 ADSCs | 低于骨髓间充质干细胞 |
| 组织处理和细胞培养 | 简单的 | 简单的 | 简单的 |
| 收获技术 | 非侵入性 | 侵入性 | 侵入性 |
| 供体年龄对细胞的影响 | 不受影响 | 随着年龄增长而衰退 | 随着年龄增长而衰退 |
| 细胞排斥 | 看不见 | 看不见 | 看不见 |
| 肿瘤形成风险 | 低的 | 低的 | 低的 |
| 抗炎特性 | 好的 | 好的 | 好的 |
| 胚胎标志物的表达 | 高层 | 低的 | 低的 |
子宫内膜、牙髓和结膜组织来源的间充质干细胞
近期研究表明,月经血来源的子宫内膜干细胞(MenSCs)因其极高的增殖能力、无创的采集方法以及显著的免疫调节活性,在1型糖尿病(T1D)的治疗中具有潜在的应用价值。在T1D小鼠模型中,MenSCs和脐带间充质干细胞(UC-MSC)移植可显著降低血糖和胰岛素水平,并改善肝脏、肾脏和脾脏的形态和功能。
2021年的一项研究发现,MenSCs表达胰岛β细胞基因,如胰岛素(INSULIN)、葡萄糖转运蛋白2(GLUT-2)和神经氨酸酶3 (NGN-3),并具有更强的分化为胰腺细胞的能力。
牙髓间充质干细胞(DP-MSCs)是目前提出的用于治疗1型糖尿病的独特间充质干细胞之一。DP-MSCs来源于脱落的人类乳牙,具有易于获取且对供体损伤小的优点。Mo等人的研究表明,DP-MSCs具有分化为胰岛β细胞的能力;然而,在开展更大规模的研究以确立该方法之前,有必要设计出体内最佳β细胞分化的方案。
一项体内研究表明,在最佳诱导条件下,结膜间充质干细胞(C-MSCs)在二维培养和三维支架中均能有效分化为胰岛干细胞。C-MSCs具有很强的增殖能力、梭形细胞形态和较高的克隆形成分化潜能,且来源广泛。然而,在将C-MSCs作为1型糖尿病(T1D)的成熟疗法之前,仍需开展更大规模的体外研究。
表2列出了所有利用MSC治疗1型糖尿病及其并发症的临床试验(表2)。
| 作者 | 研究类型 | 样本量 | 纳入标准 | 研究结果 | 不良反应 | 研究缺点 |
| Izadi 等人[24] | 一项三盲平行随机安慰剂对照试验 | 21 | 空腹C肽水平≥0.3 nmol/L,存在至少一种针对胰岛β细胞的自身抗体(ICA、GAD或IA-2A) | 低血糖发作次数和 HbA1c 水平显著降低,IL-4、IL-10 和 TGF-β1 增加,TNF-α、IL-6 和其他促炎细胞因子减少。 | 注射部位轻微反应、荨麻疹和淋巴细胞轻度增多。 | 符合既定入选标准的患者人数有限,导致招募过程比预期更长。患者的个体差异,例如生活方式、社会经济地位、压力水平、运动和饮食等,均未纳入考虑。所有参与者均在确诊1型糖尿病的早期阶段入组。 |
| Cai 等人[25]。 | 一项试点随机对照开放标签临床研究 | 42 | 年龄 18~40 岁,1 型糖尿病病史 ≥2 年且 ≤16 年,糖化血红蛋白 (HbA1c) ≥7.5% (58 mmol/mol) 且 ≤10.5% (91 mmol/mol),空腹血清 C 肽 <0.1 pmol/mL,每日胰岛素需求量 <100 IU | C肽曲线下面积和胰岛素曲线下面积增加,HbA1c、空腹血糖和每日胰岛素需求量减少。 | 严重低血糖事件、短暂性腹痛和上呼吸道感染。 | 样本量相对较小,随访时间较短。未分别评估每种细胞产物的独立贡献。未实现胰岛素非依赖性。缺乏安慰剂可能导致生活质量测量结果出现偏差,这需要在未来的大规模研究中加以验证。 |
| Lu 等人[30]。 | 一项非随机、开放标签、平行组前瞻性研究 | 52 | 年龄 8 至 55 岁(自确诊 1 型糖尿病以来需要胰岛素治疗),且空腹 C 肽水平 ≥ 100 pmol/L | 40.7% 的患者空腹和/或餐后 C 肽水平较基线升高 10%。3 名受试者实现了胰岛素非依赖,并在 3 至 12 个月内保持无胰岛素状态。成人起病的 1 型糖尿病患者的餐后 C 肽百分比变化显著增加。青少年起病的 1 型糖尿病患者的空腹或餐后 C 肽变化无统计学意义。 | 轻微发烧 | 两组受试者基线胰岛素需求量的差异提示可能存在与非随机设计相关的选择偏倚。由于实验周期过长,数据收集过程中可能引入了混杂变量。 |
| Thakkar 等人[44]。 | 一项前瞻性、开放标签、双臂临床试验。 | 20 | 1型糖尿病病程超过12个月,存在谷氨酸脱羧酶抗体,年龄在8至45岁之间,C肽水平低 | HbA1c、C肽、平均空腹血糖和餐后血糖持续改善。GAD抗体和胰岛素需求量降低。 | 未报道 | 未能实现胰岛素非依赖性。 |
| Dantas 等人[45]。 | 一项前瞻性、双中心、开放标签试验 | 17 | 美国糖尿病协会标准:< 4 个月,年龄 16 至 35 岁,GAD 抗体阳性。 | 六个月后基础C肽水平升高。C肽水平及其曲线下面积在六个月内保持稳定。 | 短暂性头痛、轻微局部输液反应、心动过速、腹部痉挛、局部血栓性静脉炎、输液期间短暂性轻微飞蚊症和中心视网膜静脉阻塞(完全缓解)。 | 该研究仅纳入了有限数量的患者。因此,无法确定ADSC对胰腺功能的有益作用是由于免疫调节还是继发于其向β细胞的分化。这是一项开放性研究,大多数参与者仅同意加入干预组。 |
| Al Demour 等人[61]。 | 一项前瞻性 1 期试点研究,开放标签,单臂单中心研究。 | 4 | 纳入25至65岁成年男性患者,患有1型或2型糖尿病,糖尿病病史≥5年,糖化血红蛋白(HbA1c)≤10%,慢性勃起功能障碍病史至少6个月,体重指数在20至30之间,且基线国际勃起功能指数(IIEF-15)评分<26。仅纳入对既往药物治疗(如PDE5抑制剂和前列腺素E1)无效的患者。 | 国际勃起功能指数-15、勃起硬度评分、性欲、性交满意度和总体满意度均有显著改善。 | 没有任何 | 由于这种新疗法的社会接受度较低,因此该研究纳入的患者数量有限。 |
| Carlsson 等人[66]。 | 开放式单中心随机试点研究 | 20 | 年龄 18-40 岁,新发 1 型糖尿病。 | 对照组在第一年内 C 肽峰值和 C 肽曲线下面积均出现下降。 | 病毒性上呼吸道感染、显微镜下结肠炎和霍顿头痛 | 对照组中女性人数多于男性。然而,在更大规模的研究中,并未发现性别对C肽消耗有影响。 |
| Araujo 等人[67]。 | 一项前瞻性、单中心、开放标签试验 | 13 | 美国糖尿病协会标准:< 4 个月,年龄在 16 至 35 岁之间,且存在 GAD 抗体。 | 观察到血糖控制改善和胰岛素需求量降低。基础C肽水平和年龄均与HbA1c降低无关。HbA1c水平有所改善,CD8+FoxP3+ T细胞频率升高。 | 短暂性头痛、轻微局部输液反应、心动过速、腹部痉挛、局部浅表性血栓性静脉炎、输液期间短暂性轻微飞蚊症以及中心性视网膜静脉阻塞 | 该研究样本量较小。与干预组相比,对照组的基线C肽水平较低。研究中没有单独使用维生素D和胰岛素治疗的组,因此无法确定阳性结果是否与异体脂肪干细胞、维生素D或两者均相关。需要更长时间的随访来确定该干预措施的长期安全性和有效性。该研究仅纳入了空腹C肽≥0.3ng/mL的1型糖尿病患者。 |
| 胡等人[68]。 | 一项双盲研究,按随机区组分为两组。 | 29 | 年龄不超过 25 岁,根据美国糖尿病协会标准进行 1 型糖尿病的临床和实验室诊断,1 型糖尿病病程不超过 6 个月,空腹 C 肽 ≥ 0.3 ng/mL。 | HbA1c和C肽水平显著改善。 | 没有任何 | 该研究纳入的患者数量有限。研究仅纳入了空腹C肽≥0.3ng/mL的1型糖尿病患者。 |
| Dave 等人[69]。 | 前瞻性非随机开放标签临床试验 | 10 | 年龄 8 至 45 岁,确诊患有 TID 至少 6 个月,且 C 肽水平低。 | 平均糖化血红蛋白(HbA1c)水平有所改善。平均血清C肽水平升高,同时外源性胰岛素需求量下降。平均谷氨酸脱羧酶(GAD)抗体水平降低。 | 没有任何 | 尚未解决的问题包括免疫排斥对 IPC 的影响、达到完全治疗所需的细胞剂量、移植技术或是否需要更有效的细胞,如调节性 T 细胞。 |
结论
间充质干细胞(MSCs)被认为可通过多种机制在1型糖尿病(T1D)及其他多种疾病中发挥作用,其中包括归巢和免疫调节。我们的综述表明,MSCs不仅能有效降低空腹血糖、C肽和糖化血红蛋白A1c水平,还能治疗与T1D相关的微血管并发症。然而,T1D的具体病理生理机制仍不清楚,这使得开发新的治疗方法变得困难。为了实现T1D的缓解,我们还必须考虑其他因素对MSCs疗效的影响,包括患者个体因素,例如年龄、体重指数、生活方式、社会经济地位、活动水平、饮食、自身免疫状态和药物相互作用,以及外部因素,例如储存条件、接种密度和培养基。因此,迫切需要开展更大规模的研究。
参考文献:[1] Jayasinghe M, Prathiraja O, Perera PB 等。(2022 年 7 月 27 日) 间充质干细胞在 1 型糖尿病治疗中的作用 Cureus 14(7): e27337。doi:10.7759/cureus.27337
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复