神经创伤性疾病,例如脊髓损伤、脑损伤,以及神经退行性疾病,例如肌萎缩侧索硬化症,因其复杂性和治疗的细微差别,对康复领域构成了挑战。几十年来,人们一直在探索细胞疗法在神经康复疾病治疗中的应用,以补充目前的主要治疗方案;然而,医学界尚未就细胞疗法的标准化及其疗效达成共识。
最新综述:比较干细胞治疗神经创伤和神经退行性疾病的临床疗效报道
近日,知名期刊杂志《Tissue Engineering and Regenerative Medicine》发表了一篇有关“干细胞治疗神经创伤和神经退行性疾病的临床疗效:比较综述”的文献综述[1]。

该综述探讨了PubMed数据库中关于细胞疗法治疗神经创伤和神经退行性疾病的现有文献,旨在阐明哪些细胞类型对脊髓损伤、创伤性脑损伤和肌萎缩侧索硬化症的治疗有效。
最终结合近十年的研究表明,骨髓干细胞和神经干细胞可有效治疗神经创伤性疾病,而间充质干细胞和神经干细胞可有效治疗神经退行性疾病(例如肌萎缩侧索硬化症)。
方法:我们从PubMed数据库中检索了2014年至2024年发表的研究,检索词包括但不限于“脊髓损伤”、“脑损伤”、“肌萎缩侧索硬化症”、“再生医学”、“细胞疗法”和“干细胞”。根据PRISMA 2020声明,对研究进行了筛选、纳入和排除。最终确定并选定了33项研究用于本综述(图1)。
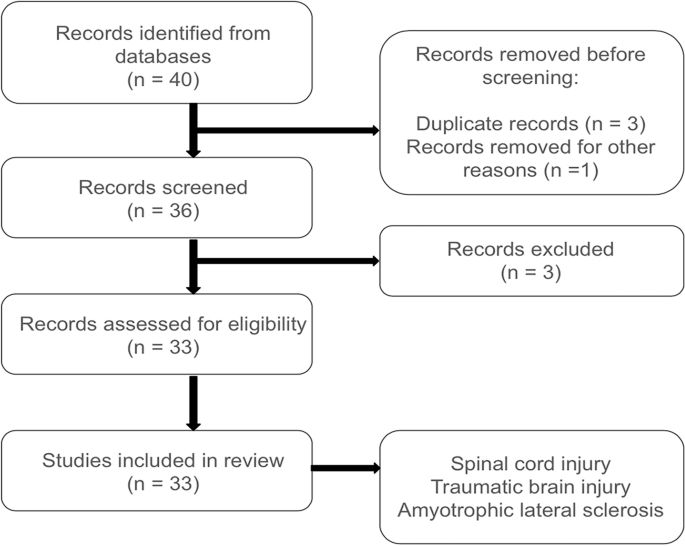
图1:研究流程
干细胞治疗神经创伤和神经退行性疾病的临床疗效的结果
干细胞治疗脊髓损伤
目前利用细胞疗法治疗难治性脊髓损伤的研究已有数十篇(表1),在颈椎、胸椎、腰椎脊髓损伤的病例中,应用自体间充质干细胞(骨髓来源细胞、脂肪来源细胞)、同种异体间充质干细胞、神经干细胞、华通胶来源细胞、少突胶质细胞祖细胞等。
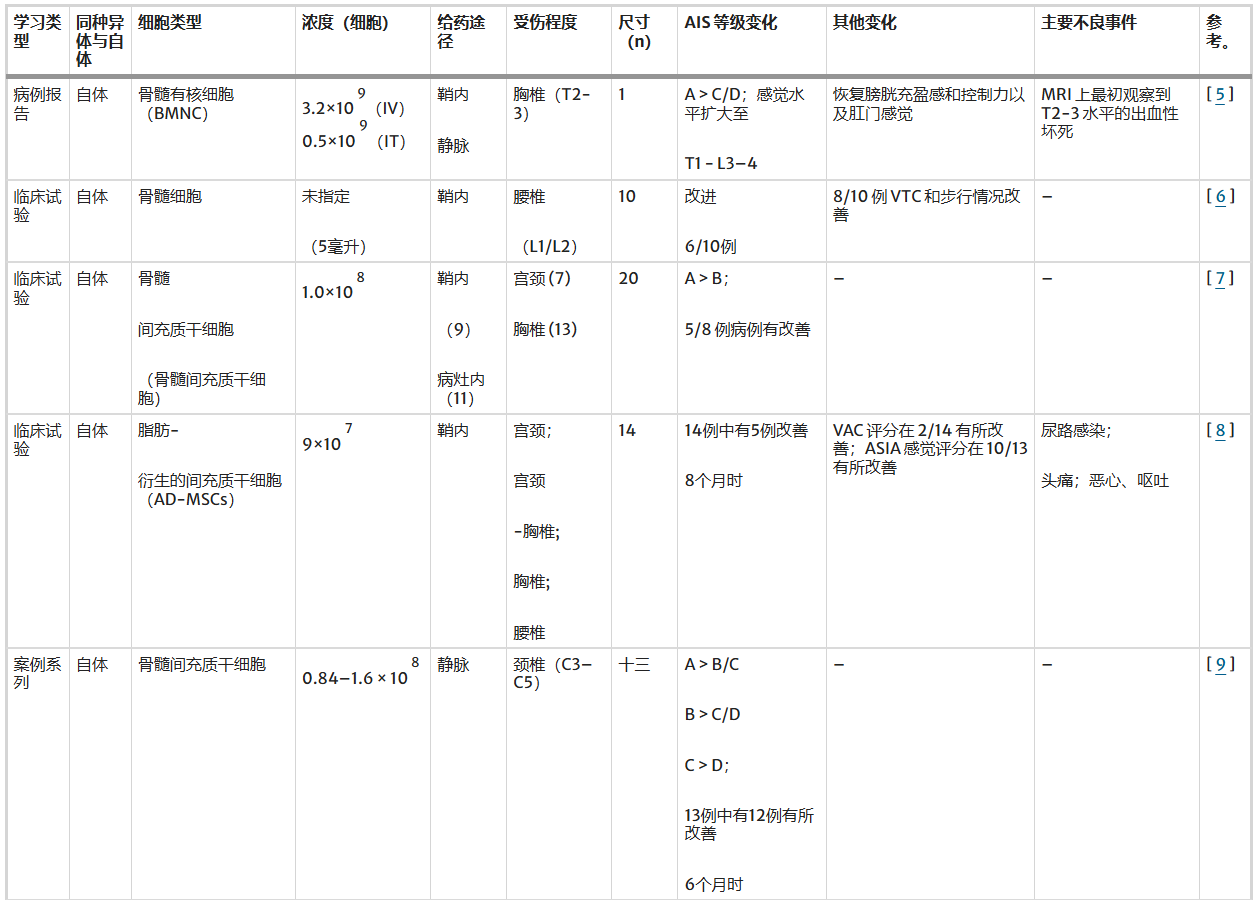
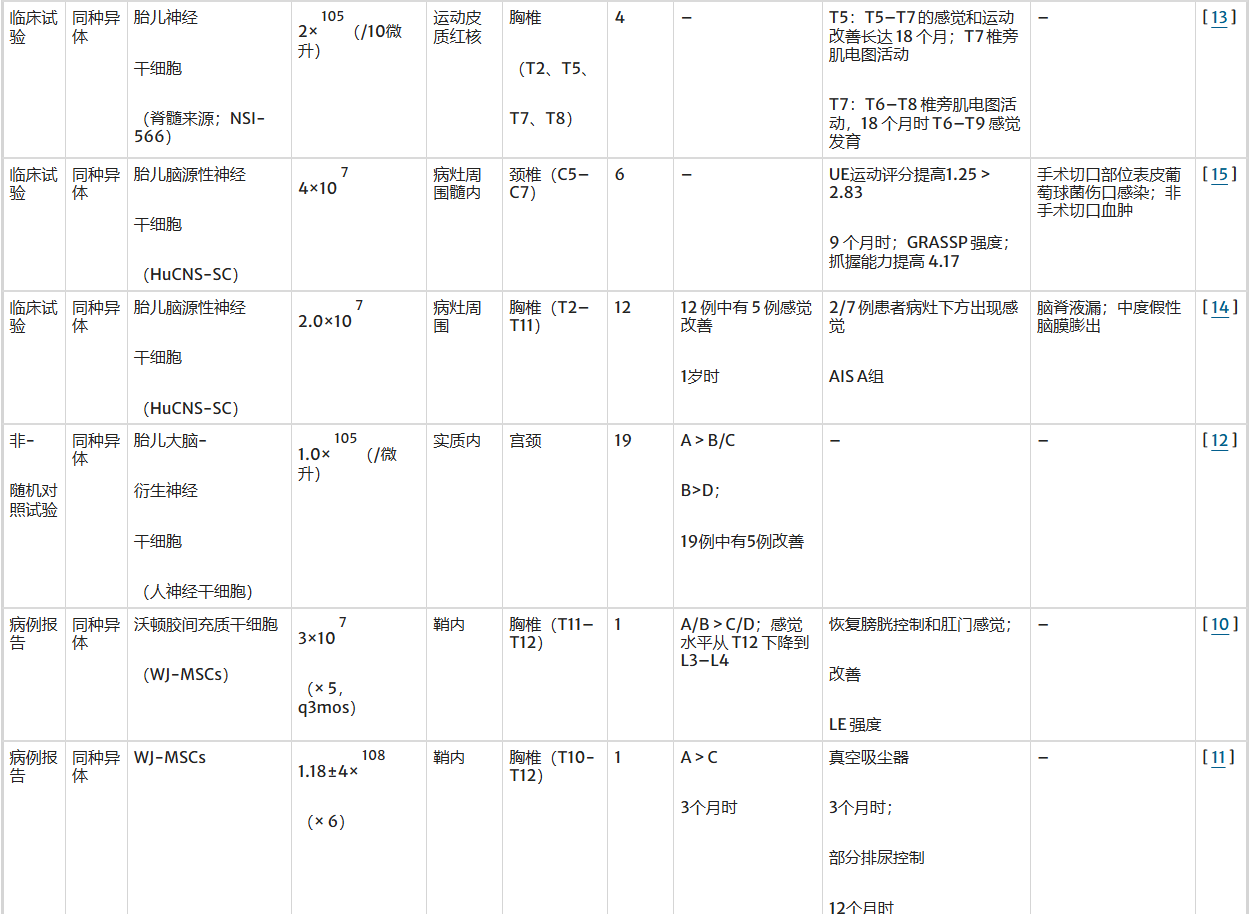
表1:干细胞类型及其在脊髓损伤治疗中的不同疗效
自体间充质干细胞治疗脊髓损伤
自体骨髓来源细胞在胸腰段脊髓损伤(SCI)患者中的治疗潜力已得到初步证实。
早期病例与小规模研究的结果:最早在2015年,Jarocha等人通过自体骨髓有核细胞(BMNCs)治疗胸段SCI患者,结果显示AIS分级从A提升至C/D,并伴随感觉水平及膀胱、肛门功能的恢复。随后Bansal等人在10例腰段SCI患者中应用自体骨髓干细胞,其中多数患者在运动、排尿及性功能方面均有不同程度改善,且未出现严重不良事件。
中期临床试验与脂肪来源MSC的应用:2024年Awidi等人开展的随机临床试验进一步验证了骨髓来源MSC的疗效,结果显示颈段和胸段SCI患者普遍出现AIS分级提升,且安全性良好。与此同时,Hur等人使用自体脂肪来源MSC治疗不同水平的SCI,随访8个月时约三分之一患者AIS分级改善,部分患者肛门收缩及感觉功能也得到恢复,但报告了轻度不良反应。
最新研究与总体结论:Honmou等人针对颈段SCI患者的研究显示,绝大多数患者在6个月内AIS分级改善,甚至有部分患者提升2个分级。综合不同研究结果,自体间充质干细胞(包括骨髓与脂肪来源)在鞘内、静脉及脊髓内多种给药途径下均展现出一定疗效,尤其是在运动、感觉及部分自主功能恢复方面,为SCI患者提供了新的治疗希望。
异体间充质干细胞治疗脊髓损伤
异体沃顿胶来源MSCs(WJ-MSCs)为细胞来源提供了新思路。病例报告显示,通过腰椎穿刺或鞘内注射异体WJ-MSCs,胸段SCI患者在感觉、膀胱、肛门功能及下肢肌力方面均获得显著改善,且疗效在长达18-25个月的随访中保持稳定,未出现严重并发症,提示了其作为“现货型”异体干细胞产品的安全性与价值。
神经干细胞(NSCs)治疗脊髓损伤
神经干细胞(NSCs)在治疗颈椎、胸椎和腰椎各主要水平的慢性脊髓损伤(SCI)中均显示出一定疗效,近十年已有四项临床试验证实这一点。
颈髓损伤治疗案例:Shin团队针对19例慢性颈髓损伤患者(多为完全性损伤),采用胎脑来源神经干/祖细胞(hNSPCs)进行髓内注射。治疗后26.3%的患者出现AIS分级显著改善(如从A级升至C级),且一年随访未发现肿瘤形成、神经功能恶化或疼痛加重等严重不良反应,证明了颈段治疗的安全性及功能恢复潜力。
胸髓损伤治疗案例:2018年,Curtis等人对4例胸段脊髓损伤患者(T2-T8节段)注射脊髓来源的NSI-566细胞。尽管国际神经功能标准评分(ISNCSCI)未全部改善,但肌电图检测到T7患者腹直肌与胸椎旁肌出现新自主活动,T5和T8患者出现感觉运动节段性恢复,且无注射相关并发症,表明胸段治疗可促进神经再支配。
颈髓损伤多维度评估案例:Levi团队通过随机对照试验,对6例四肢瘫患者移植胎脑来源HuCNS-SC细胞。采用特异性上肢功能评分(UEMS/GRASSP)发现患者抓握力和运动功能显著提升(如UEMS评分从1.25升至2.83),但研究也报告了切口感染与血肿等手术相关风险,提示需平衡疗效与侵入性操作带来的潜在并发症。
尽管多项研究结果令人鼓舞,表明NSCs在不同水平SCI的治疗中具有潜在价值,但理想的剂量与给药方式仍未统一。此外,虽然多数研究采用AIS分级作为疗效评估指标,但部分研究使用ISNCSCI、UEMS或GRASSP等其他量表,导致不同研究之间的疗效难以直接比较。
少突胶质细胞前体细胞治疗脊髓损伤
由人胚胎干细胞衍生的OPCs(如LCTOPC1)为治疗提供了新方向。一项开放标签、剂量递增的临床试验显示,在接受鞘内注射的25例颈髓损伤患者中,绝大多数(21/22)在身体至少一侧恢复了一个或更多水平的神经功能,展现了其促进神经修复的潜力,但需关注脑脊液漏和感染等手术相关风险。
干细胞治疗创伤性脑损伤
有研究表明,创伤性脑损伤也可以通过细胞疗法治疗,使用WJ-MSC、骨髓单核细胞和基因改造的MSC(表2)。
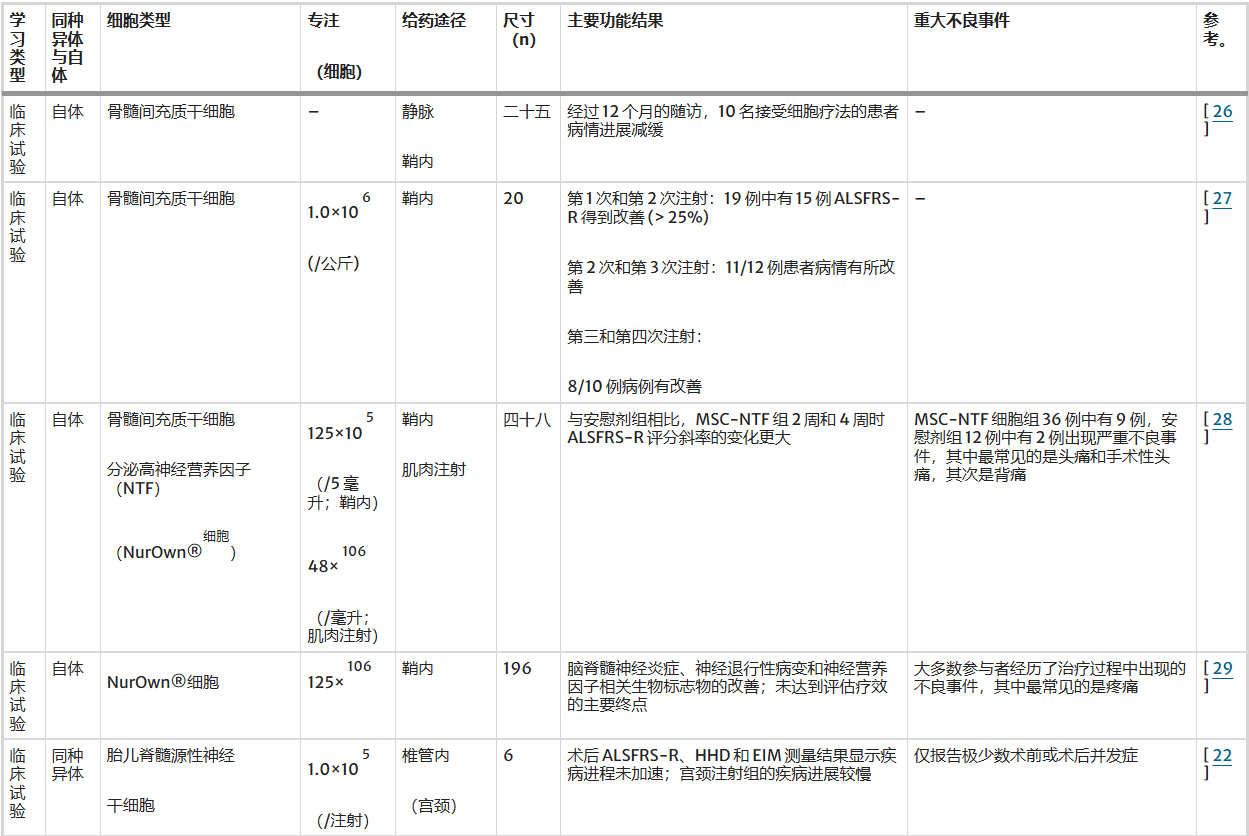
表2:创伤性脑损伤治疗中的不同细胞类型
脐带沃顿胶来源间充质干细胞(WJ-MSCs)治疗创伤性脑损伤
在脊髓损伤治疗中已显示出疗效的WJ-MSCs,自2020年起也开始被探索用于创伤性脑损伤(TBI)的治疗。Kabatas等人首次报道了一例 TBI患者,该患者表现为四肢瘫痪、严重肌痉挛、不能说话及括约肌失控。研究中,患者共接受6次给药,途径包括鞘内、肌肉内及静脉注射,每次注射剂量为1×10⁶WJ-MSCs。
在12个月随访时,患者的功能独立性评估(FIM)评分从22/126提升至76/126,改良Ashworth痉挛量表(MAS)从44降至16。未报告相关不良事件。
四年后,研究团队开展了一项包含6名患者的临床试验,采用了类似的治疗方案,即通过鞘内、肌肉内及静脉注射1×10⁶WJ-MSCs。所有参与者在随访中均显示出认知能力、运动技能(FIM评分)、肌痉挛程度(MAS)、肌力及Karnofsky评分的改善。部分患者出现早期短暂的不良反应,如低热、轻度头痛以及因肌内注射引起的肌肉疼痛。
骨髓单个核细胞(BMMNCs)治疗创伤性脑损伤
BMMNCs的治疗潜力主要体现在神经保护和抗炎机制上。在2017年的I/IIa期临床试验发现,静脉输注BMMNCs后,治疗组患者的幕上脑体积得以保持,并观察到剂量依赖性的炎性因子(如TNF-α)抑制,提示其通过调节炎症微环境发挥疗效。
基因修饰的异体骨髓间充质干细胞(BM-MSCs)治疗创伤性脑损伤
基因工程改造为增强干细胞疗效提供了策略。一项II期临床试验采用经Notch-1转染的异体BM-MSCs(SB-623),通过立体定向手术进行颅内注射。结果显示,治疗组患者在运动功能(FMMS评分)和日常生活能力方面获得持续改善,且治疗安全性良好,代表了细胞疗法精准化、高效化的发展方向。
干细胞治疗肌萎缩侧索硬化症
肌萎缩侧索硬化症 (ALS) 的常规治疗可以辅以细胞疗法(表3)。胎儿脊髓来源的神经干细胞、神经干细胞来源的运动神经元、胎儿人类神经干细胞、BM-MSC、WJ-MSC以及过表达GDNF的人类胎儿神经祖细胞在治疗ALS方面已显示出乐观的效果。

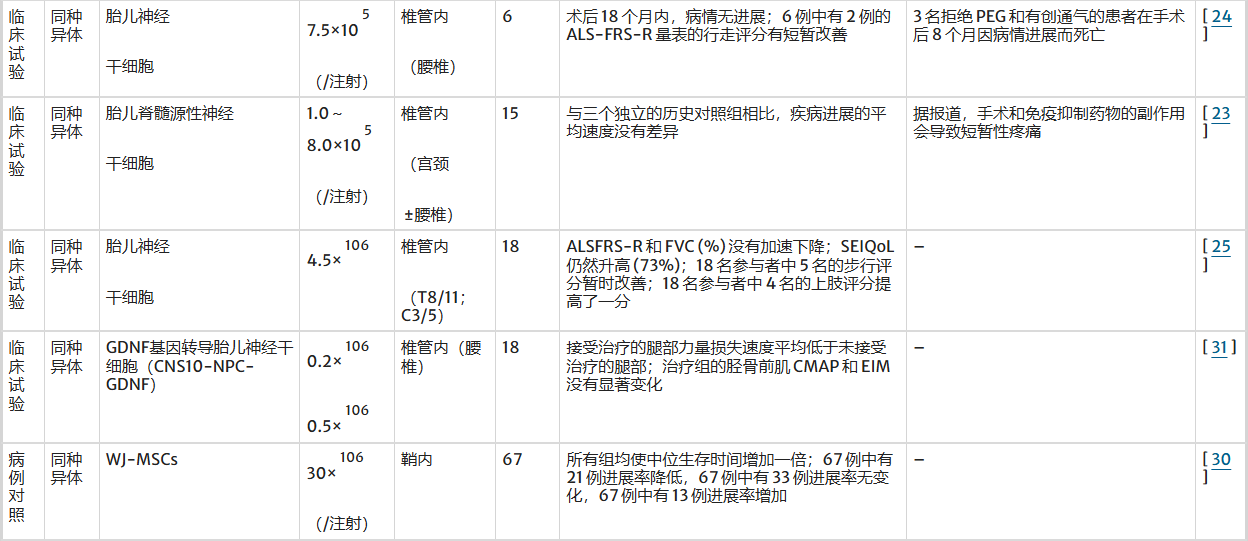
表3:不同细胞类型在肌萎缩侧索硬化症中的治疗效果
胎儿脊髓来源的神经干细胞治疗肌萎缩侧索硬化症
两项在2014年和2016年进行的临床试验提示,异体胎儿脊髓来源的神经干细胞可用于颈髓腔内移植。Feldman等人开展了一项I期临床试验,共纳入6名患者,每次注射1.0×10⁵个细胞。术后评估采用ALSFRS-R、HHD和EIM等指标,结果显示疾病进展并未加速,其中接受颈髓注射的患者病程进展甚至有所减缓。未观察到严重不良事件,仅出现轻微的围手术期和术后并发症。
同样地,Glass等人开展了一项I/II期临床试验,纳入15名患者,使用相同的细胞系,注射浓度为1.0–8.0×10⁵个细胞/次。所有患者均在颈髓两侧接受注射,其中一组额外在腰髓(L2–L4)水平注射。研究未设立自身对照组,而是与三组历史对照组进行比较,结果显示实验组与对照组在疾病进展平均速率上无显著差异。报告的不良事件包括与手术相关的短暂疼痛以及免疫抑制剂引起的副作用。
胎儿人类神经干细胞治疗肌萎缩侧索硬化症
Mazzini等人于2015年和2019年分别通过对6名和18名患者的临床试验提出,采用胎儿人类神经干细胞靶向腰椎脊髓治疗肌萎缩侧索硬化(ALS)。在初步研究中,以7.5×10⁵细胞浓度进行脊髓内注射,术后18个月随访未观察到疾病进展加速的证据。6名参与者中有2例表现出ALS功能评分量表-修订版(ALS-FRS-R)行走亚评分的暂时性改善。
该研究中有3名拒绝接受经皮内镜下胃造口术和有创通气治疗的患者于术后8个月死亡,被认为与疾病自然进展相关。在第二项试验中,接受4.5×10⁶细胞脊髓内注射的患者随访时间长达60个月,未发现与治疗相关的不良事件证据。在细胞移植后的第一个月内观察到ALS-FRS-R评分进展出现显著暂时性减缓,该效应持续至4个月。
自体间充质干细胞(MSCs)治疗肌萎缩侧索硬化症
Rushkevich团队开展自体BM-MSCs治疗肌萎缩侧索硬化症的初步探索(2015年):通过腰椎穿刺途径对25例ALS患者进行自体BM-MSCs输注。12个月随访显示,治疗组10例患者疾病进展速度显著减缓,且未出现明显不良反应,初步证实了该疗法的安全性及潜在延缓疾病进展的效果。
Petrou团队开展鞘内注射剂量优化研究(2021年):采用1.0×10⁶细胞/公斤体重的剂量对20例患者进行鞘内注射。研究发现多次注射后患者ALSFRS-R评分改善率持续提升(首次注射后73.7%的患者进展率改善>25%),且无严重不良事件报告,提示重复给药可能增强疗效。
Berry团队NurOwn®细胞多重给药途径试验(2019年):通过鞘内与肌肉注射联合方式给药,发现治疗组ALSFRS-R评分斜率在短期(2周)内显著改善(+1.7分/月),但11例患者出现头痛、背痛等不良反应,表明尽管神经营养因子分泌型细胞具有短期疗效,但需关注疼痛类副作用。
Cudkowicz团队大规模Ⅲ期验证研究NurOwn®细胞治疗ALS的疗效(2022年):对196例患者进行高浓度鞘内注射(125×10⁶细胞)。虽然治疗组在神经炎症标志物和神经营养因子水平显著改善,但未达到主要临床终点,且疼痛成为普遍不良反应,提示生物标志物改善未必转化为临床终点获益,亟需优化治疗策略。
沃顿胶源间充质干细胞(WJ-MSCs)治疗肌萎缩侧索硬化症
Barczewska等人通过一项病例对照研究证实,鞘内注射WJ-MSCs对治疗肌萎缩侧索硬化(ALS)患者具有治疗潜力。该研究共纳入67例患者,治疗组按每次注射30×10⁶细胞的剂量给药。所有组的中位生存时间均实现翻倍,其中67例患者中21例疾病进展速度减缓,33例进展速度无变化,13例出现进展加速。研究中未报告严重不良事件。
过表达GDNF的胎儿神经干细胞治疗肌萎缩侧索硬化症
Baloh等人于2022年报告了一项1/2a期临床试验,使用经胶质细胞源性神经营养因子(GDNF)基因转导的胎儿神经干细胞(CNS10-NPC-GDNF)进行治疗。18名参与者被分为两组:A组接受0.2×10⁶个CNS10-NPC-GDNF细胞治疗;B组接受0.5×10⁶个细胞治疗。细胞被注射到腰椎脊髓背角与腹角之间的过渡区。
尽管治疗组在胫骨前肌复合肌肉动作电位(CMAP)和电阻抗肌动图(EIM)方面未观察到显著变化,但接受治疗的腿部力量丧失速度平均慢于未治疗的腿部。未报告与注射细胞相关的严重不良事件。
讨论干细胞治疗神经创伤和神经退行性疾病的临床疗效
本研究是第一份全面、比较地概述细胞疗法在治疗脊髓损伤、脑外伤和肌萎缩侧索硬化症等各种神经康复疾病的规格和疗效的最新发展的综述,主要关注过去十年(2014年至2024年)发表的研究。
细胞疗法在神经创伤性疾病中的疗效:对于脊髓损伤的治疗,骨髓来源细胞和神经(祖)干细胞是两种表现出显著潜力的细胞类型。其疗效主要体现在美国脊髓损伤协会(AIS)分级改善、感觉与运动功能恢复以及膀胱和肛门控制能力提升等方面(图2)。
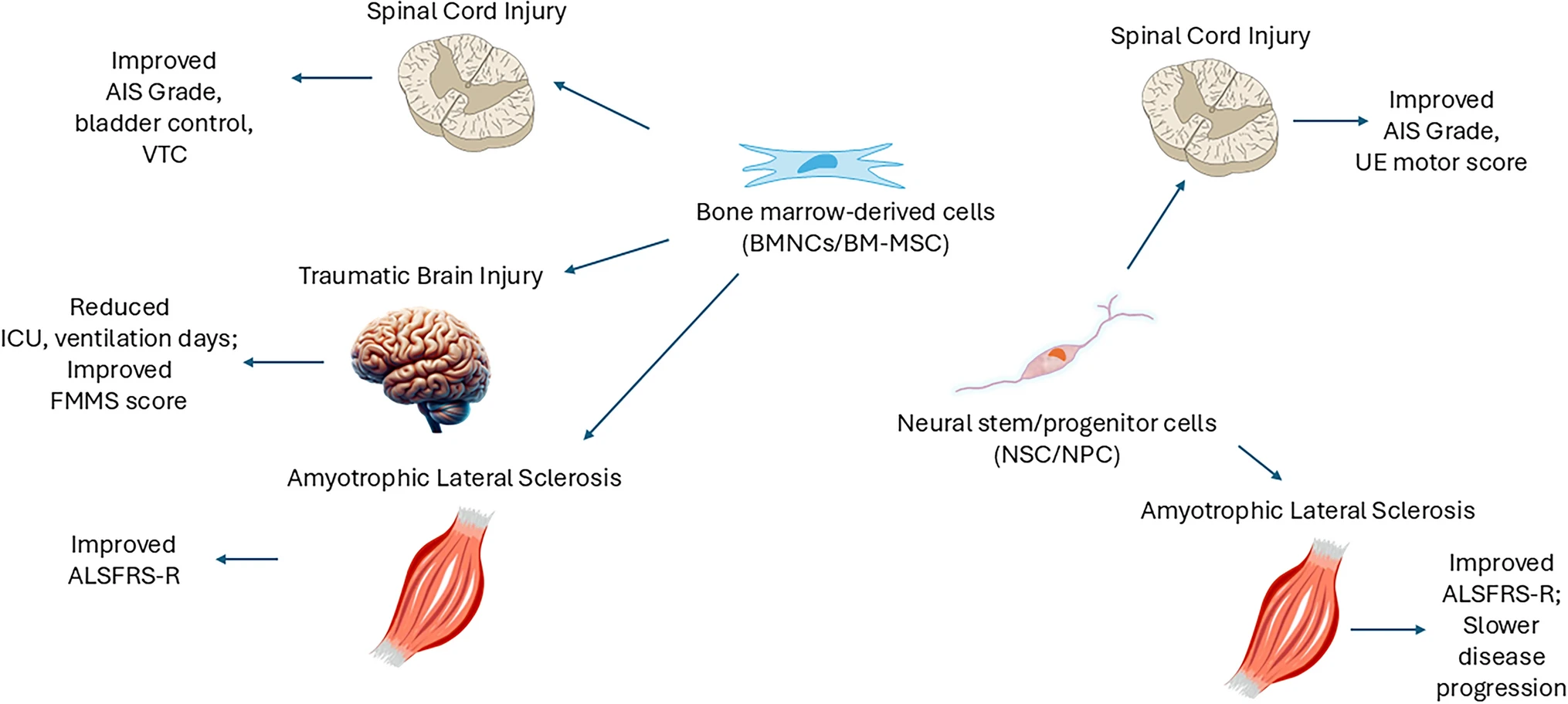
图2:骨髓有核细胞和骨髓间充质细胞在神经创伤和神经退行性疾病中的潜在治疗效果
研究表明,自体骨髓来源细胞对颈椎、胸椎和腰椎等几乎所有节段的脊髓损伤均具有治疗效果,多项临床试验均观察到患者AIS分级获得至少一级或多级的改善。
这两种细胞均通过鞘内注射途径给药,但针对的损伤节段存在差异。骨髓来源细胞广泛适用于各节段损伤,而同种异体神经干细胞则主要应用于较高节段的颈胸段脊髓损伤。值得注意的是,尽管给药方式一致,但不同细胞类型的作用机制和长期效果各有特点。
细胞治疗在神经退行性疾病中的疗效:在肌萎缩侧索硬化症(ALS)的治疗中,间充质干细胞和神经干细胞已被证明可有效促进患者康复。ALS疾病进展减缓,以及根据修订版 ALS功能评定量表 (RERS) 评估的疾病进展加速改善或消失,证明了该疗法的有效性。
干细胞治疗神经退行性疾病的疗效机制与综合潜力
干细胞治疗神经疾病的疗效可能主要归因于其强大的免疫调节与神经营养作用,而非简单的细胞替代。它们通过释放抗炎细胞因子(如IL-10),诱导M2型巨噬细胞/小胶质细胞活化,并抑制TNF-α、IL-1β等促炎因子,从而减轻继发性神经损伤、创造再生微环境。
同时,分泌的多种神经营养因子支持了现存神经元的存活和轴突修复。MSCs的旁分泌效应和NSCs的分化潜能相结合,可能是未来优化治疗策略的方向。
研究的局限性与挑战
尽管结果鼓舞人心,但该领域仍面临显著挑战,限制了研究结论的普适性。
- 异质性高:各研究在给药途径、细胞剂量、浓度、来源(自体/异体)、制备流程和产品状态(新鲜/冻存)上存在巨大差异。
- 样本量小:大多数研究样本量有限(n<25),统计效能不足。
- 评估标准不一:除AIS分级外,部分研究使用ISNCSCI、FIM、ALSFRS-R、GRASSP等多种评估工具,导致结果难以直接比较。
- 缺乏标准化:在细胞制备、分化方法和生产标准上缺乏国际共识,是导致结果不一致的主要原因。
安全问题
总体而言,多数细胞疗法耐受性良好。然而,仍需警惕可能的不良事件。在SCI治疗中,包括脊髓出血性坏死、脑脊液漏、假性脑膜膨出等严重手术相关风险,以及感染、血肿、头痛和恶心等轻度不良反应。
在ALS治疗中,头痛、背痛等疼痛反应较为常见。值得注意的是,疾病自然进展相关的严重事件(如死亡)需与治疗相关副作用仔细区分。在严格监控下,当前证据表明细胞疗法的潜在收益可能超越其风险。
未来我们应该怎么做?
未来研究应从以下方向重点突破:
- 开展大规模、多中心RCTs:针对特定损伤水平和疾病分期的患者,使用标准化的细胞产品和统一的疗效评估指标,以提供高级别证据。
- 探索最佳治疗策略:确定不同疾病的最优细胞类型、剂量、给药途径和治疗时机。
- 开发联合治疗策略:将细胞疗法与生物材料(如SilMA水凝胶支架)、神经营养因子或现有康复手段相结合,以协同增强疗效。
- 深入研究机制:利用生物标志物和影像学技术,进一步阐明细胞的作用机制和患者反应差异的原因。
结论
近十年的临床研究数据表明,细胞疗法为神经创伤和退行性疾病患者带来了令人鼓舞的新希望。骨髓干细胞和神经干细胞在治疗SCI和TBI中展现出明确潜力,而间充质干细胞和神经干细胞在延缓ALS进展方面显示出疗效。
然而,要将这种潜力转化为临床常规应用,未来必须着力于推动研究设计的标准化、细胞制备的规范化以及疗效评估的统一化,并通过精心设计的大规模临床试验来最终验证其安全性和有效性,从而确保这一前沿疗法能够惠及更广泛的患者群体。
参考资料:[1]:Ku, J.B., Pak, R.J., Ku, S.S. et al. Clinical Efficacy of Stem Cell Therapy in Neurotraumatic and Neurodegenerative Conditions: A Comparative Review. Tissue Eng Regen Med (2025). https://doi.org/10.1007/s13770-025-00757-2
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复