神经退行性疾病,如阿尔茨海默病(AD)、帕金森病(PD)和肌萎缩侧索硬化症(ALS),一直是现代医学面临的重大挑战。随着人口老龄化加速,这类疾病的患病率逐年攀升,不仅严重影响患者的生活质量,也给社会医疗体系带来沉重负担。尽管过去几十年间,研究者们在病理机制探索和药物研发方面取得了诸多进展,但目前的治疗手段大多仍停留在缓解症状层面,真正能够延缓甚至逆转疾病进程的疗法仍显匮乏。
在这种背景下,干细胞治疗和工程化外泌体逐渐走入公众与学界的视野,代表着一种新的治疗范式。干细胞移植为修复受损神经组织提供了可能,而外泌体作为细胞间通讯的重要媒介,正被赋予药物递送与神经保护的新使命。二者的结合,或许正预示着未来神经退行性疾病治疗的方向。
重塑神经退行性疾病治疗的未来:干细胞与工程化外泌体的临床转化进展
近日,国际期刊《中枢神经系统治疗》杂志发表的一篇文献综述,系统回顾了“干细胞和外泌体治疗神经退行性疾病的临床试验进展和前景”。该综述对94项针对AD、PD、ALS和亨廷顿病(HD)的干细胞临床试验进行了评估,并探讨了基于干细胞来源外泌体的新兴疗法[1]。

其结果表明,外泌体能够穿越血脑屏障,将治疗分子直接递送至脑部,为干细胞移植提供了一种侵入性更低的替代方案。尤其是间充质干细胞(MSC)来源的外泌体,在临床前模型中展现出减少神经炎症、氧化应激和促进神经元再生的潜力。
干细胞治疗神经退行性疾病的概述
干细胞疗法通过修复受损脑组织和减缓病情进展,为治疗神经退行性疾病(ND)带来了新的希望。多种干细胞类型,包括神经干细胞(NSC)、间充质干细胞(MSC)、诱导多能干细胞(iPSC)和胚胎干细胞(ESC),已被证实能够替换丢失的神经元、修复受损脑回路并整合入脑组织,从而改善患者的认知与运动功能。
临床试验概况:为系统分析该领域的临床研究进展,我们从ClinicalTrials.gov数据库筛选出94项相关试验。筛选过程基于特定疾病关键词搜索,并严格排除了未使用干细胞疗法及处于暂停、终止等状态的研究。
最终纳入的试验根据招募状态被分类为“已完成”或“正在进行”,并按临床阶段(包括未知阶段NA)进行归纳,从而清晰展示了干细胞治疗各类神经退行性疾病所达到的最新研发阶段。
使用干细胞治疗上述ND的初始临床试验始于2007年,首先是ALS,随后2011年是AD和PD,后来在2014年是HD。这些试验主要集中于评估干细胞在ND中的效果,并旨在评估通过各种输送方式(包括静脉内或鞘内注射以及直接移植到脑内)将干细胞移植到患者体内的安全性和可行性。
在94项临床试验中,如果我们忽略那些研究状态未知的,则总共有3项3期试验(1项针对ALS已完成、1项正在进行,1项针对HD正在进行),10项2期试验(2项针对AD正在进行,2项针对PD已完成、1项正在进行,2项针对ALS已完成、2项正在进行,1项针对HD已完成),以及1项针对ALS已完成的2/3期试验。其余大部分为1期和1/2期试验,以及少数早期试验(图1)。
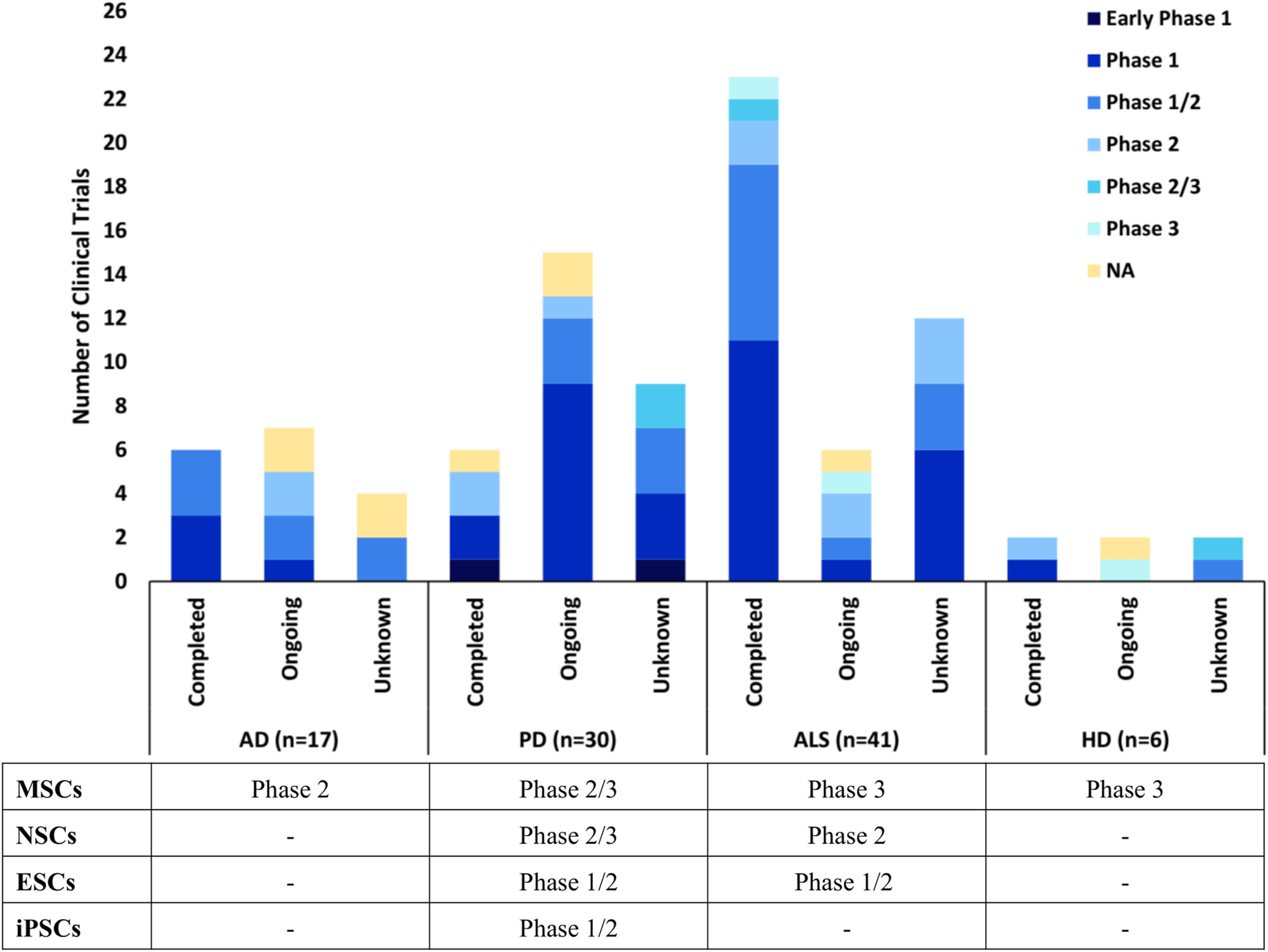
图1:数据显示AD、PD、ALS和HD的干细胞临床试验状况,按阶段分类,以及每种疾病所处的最远阶段,如在clinicaltrials.gov上注册的。
总计有超过8000名参与者(患者和健康对照者)参加了这四种疾病的干细胞治疗试验。值得注意的是,其中近70%的参与者参加了AD试验(图2)。
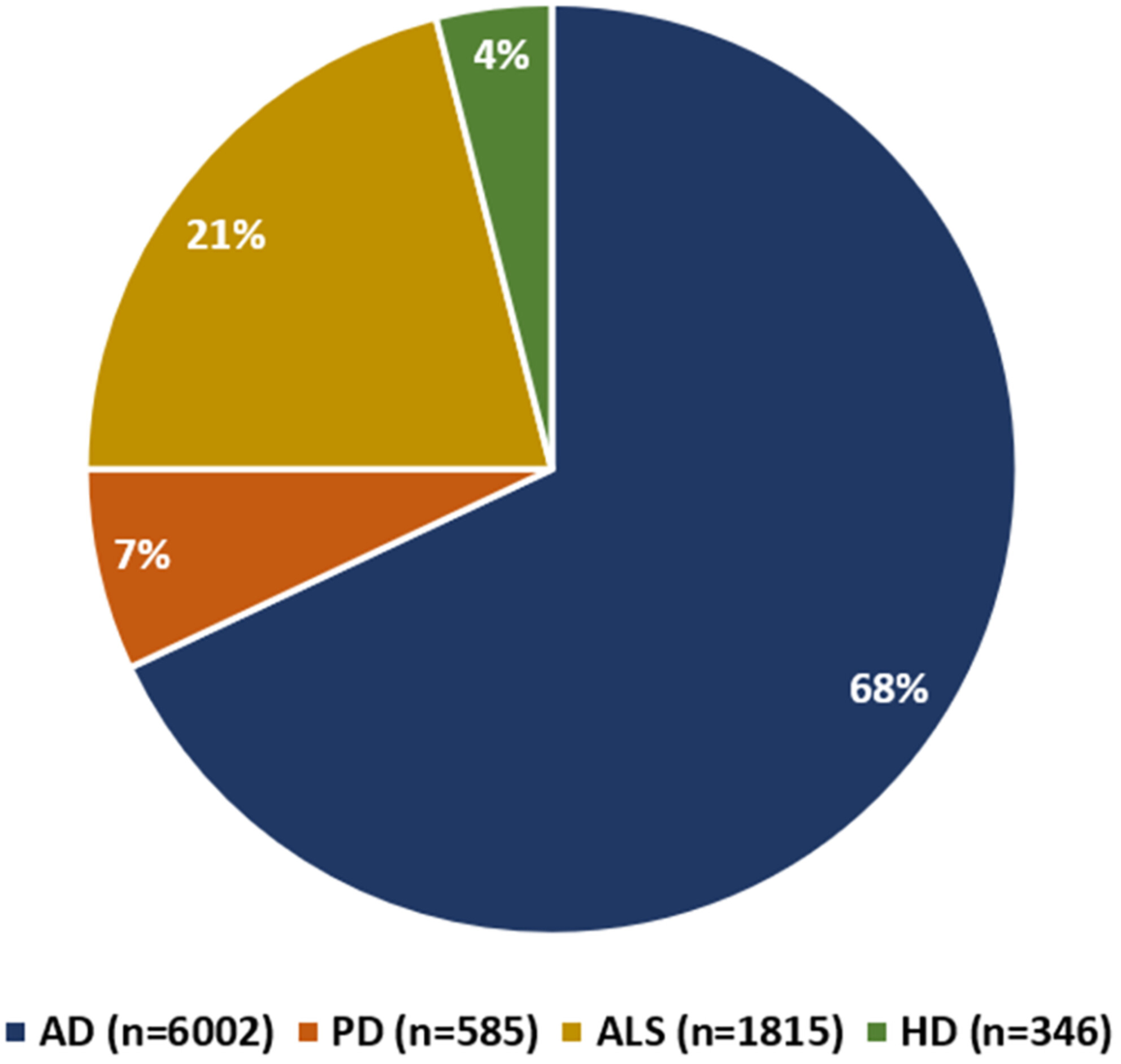
图2:在clinicaltrials.gov上注册的AD、PD、ALS和HD干细胞治疗临床试验参与者的分布情况。
各类干细胞治疗的应用与挑战
神经干细胞(NSC):在中枢神经系统 (CNS) 的发育过程中,神经干细胞 (NSC) 具有独特的自我更新能力,能够分化成神经元和神经胶质细胞,这使其特别适合用于治疗神经退行性疾病 (ND) 。已证明NSC移植可通过各种机制预防神经退行性变并促进再生,包括增强神经元可塑性、减少神经炎症、产生神经营养因子以及修复死亡细胞。
然而,它们的使用也有局限性。NSC主要存在于成人大脑的特定区域,因此从活体捐献者处获取它们用于治疗目的并不切实际。此外,从胎儿大脑中获取NSC会引发有关可能利用人类胎儿的伦理担忧。
间充质干细胞(MSC):MSC通常来源于骨髓、脂肪组织或脐带组织,是临床试验中使用最广泛的干细胞之一(图3A、B),因为它们能够改变局部微环境、支持神经发生、促进细胞修复和调节免疫反应,从而可能改善认知和运动功能。它们的免疫调节作用和营养因子的分泌使其成为治疗ND的有吸引力的选择,有可能缓解神经炎症并增强组织修复。MSC通常被认为具有良好的安全性,因为它们不易形成肿瘤,并且可用于自体疗法以减轻免疫排斥反应。
但其临床应用仍面临挑战:包括移植后细胞存活率低、定向分化为神经细胞困难,以及可能因反复注射或MHC I类分子表达引发免疫反应的风险。
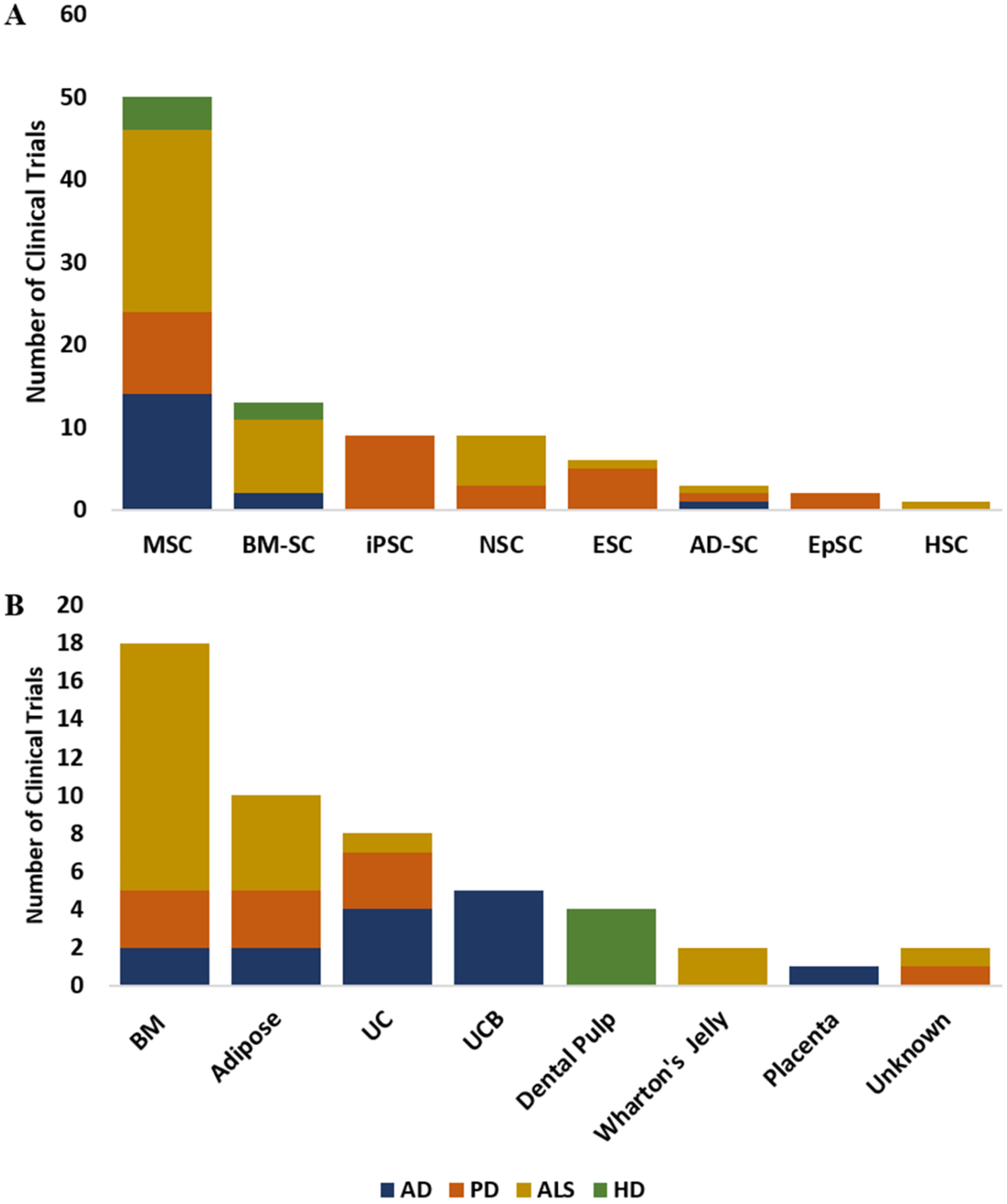
图3:(A) 在clinicaltrials.gov上注册的AD、PD、ALS和HD临床试验中使用的干细胞类型分布。(B) 在clinicaltrials.gov上注册的AD、PD、ALS和HD临床试验中使用的干细胞分离来源。
胚胎干细胞(ESC):胚胎干细胞(ESC)因其具有分化为所有细胞类型的强大潜力而备受关注,但受限于伦理争议,其在神经退行性疾病(ND)领域的临床试验数量较少,目前仅有6项,主要集中于帕金森病(PD)和肌萎缩侧索硬化症(ALS)。
诱导多能干细胞(iPSC):相比之下,诱导多能干细胞(iPSC)通过重编程体细胞获得,在保留多能性的同时有效规避了伦理问题,已成为更具应用前景的替代策略;现有临床试验主要围绕PD展开,通过将iPSC分化为多巴胺能祖细胞进行脑内移植,且研究方向正逐渐拓展至基于iPSC的外泌体疗法,以提升分化的可控性并降低免疫风险。
干细胞治疗供体来源选择
干细胞供体来源主要包括自体(来自患者自身)和异体(来自他人)。异体来源在AD和PD中较常见,可提供更健康、丰富的细胞,但存在免疫排斥风险;自体疗法在ALS中应用较多(图4),无排斥问题但可能受患者年龄和病情影响细胞质量。最终选择需结合疾病类型、患者状况及细胞质量而定。
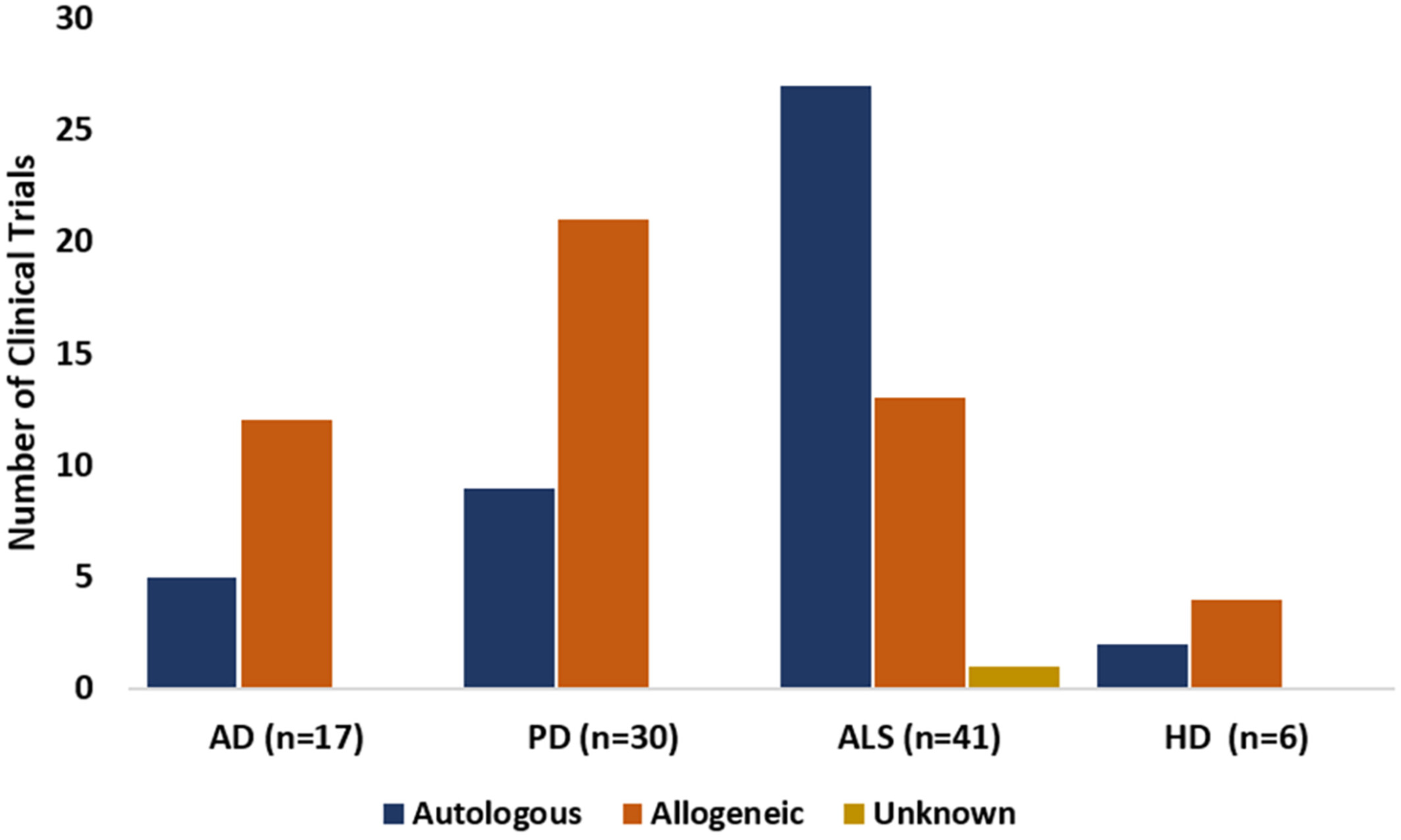
图4:在AD、PD、ALS和HD临床试验中使用的干细胞的捐赠来源,已在clinicaltrials.gov上注册。
干细胞外泌体在神经退行性疾病中的特征与功能
特征与生物学功能:在神经退行性疾病的背景下,外泌体是直径30-150纳米的细胞外囊泡,由脂质双层膜(含鞘磷脂、胆固醇等)构成,表面携带CD9、CD63、CD81等蛋白标志物,内部包裹miRNA、蛋白质等生物活性分子。
它们在中枢神经系统中维持大脑内环境平衡,参与调控突触可塑性、促进神经发生、支持髓鞘形成和驱动神经修复再生,并通过传递遗传信息调控基因表达,发挥神经保护、抑制凋亡、调节氧化应激和炎症反应等作用。
治疗潜力:基于其功能,外泌体(尤其是MSC和NSC来源)在ND治疗中展现出巨大潜力。MSC外泌体通过传递VEGF、TGF-β等因子和miR-21促进血管生成、抑制凋亡和减轻炎症;NSC外泌体则富含BDNF和miR-124等,直接促进神经元分化、突触形成和神经保护。其天然穿越血脑屏障的能力,使其成为极具前景的无细胞治疗策略和药物递送载体。
外泌体的生物合成:如图5所示 ,外泌体的生物合成始于真核细胞的内体系统,始于细胞质膜内陷形成早期内体。这些早期内体随后成熟为晚期内体,称为多泡体 (MVB)。在此成熟过程中,内体膜向内出芽进入MVB腔,形成腔内囊泡 (ILV)。MVB可以与溶酶体或自噬体融合降解,或转运至质膜,在那里它们融合并将ILV释放到细胞外环境中,形成外泌体。
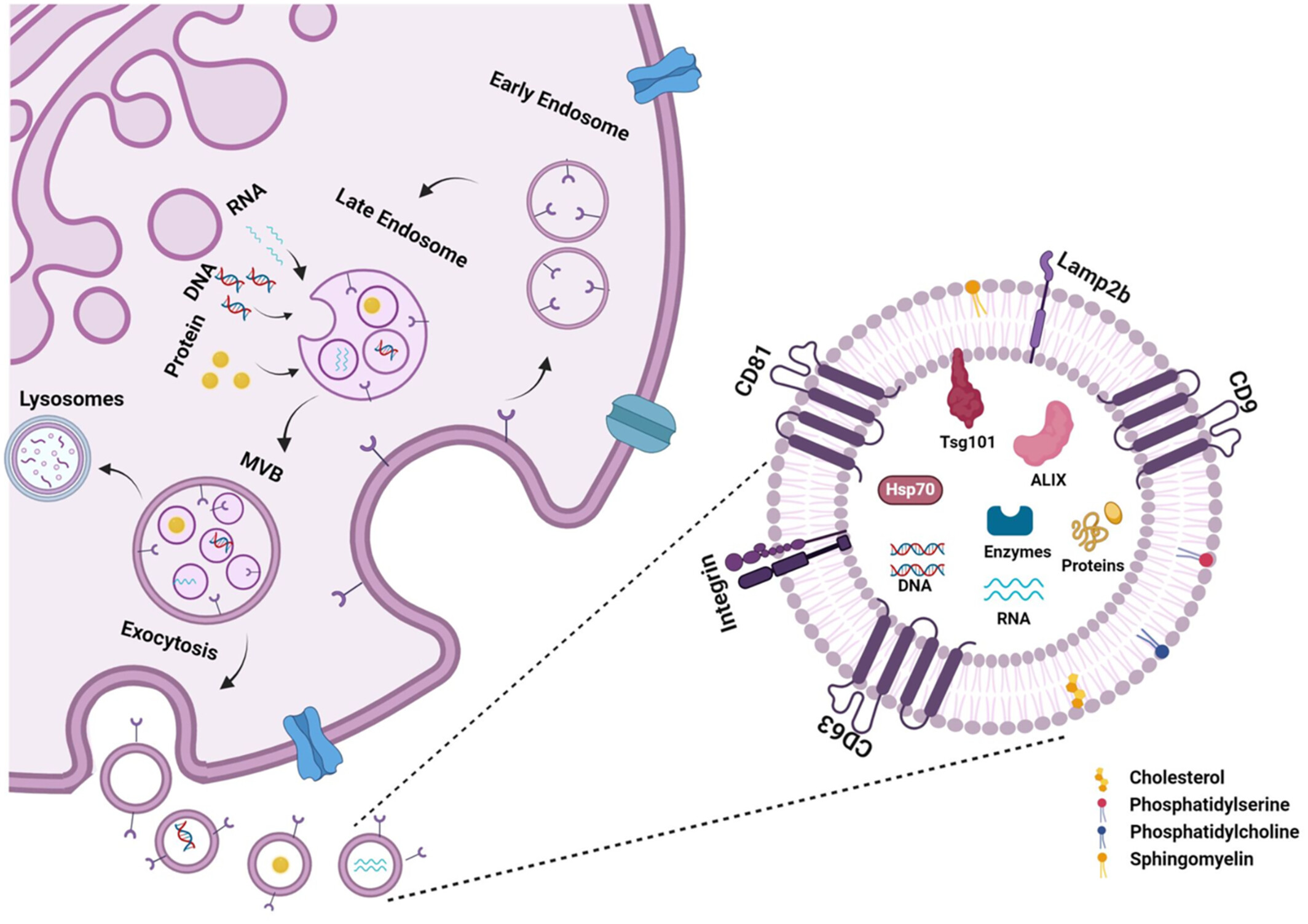
图5:外泌体的生物合成和分子组成。
干细胞外泌体在治疗神经退行性疾病中的潜力
外泌体在神经性痴呆(ND)中的治疗潜力源于其能够传递神经保护和再生信号、穿过血脑屏障 (BBB) 并最大限度降低干细胞治疗相关风险。临床前研究表明,外泌体能够在动物模型中传递神经保护药物、减轻神经炎症并促进神经元再生,这凸显了其药用潜力。
干细胞外泌体治疗阿尔茨海默病
MSC衍生的外泌体具备抗炎、神经保护和促进再生能力,能缓解神经炎症、促进神经重塑和血管生成,在动物模型中减少炎症、改善记忆。
NSC外泌体同样可促进神经元存活、刺激神经发生,并降低磷酸化tau和β-淀粉样蛋白水平。星形胶质细胞和小胶质细胞来源的外泌体也显示治疗潜力,如调节突触活动、调控炎症反应(如促进M2极化)等。此外,含鞘糖脂的外泌体能减轻淀粉样病理,可能充当清除Aβ的“信使”。
干细胞外泌体治疗帕金森病
外泌体在帕金森病(PD)中的治疗潜力已在临床前研究中得到广泛探究,揭示了体外和体内模型中神经保护的多种机制和重大前景。这些模型凸显了MSC和NSC衍生的外泌体在减轻PD病理特征方面的功效。
富含神经营养和抗炎因子的MSC衍生外泌体已被证实能够减少α-突触核蛋白(α‐syn)聚集、促进自噬、增强多巴胺能神经元存活并改善运动障碍。例如,它们通过促进脑微血管内皮细胞的血管生成改善神经血管功能,抑制小胶质细胞活化并减少神经炎症。
干细胞外泌体治疗萎缩侧索硬化症
干细胞外泌体在肌萎缩侧索硬化症(ALS)中展现出多重保护作用。脂肪来源干细胞(AD-SCs)外泌体能够减缓SOD1蛋白聚集、改善线粒体功能,并在氧化应激环境下降低细胞损伤、提升细胞存活率。在ALS动物模型中,无论是静脉注射还是鼻腔给药,这些外泌体都能跨越血脑屏障并精准定位受累脑区,从而改善小鼠的运动功能,显示出良好的神经保护效果和天然靶向性。
此外,间充质干细胞(MSC)外泌体同样在ALS中具有治疗潜力。它们可促进运动神经元的神经突起生长和形态改善,并携带多种抗氧化和抗炎基因,从而在正常和应激条件下均能增强神经元的存活与功能。这些研究结果表明,干细胞外泌体通过调控炎症反应、缓解氧化应激和改善细胞能量代谢,为ALS的新型治疗策略提供了坚实的理论与实验基础。
干细胞外泌体治疗亨廷顿舞蹈症
干细胞外泌体为治疗亨廷顿舞蹈症(HD)提供了一种极具前景的无细胞治疗策略。其核心作用在于作为天然的纳米级载体,能够有效穿越血脑屏障,将具有治疗价值的生物活性分子(如小干扰RNA和微小RNA)精准递送至中枢神经系统的受损脑区。在HD中,这旨在降低突变亨廷顿蛋白(mHTT)的毒性聚集、促进神经营养因子(如BDNF)的生成,并最终发挥神经保护作用,延缓疾病进展。
其治疗机制主要通过所携带的货物分子来实现。例如,负载siRNA的外泌体可以特异性沉默突变型HTT基因的表达,从源头上减少毒性蛋白的产生。同时,外泌体富含的特定miRNA(如miR-124)能够通过抑制REST等关键靶点,重建受损的基因调控网络,促进神经元存活和功能恢复。此外,源自干细胞(如脂肪来源干细胞)的外泌体本身还具有天然的神经保护特性,能够减轻神经炎症、改善细胞应激反应,从而为受损神经元提供一个更有利的微环境。
目前,关于使用源自干细胞(例如MSC、NSC或iPSC)的外泌体进行亨廷顿氏病治疗的文献非常有限。虽然干细胞衍生的外泌体因其神经保护特性而显示出在各种神经退行性疾病中的治疗潜力,但证明其在亨廷顿氏病模型中疗效的具体临床前研究却很少。
干细胞来源的外泌体在ND中的临床试验
人们普遍认为,外泌体是治疗多种疾病的一种很有前景的选择。大量临床前研究表明,外泌体可治疗多种疾病。最近,外泌体已被用于临床试验,特别是从人类干细胞中获得的外泌体。此外,外泌体在临床应用中的主要用途包括作为生物标记物、提供基于外泌体的疗法和辅助药物输送系统。目前,研究外泌体在NDs中应用的临床试验仍然很少,这反映了这一领域的新颖性。
一项正在招募的临床试验已完成Ⅰ期,旨在评估从人脐带间充质干细胞(UC-MSC)分离的外泌体鼻用滴剂在ALS治疗中的安全性和初步疗效,并将在Ⅱ期阶段进一步开展评估(ClinicalTrials.gov编号:NCT06598202)。
另一项尚未开始招募的新研究计划探讨将有氧运动与认知训练相结合的长期干预项目对高风险AD患者认知能力及血液中神经外泌体突触蛋白等生物标志物的影响。通过分析血液循环外泌体中的GAP43、神经颗粒蛋白、SNAP25和突触囊泡蛋白等标志物,研究人员可以在临床症状出现之前识别AD的早期迹象(ClinicalTrials.gov编号:NCT05163626)。
此外,还有一项临床试验评估了AD-MSC外泌体治疗AD的安全性和疗效,该试验通过鼻腔给药方式进行,结果显示患者认知功能得到改善(ClinicalTrials.gov编号:NCT04388982)。
由于部分神经退行性疾病(ND)尚无外泌体疗法,研究人员也探索了外泌体在诊断中的潜力。例如,一项观察性研究通过分析血液成分(包括外泌体及其相关生物标志物)来研究神经认知障碍的影响因素,特别是AD(ClinicalTrials.gov编号:NCT03275363)。另一项研究则通过分析尿液外泌体寻找帕金森病(PD)的潜在生物标志物,结果发现富含亮氨酸重复激酶2(LRRK2)及其他蛋白质与PD的病理生理相关(ClinicalTrials.gov编号:NCT01860118)。
目前,虽然已有少数临床试验在探索外泌体治疗AD和ALS,但针对PD和HD的临床试验尚未开展(表1)。

表1:干细胞外泌体治疗神经退行性疾病的临床试验
作为一种新颖且有前景的治疗方式,外泌体疗法仍需进一步研究和临床验证,以评估其在应对神经退行性疾病复杂性中的潜力。在早期开发阶段,外泌体疗法显示出通过提供比干细胞干预更安全、更有效、更易获取的治疗方案,显著提升ND治疗的潜力。
结论与未来展望
本综述重点介绍了干细胞治疗神经性痴呆(ND),包括阿尔茨海默症(AD)、帕金森病(PD)、肌萎缩性脊髓侧索硬化症(ALS)和亨廷顿氏病(HD)的进展。尽管取得了显著进展,尤其是在早期临床试验中。
基于干细胞外泌体可缓解神经炎症、减少氧化应激、促进神经元再生,并通过工程化手段提高靶向性。尽管临床研究仍处于初步阶段,且针对PD与HD的试验有限,但随着技术进步和生产标准化,未来有望提供更安全、高效、侵入性更低的治疗方案,改善ND患者预后。未来的举措应侧重于扩大临床试验,以涵盖更多ND,例如帕金森病(PD)和亨廷顿氏病(HD),同时解决外泌体生产的可扩展性和标准化问题。人们对外泌体疗法日益增长的兴趣,以及技术进步和对其治疗潜力的深入理解,预计将推动ND治疗技术的革命性发展。这些进步可能有助于更精准、更高效、侵入性更低的治疗方案,从而改善这些ND患者的预后。
参考资料:
[1]:Isik S, Osman S, Yeman-Kiyak B, Shamshir SRM, Sanchez NME. Advances in Neurodegenerative Disease Therapy: Stem Cell Clinical Trials and Promise of Engineered Exosomes. CNS Neurosci Ther. 2025 Sep;31(9):e70577. doi: 10.1111/cns.70577. PMID: 40904199; PMCID: PMC12409071.
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复