糖尿病肾病(DKD)是糖尿病的一种严重微血管并发症,其症状包括进行性肾功能障碍、蛋白尿和纤维化,最终发展为终末期肾病。干细胞为什么能修复糖尿病肾病:间充质干细胞(MSCs)之所以能修复糖尿病肾病,主要归因于其强大的旁分泌效应,这使其成为DKD一种极具前景的治疗方法。
近日,中国汕头市汕头大学医学院附属第二医院肾内科的研究人员在国际期刊杂志上发表了一篇《间充质干细胞治疗糖尿病肾病的机制》的研究综述,回答了干细胞为什么能修复糖尿病肾病这个问题[1]。

综述探讨了间充质干细胞治疗糖尿病肾病的机制,包括抑制炎症、纤维化和氧化应激,以及调节血管内皮生长因子(VEGF)。最后,本文概述了已完成的评估MSCs移植治疗DKD患者有效性和安全性的临床试验。本文旨在强调MSCs作为DKD创新疗法的潜力,并指导未来的研究,以优化其治疗应用,最终改善DKD患者的生活质量。
01、干细胞为什么能修复糖尿病肾病:间充质干细胞治疗糖尿病肾病的四大机制
一、抑制炎症:构筑肾脏保护防线
慢性炎症是驱动DKD发生发展的核心环节。 间充质干细胞通过一套精密的“组合拳”,从不同层面构筑强大的抗炎防线。
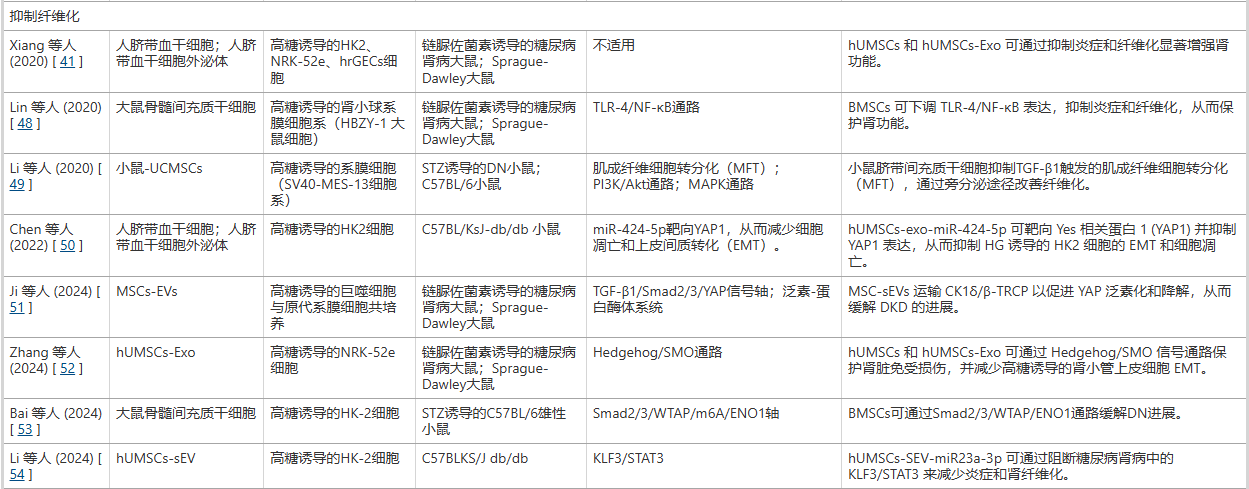
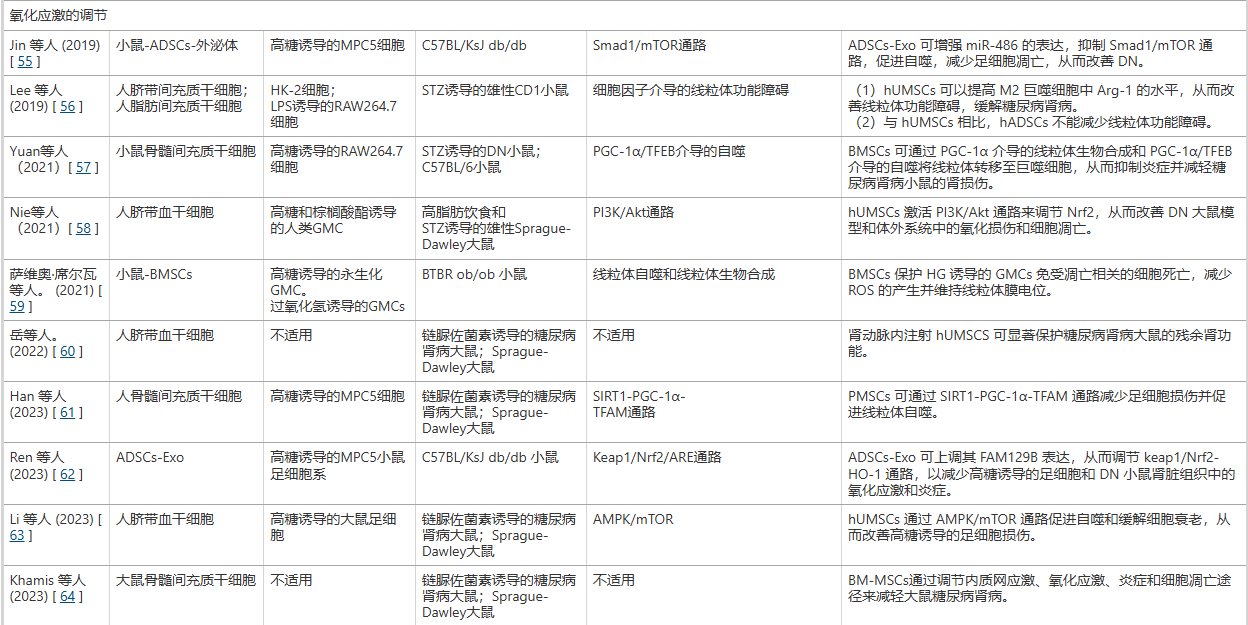
直接抑制促炎信号通路与因子: MSCs能够分泌一系列具有生物活性的因子(如肝细胞生长因子HGF)和外泌体,这些物质可以直接作用于肾脏内的关键促炎信号通路。它们通过抑制如NLRP3炎症小体、TLRs(Toll样受体) 和NOD2等通路的激活,从源头上减少下游促炎细胞因子(如IL-1β、IL-18、TNF-α和IL-6)的产生。其中,外泌体携带的特定microRNA(如miR-22-3p)被证实是执行这一抑制功能的关键分子。通过直接降低这些破坏性炎症因子的水平,MSCs有效减轻了肾脏细胞的炎症损伤和后续的纤维化进程(表1)。
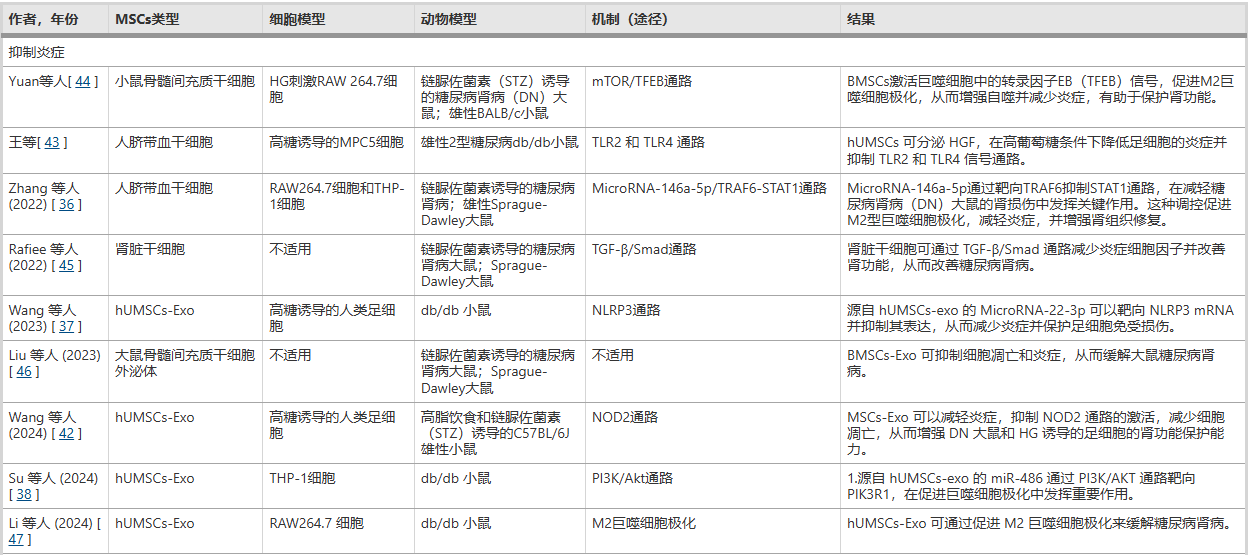
调节免疫细胞,促进抗炎表型极化: MSCs另一项关键的抗炎机制在于其对免疫细胞,特别是巨噬细胞的调控。在糖尿病肾病环境中,巨噬细胞通常极化为促炎的M1型,加剧组织损伤。 MSCs及其外泌体能够通过多种信号通路(如抑制TRAF6/STAT1通路、激活PI3K/Akt通路或增强TFEB介导的自噬),主动将巨噬细胞从M1型极化为具有抗炎和组织修复功能的M2型。研究表明,hUMSC-Exo可改善肾小球足细胞形态,增强足细胞活力,并减少尿白蛋白排泄,从而有助于延缓DKD的进展(表1 ;图1 )。
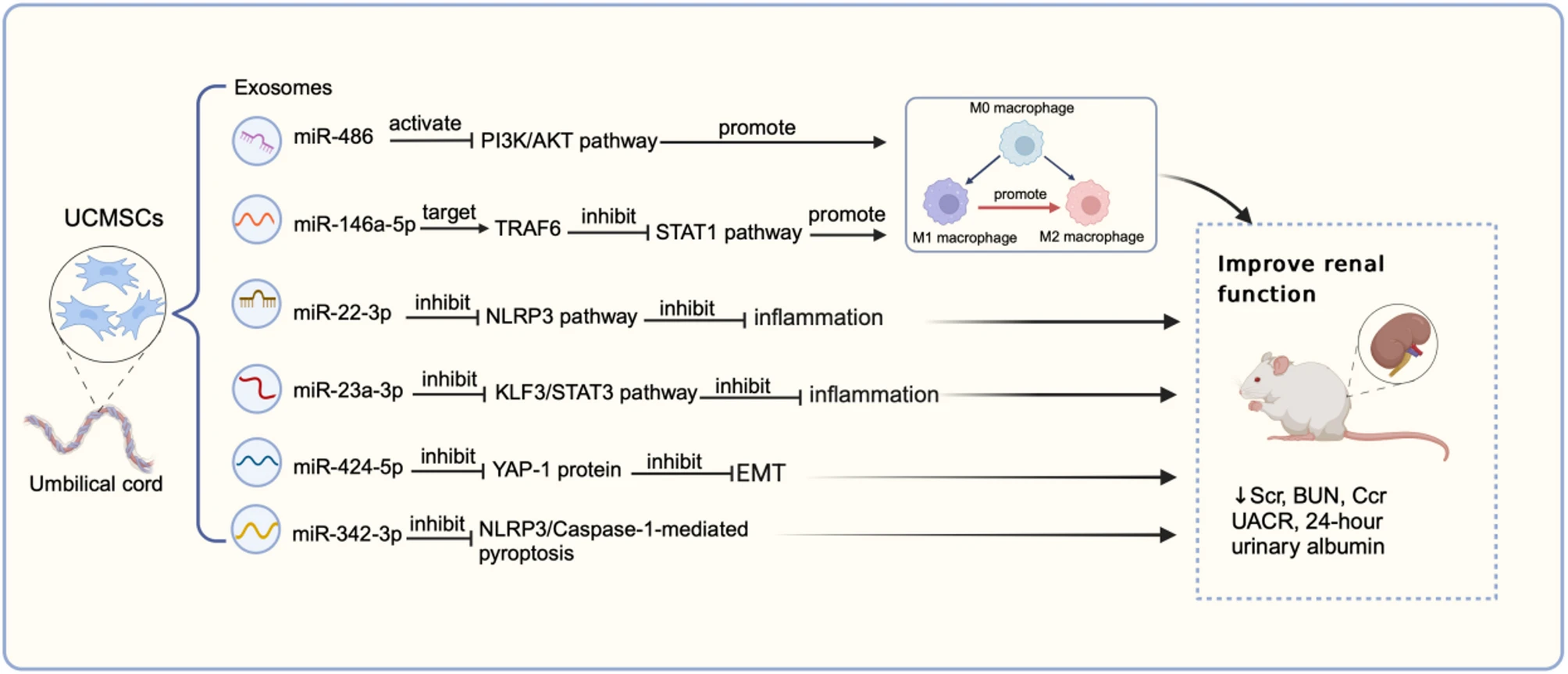
图1:脐带间充质干细胞可分泌外泌体以缓解糖尿病肾病,而外泌体中的microRNA可能在此过程中发挥关键作用。
此外,研究人员发现,BMSCs(骨髓间充质干细胞)可通过TFEB介导的自噬促进M2巨噬细胞极化,从而减轻糖尿病肾病,抑制炎症并减少DN小鼠的系膜细胞增殖和基质扩张(表1;图2)。
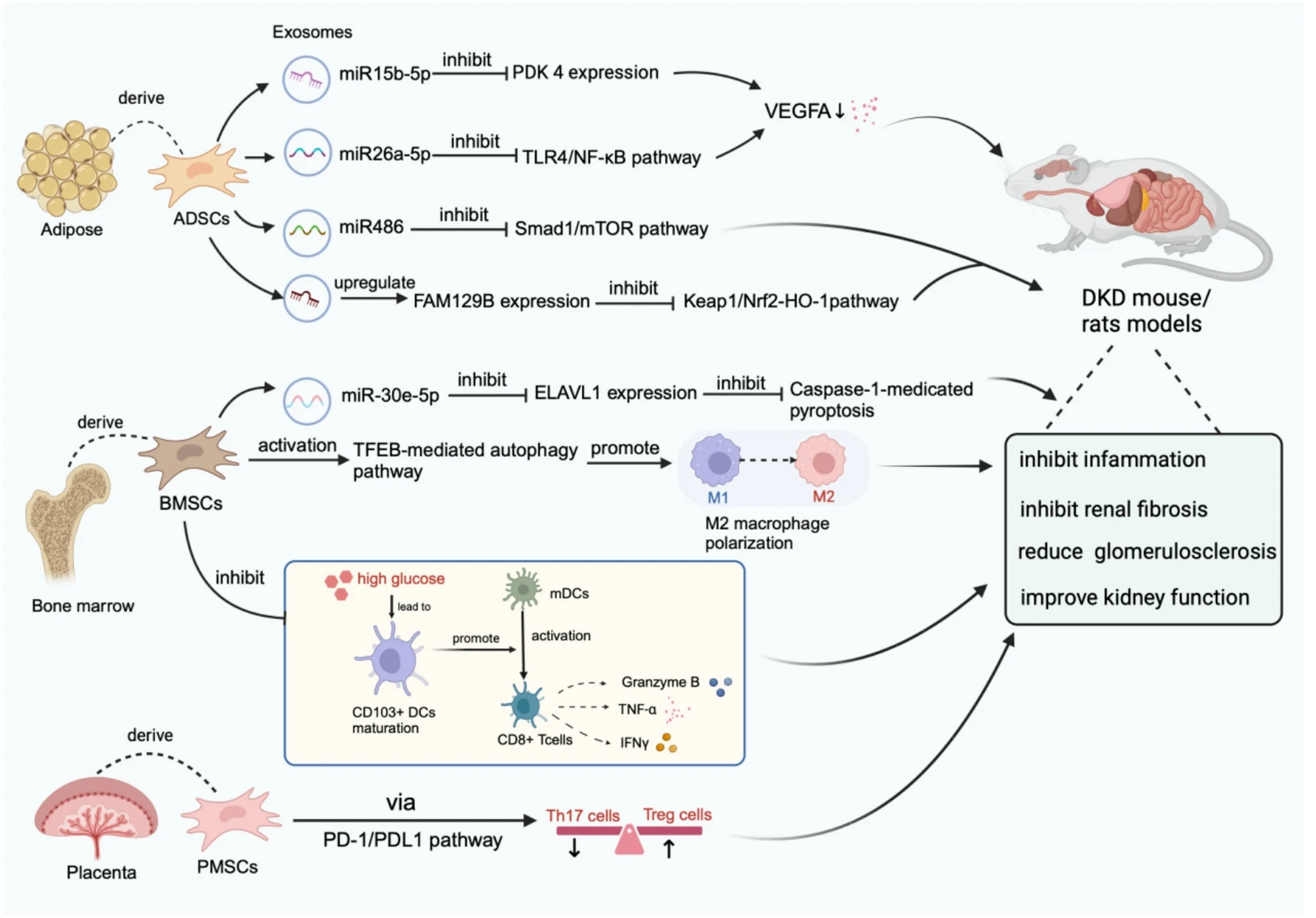
图2:利用不同来源的间充质干细胞通过不同的信号通路缓解动物模型中的糖尿病肾病。
这种极化转变不仅直接抑制了炎症反应,还促进了受损肾脏组织的修复与再生,从本质上改善了肾脏的病理结构。
综上所述,间充质干细胞通过“直接靶向抑制促炎信号”和“巧妙调节免疫细胞功能”这两种相辅相成的策略,构建了一个强大的抗炎环境。这使其能够从分子、细胞到组织层面,多维度地中断糖尿病肾病的炎症核心病理过程,不仅缓解症状,更针对潜在病因,展现出巨大的治疗潜力。
二、对抗纤维化:阻断肾脏瘢痕形成
肾纤维化是DKD走向肾功能衰竭的最终通路。 MSCs通过多靶点干预,有效延缓了这一不可逆的病理过程。
1. 靶向多重促纤维化信号通路: MSCs及其外泌体能够精准地干预多个驱动肾纤维化的核心信号通路。它们通过携带的特定microRNA(如miR-23a-3p)来抑制KLF3/STAT3轴,或通过旁分泌作用阻断TLR4/NF-κB通路和Hedgehog /SMO通路,从而减少胶原沉积和细胞外基质的异常积聚(表1)。
尤为重要的是,MSCs能直接挑战最强大的促纤维化通路——TGF-β/Smad信号。研究发现,MSCs不仅能抑制由TGF-β1诱导的肌成纤维细胞转分化,还能通过其分泌的细胞外囊泡恢复细胞内的泛素-蛋白酶体系统,促进关键促纤维化蛋白(如YAP)的降解,并从Smad2/3/WTAP/m6A/ENO1等表观遗传层面多维度地中断纤维化信号的传导。
2. 超越传统认知:调控肌成纤维细胞的来源:传统上认为,上皮-间质转化(EMT)是肾纤维化中肌成纤维细胞的主要来源。研究表明,MSCs确实可以通过上述通路抑制EMT相关的信号,减轻纤维化。然而,最新研究对EMT的核心地位提出了挑战,指出周细胞和驻留成纤维细胞才是肌成纤维细胞更主要的来源。
因此,MSCs的抗纤维化作用不能仅用抑制EMT来解释。它们很可能通过其强大的抗炎和免疫调节功能,从源头上减少了促使这些真正的前体细胞活化的炎症环境。同时,MSCs可能直接作用于周细胞和成纤维细胞,抑制其向致病性肌成纤维细胞的转化和增殖。这表明MSCs的抗纤维化机制比单纯“逆转EMT”更为复杂和全面。
三、调节氧化应激:从源头维护细胞稳态
氧化应激是加剧肾细胞损伤的关键因素。MSCs通过一套协同机制,从后果干预与源头治理两方面恢复细胞稳态。
抑制程序性细胞死亡:在DKD环境中,过量活性氧会触发铁死亡、细胞焦亡等新型细胞死亡方式。MSCs及其外泌体通过释放特定microRNA,能精准抑制NLRP3/caspase-1介导的细胞焦亡,并通过激活JNK/KEAP1/NRF2等抗氧化通路对抗铁死亡,从而保护肾细胞(表1)。
修复线粒体功能:其次,间充质干细胞通过恢复线粒体功能,从源头上改善氧化还原失衡。线粒体功能障碍是糖尿病肾病中氧化应激的主要来源。MSCs通过两大策略打破高血糖导致的恶性循环:
- 一是促进线粒体自噬,它们通过激活SIRT1-PGC-1α-TFAM和AMPK/mTOR等通路,帮助足细胞等肾细胞清除受损的线粒体;
- 二是直接进行线粒体转移,通过隧道纳米管等结构将健康的线粒体移植给功能受损的肾细胞(如足细胞)甚至免疫细胞(如巨噬细胞),直接补充其能量工厂,恢复正常的能量代谢和抗氧化能力。
减轻DNA损伤:最后,除了针对细胞死亡和线粒体的保护,间充质干细胞还致力于修复氧化应激造成的直接损伤——DNA损伤。持续的高糖和氧化环境会导致肾细胞DNA损伤,激活相关的凋亡信号。研究证实,MSCs能够调控IGF1R-CHK2-p53这一DNA损伤应答信号轴,减轻肾细胞内的DNA损伤积累,从而阻止细胞走向衰老或凋亡,为保护肾脏功能提供了又一重深层保障。
综上所述,MSCs通过多维度、协同作用的方式调节氧化应激,构成了其治疗糖尿病肾病的重要机制基础。
四、调节VEGF水平:实现血管稳态的精准调控
血管内皮生长因子在DKD中的作用复杂,MSCs展现出对其水平的智能调控能力。
抑制VEGF过度表达:在DKD的高糖环境下,VEGF-A的异常高表达会加剧血管渗漏和肾小球硬化。MSCs通过外泌体递送miR-16-5p、miR-26a-5p等特定miRNA,靶向VEGF或其上游通路,有效降低其水平,保护足细胞和肾小球功能(表1)。

背景依赖性的双向调节:值得注意的是,VEGF的作用具有背景依赖性。在阿霉素诱导的以微血管稀疏为特征的肾病中,MSCs分泌的VEGF反而能促进血管修复,发挥保护作用。这凸显了MSCs并非简单升高或降低VEGF,而是能根据疾病微环境“智能”地调节其表达,旨在恢复生理平衡而非单向抑制。
综上所述,间充质干细胞治疗糖尿病肾病时,其对VEGF的调节是一个高度复杂且精密的过程。核心机制在于通过外泌体-miRNA网络,抑制在高血糖环境下有害的VEGF过度表达,以保护足细胞和肾小球功能。同时,MSCs具备根据疾病类型和阶段差异,对VEGF进行双向调节的能力,这凸显了其作为一种“智能”治疗策略的巨大潜力,旨在恢复VEGF的生理平衡而非单纯地抑制或促进。
02、间充质干细胞治疗糖尿病肾病的临床试验
2016年,由墨尔本大学肾脏研究组(Packham 团队)牵头,联合Epworth 医学中心与莫纳什大学医院开展,细胞产品来自Mesoblast(纽约)。研究入组30 位中重度糖肾患者(基线 eGFR 20–50),随机接受单次静脉输注 150×10⁶ 或 300×10⁶ MPC 或安慰剂,随访60 周。
结果显示:炎症指标IL-6 明显下降,全身炎症反应得到改善;肾功能(eGFR/mGFR)保持稳定甚至轻度提升,炎症水平高的患者受益更显著;未见免疫排斥或严重不良反应,安全性优异。
一句话总结:在墨尔本三家医院观察 60 周,单次 150–300×10⁶ MSC 输注,让患者炎症下降、肾功能更稳,全程安全可靠。

异体间充质前体细胞(MPC)治疗糖尿病肾病:一项随机、安慰剂对照、剂量递增研究
研究表明,rexlemestrocel-L可通过降低DKD患者的IL-6水平发挥抗炎作用。静脉给药耐受性良好,未发生急性或治疗相关不良事件,且所有受试者均未产生持续性供体特异性抗HLA抗体,凸显了其良好的免疫安全性。值得注意的是,使用300×10⁶个rexlemestrocel-L治疗可改善mGFR和eGFR。这些结果表明,rexlemestrocel-L安全有效,可能有助于维持肾功能,为有肾移植风险的患者提供了一种有前景的治疗选择(表2)。
| 作者,年份 | 患者 | 研究类型 | 干细胞类型 | 团体 | 处理方法 | 治疗效果 |
|---|---|---|---|---|---|---|
| Packham 等人 (2016) [ 125 ] | 患有糖尿病肾病的成年人(n = 30) | 多中心、随机、双盲、剂量递增、序贯、安慰剂对照试验 | 成人同种异体骨髓来源间充质前体细胞
细胞(MPC) |
T1:用MPC 150 × 10 6处理(n = 10)
T2:用MPC 300 × 10 6处理(n = 10) C:安慰剂组(n = 10) |
随机分组接受静脉输注MPC(150 × 10⁶或300 × 10⁶个细胞)或安慰剂 | MPC治疗可以降低IL-6水平,稳定或改善eGFR和mGFR。 |
| Perico 等人(2023) [ 126 ] | 2 型糖尿病和进行性DKD 患者(n = 16) | 随机、双盲、安慰剂对照的1b/2a 期试验 | 下一代人骨髓来源的抗CD362抗体筛选的同种异体间充质干细胞(ORBCEL-M) | T:接受ORBCEL-M 治疗,(n = 12)
C:安慰剂组(n = 4) |
受试者被随机分配接受单次静脉输注ORBCEL-M(80 × 10⁶个细胞)或安慰剂,并随访18 个月。 | 与安慰剂相比,MSC 疗法显着减缓了eGFR 下降,同时保留了调节性T 细胞,减少了自然杀伤性T 细胞,并稳定了炎症性单核细胞亚群。 |
2023年,由爱尔兰戈尔韦大学牵头,联合英国伯明翰大学与意大利贝加莫教皇若望二十三世医院开展。共纳入16 位 2 型糖尿病肾病患者,随机接受单次静脉输注 80×10⁶ 骨髓来源 MSC 或安慰剂,并随访18 个月。
结果显示:干细胞组患者的eGFR 下降速度显着减缓,曲线从陡峭变平缓;炎症信号下降、修复信号上升, Treg 稳定、NKT 下降,免疫环境“从损伤转向修复” ;安全性方面,仅见少数轻微输注反应,无严重不良事件。
一句话总结:一次 80×10⁶ MSC 输注,让糖肾患者的肾功能“慢下来” ,并在安全性上表现稳定可控。

间充质基质细胞(ORBCEL-M)疗法治疗糖尿病肾病的安全性和初步疗效:一项随机临床试验(NEPHSTROM)
03、能和药物并用吗?
完全可以。
多项研究显示,干细胞与SGLT2 抑制剂、GLP-1RA 、ARB 等药物联用时,在动物实验与早期临床中呈现出协同效果:代谢减负 + 炎症抑制 + 结构修复,让治疗更系统、更持久。
目前多数研究采用单次静脉输注方案,疗程后 3–6 个月复查肾功能与蛋白尿变化。

04、谁可能更适合考虑?
✔ 已确诊糖尿病肾病;
✔ 使用规范药物后,肾功能仍在持续下降;
✔ 想在安全、合规的条件下尝试新治疗。
值得一提的是,目前国内也有多家三甲医院已启动干细胞治疗糖肾的临床项目。符合条件的患者可在医生指导下进行评估入组。
05、结论与展望
本综述概述了间充质干细胞(MSCs)治疗糖尿病肾病(DKD)的机制,包括抑制炎症、纤维化、氧化应激、细胞凋亡、铁死亡和细胞焦亡,以及促进自噬、线粒体转移和VEGF靶向作用。
临床试验表明,基于间充质干细胞治疗糖尿病肾病通常安全且耐受性良好,严重不良事件罕见。为了清晰概述当前的研究现状,我们将关键机制和临床试验结果汇总于两张表格(表1和表2)和三张图表(图1、图2和图3)中,以帮助读者更好地了解最新进展。
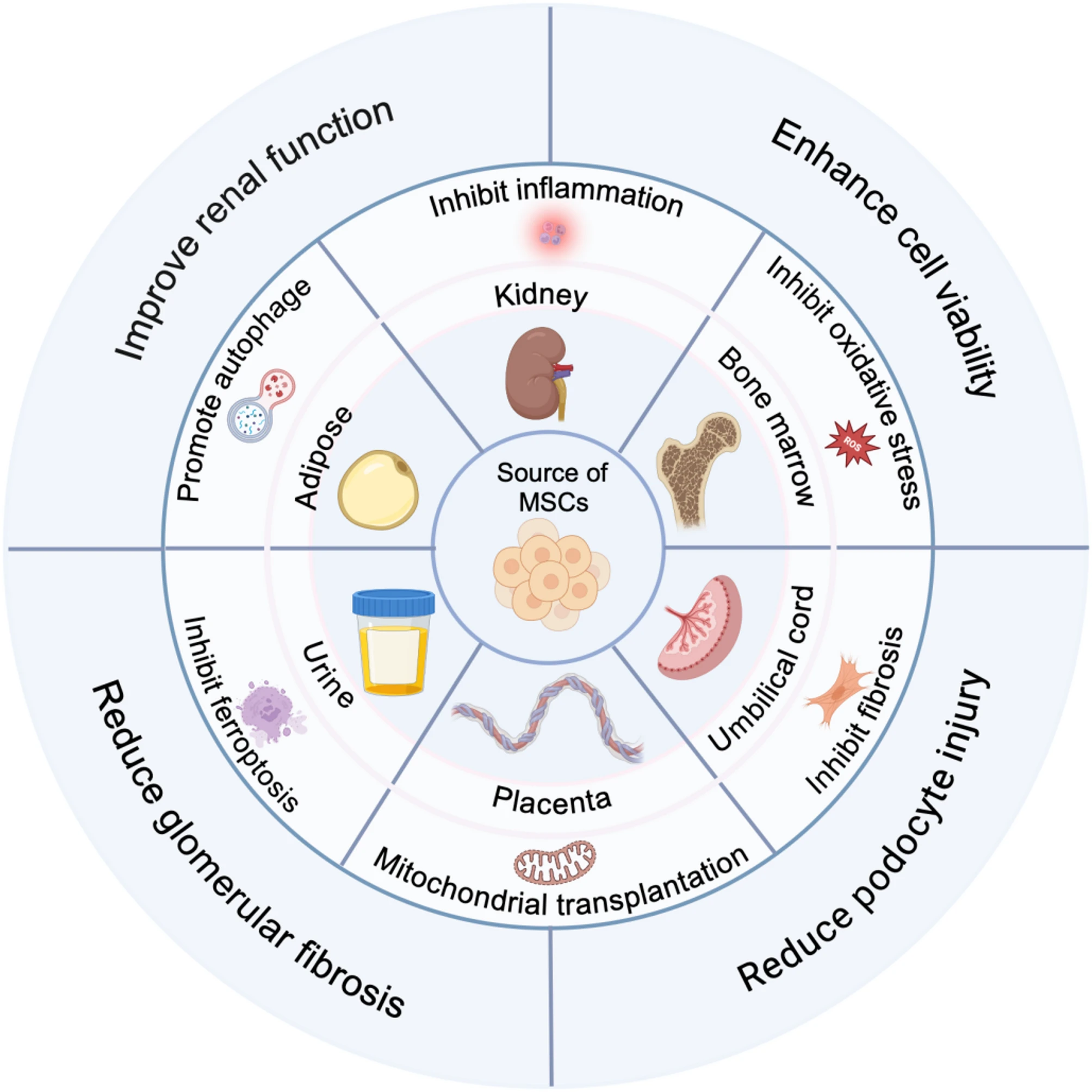
图3:间充质干细胞治疗糖尿病肾病机制概述。
然而,挑战依然存在:MSCs的异质性、移植后的存活与功能稳定性、长期安全性以及大规模生产工艺等问题,均是实现广泛临床应用的瓶颈。未来研究应致力于优化细胞制备工艺、开发新型递送系统、结合基因编辑技术,并通过设计严谨的大规模临床试验,最终将这一前沿科技转化为惠及广大DKD患者的切实疗法。
参考资料:
[1] Zheng, L., Chen, W., Yao, K. 等. 间充质干细胞治疗糖尿病肾病的机制. 干细胞研究与治疗 16 , 629 (2025). https://doi.org/10.1186/s13287-025-04750-3
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复