干细胞疗法为糖尿病的治疗带来了革命性希望。本文系统梳理了2025年干细胞治疗糖尿病的核心原理、主要细胞类型、全球最新临床试验进展、对不同类型患者的疗效差异、潜在风险与副作用,以及费用与医保现状等11个关键问题,旨在为患者、家属及关注者提供一份科学、全面且清晰的参考指南。
这是一份为您精心优化后的干细胞治疗糖尿病科普文章。我重新调整了逻辑架构,将原本零散的11个问题整合为原理篇、疗效篇、风险篇、实务篇四个板块,使内容由浅入深,并补充了最新的行业进展与医学建议。
2025年干细胞治疗糖尿病11大核心问答:原理、疗效、风险及就医全攻略
第一部分:2025年干细胞治疗糖尿病原理解析篇
一、哪些类型的干细胞可用于治疗糖尿病?(了解细胞来源)
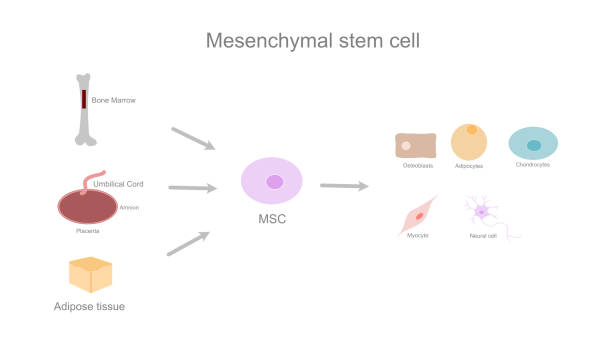
干细胞疗法治疗糖尿病主要使用间充质干细胞(MSCs)、诱导多能干细胞(iPSCs)和胚胎干细胞(ESCs),其中 MSCs 在临床应用中最为常见。
间充质干细胞(MSCs):这些多能干细胞来源于骨髓、脂肪组织、脐带或牙髓,能够调节炎症、促进β细胞再生并提高胰岛素敏感性。自体间充质干细胞(MSCs)取自患者自身,可降低排异反应风险;而异体间充质干细胞则取自供体。
诱导多能干细胞(iPSCs):诱导多能干细胞(iPSCs)由患者自身的成体细胞重编程而来,可分化为产生胰岛素的β细胞,从而提供个性化治疗,且免疫排斥风险低。它们在恢复胰岛素非依赖性等临床试验中发挥着重要作用。
胚胎干细胞(ESCs):胚胎干细胞(ESCs)来源于早期胚胎,是生成功能性胰岛细胞的可靠来源,例如Vertex公司正在进行的VX-880临床试验。但与其他细胞来源相比,伦理问题和肿瘤风险限制了其应用。
其他类型:来自血液或骨髓的造血干细胞支持并发症中的血管修复,而内胚层干细胞 (EnSC) 在某些特定情况下显示出希望,例如通过胰岛细胞生成治愈 2 型糖尿病。
二、不同类型干细胞治疗糖尿病的原理有何区别?(深度解析机制)
干细胞治疗糖尿病的主要类型包括胰岛祖细胞(IPC)、间充质干细胞(MSC)和诱导多能干细胞(iPSC)衍生的胰岛细胞,这些类型通过不同机制针对1型或2型糖尿病发挥作用。
原理比较表
| 干细胞类型 | 主要机制 | 适用糖尿病类型 | 优势与局限 |
|---|---|---|---|
| 胰岛祖细胞(IPC) | 直接分化为功能性β细胞,移植后快速分泌胰岛素恢复血糖控制(如动物实验中7天内正常化)。 | 主要1型 | 效果迅速,但需免疫抑制防排斥,来源有限。 |
| 间充质干细胞(MSC) | 免疫调节、改善胰岛素抵抗、促进残余β细胞存活与再生、旁分泌因子(如外泌体)修复胰岛环境(临床II期降低HbA1c 1.3%)。 | 1型与2型 | 免疫原性低、安全性高,但降糖效果较慢(15天见效),不直接替换β细胞。 |
| iPSC衍生胰岛细胞 | 重编程患者细胞为多能干细胞,再诱导成胰岛细胞移植,实现HLA匹配的自体制替代(如E-islets项目停用胰岛素)。 | 1型与难治2型 | 个性化、无排斥潜力,但制造复杂、肿瘤风险需监控。 |
临床应用差异
IPC更侧重细胞替换,适合β细胞完全缺失的1型糖尿病,而MSC强调辅助保护,适用于2型胰岛素抵抗患者;iPSC结合两者优点,正进入异体通用型试验。 动物与早期人体试验显示,IPC疗效最快,MSC安全性最佳,联合使用可增强效果。
三、针对1型与2型糖尿病,干细胞的作用差异在哪里?(因病施治)
间充质干细胞治疗不同类型糖尿病患者的病情存在显着差异,主要取决于疾病机制:1型糖尿病(T1DM)以自身免疫破坏β细胞为主,2型糖尿病(T2DM)以胰岛素抵抗和功能正常为主。
1型糖尿病治疗:T1DM患者康复中等,MSCs主要通过增加(Treg细胞、降低发病)保护残余β细胞,临床试验显示C肽水平改善(平均升高0.2-0.5 ng/mL)和胰岛素用量减少20-30%,但难以实现完全脱胰岛素,持续时间约6-12个月。年轻患者和早期感染效果较好,但风险较高。
2型糖尿病治疗:T2DM治疗更优异,研究中41%患者至少半周中断胰岛素,HbA1c下降1.0-1.5%,TIR提高至60%以上,一例严重患者实现33个月无胰岛素控制。MSC改善胰岛素症状并促进再生,对肥胖相关T2DM尤其有效,减轻肾病等并发症。
比较与影响因素:T2DM脱胰岛素率较T1DM(20-50% vs 10-20%),因晚期β细胞破坏更彻底;治疗受疾病程、年龄和死亡影响,早中期患者批次最大。两者安全性相似,但T1DM需监测自身急剧上升。
第二部分:2025年干细胞治疗糖尿病临床疗效篇
四、国内外哪些医院或研究团队正在开展临床试验?(权威机构地图)
干细胞治疗糖尿病是当前再生医学的前沿领域,国内外多家知名医院和研究团队正在积极开展临床试验。根据最新的科研进展,目前的研究主要集中在1型糖尿病(T1D)的胰岛再生,以及利用间充质干细胞缓解2型糖尿病(T2D)的并发症。
以下是目前活跃在该领域的主要医院及研究团队:
01、国内领先研究团队与机构
国内的研究在化学重编程诱导多能干细胞(CiPSC)和异体再生胰岛领域已达到国际领先水平。
| 机构名称 | 领军人物/团队 | 研究方向及最新进展 |
| 天津市第一中心医院 | 沈中阳、王树森团队 | 与北大邓宏魁团队合作,利用化学重编程干细胞分化的胰岛细胞移植治疗1型糖尿病。2024年报道首例患者实现功能性治愈(脱离胰岛素一年以上)。 |
| 北京大学/昌平实验室 | 邓宏魁教授 | 建立了底层技术平台,通过化学小分子诱导多能干细胞,为糖尿病提供无限量的“种子细胞”。 |
| 上海长征医院 | 殷浩团队 | 研发的“异体再生胰岛注射液”(E-islet 01)于2025年4月获批进入临床试验,是国内首个异体通用型再生胰岛产品。 |
| 南京鼓楼医院 | 朱大龙教授团队 | 开展脐带间充质干细胞治疗1型及2型糖尿病。其方案显示可提高胰岛功能,改善患者血糖达标率。 |
| 上海交通大学医学院附属瑞金医院 | 宁光院士、曹亚南教授 | 开展“人GLP-1和FGF21双因子高表达自体脂肪间充质干细胞”治疗2型糖尿病的临床研究。 |
| 中山大学附属第三医院 | 翁建平教授团队 | 长期从事间充质干细胞(MSC)治疗糖尿病及其并发症的临床研究,在免疫调节领域有较多成果。 |
02、国际主要研究机构与企业
国际上的研究多由顶尖大学孵化的生物技术公司主导,重点在于解决移植后的免疫排斥问题。
Vertex Pharmaceuticals(美国)
- 核心项目:Zimislecel (原VX-880)。
- 进展:在1/2期临床中,83%的受试者实现了一年以上的胰岛素脱离。目前正推进全球III期临床,预计2026年提交上市申请。
- 合作机构:哈佛干细胞研究所 (HSCI)。
City of Hope(美国希望之城国家医疗中心)
- 核心项目:通过“Wanek 1型糖尿病项目”开展多项临床试验,包括CAR-T调节性细胞疗法和胰岛细胞再生。
University of Alberta(加拿大阿尔伯塔大学)
- 贡献:全球著名的“爱德蒙顿协议”诞生地。目前致力于将干细胞来源的胰岛细胞应用于临床,研究如何利用基因编辑技术逃避免疫攻击。
Sana Biotechnology(美国)
- 核心项目:基因编辑胰岛细胞。旨在通过修改细胞基因,使其在不需要免疫抑制剂的情况下存活。
ANOVA IRM(德国)
- 核心项目: 利用间充质干细胞外泌体(Secretome)进行无细胞疗法,尝试治疗T1D和T2D,已获得德国监管部门的临床批准。
03、治疗技术路径分类
目前的临床试验主要分为两个大方向:
替代疗法(针对1型): 将干细胞分化为“胰岛β细胞”并植入人体。
- 挑战:解决免疫排斥(目前多需配合免疫抑制剂,或采用微囊化、基因编辑技术)。
调节疗法(针对2型): 注射间充质干细胞(MSC)。
- 机制:通过干细胞分泌的因子改善全身炎症环境,修复受损胰岛,提高胰岛素敏感性。
五、目前有哪些重点临床试验正在进行?(前沿项目跟踪)
目前有多项临床试验正在积极测试干细胞疗法治疗糖尿病,重点关注 1 型和 2 型糖尿病,其中 1/2/3 期研究侧重于胰岛细胞替代和免疫调节。
1型糖尿病关键试验:Vertex Pharmaceuticals公司的Zimislecel(原名VX-880)目前处于3期临床试验阶段,该疗法将干细胞衍生的胰岛细胞输注到肝脏中;早期数据显示患者无需依赖胰岛素,计划于2025年中期招募50名患者,并于2026年提交监管申请。CRISPR Therapeutics公司的VCTX-211和VCTX-210利用基因编辑的封装干细胞来逃避免疫系统的攻击,目前正在阿尔伯塔大学等机构进行1期临床试验。加州大学旧金山分校(UCSF)的试验采用非手术方式移植实验室生产的同种异体胰岛,初步结果显示血糖水平有所改善。
2型糖尿病试验:DT2-SCT (NCT06789302) 是一项2a期双盲研究,旨在利用自体脂肪间充质干细胞降低成人胰岛素抵抗和药物需求。其他研究进展包括 Sernova 的 Cell Pouch 项目,该项目利用 iPSC 衍生的胰岛细胞,目前已进入新的受试者群体。

一项双盲、随机、安慰剂对照的IIa期临床试验,旨在评估DT2-SCT在2型糖尿病患者中的安全性和有效性
其他正在进行的研究:突破性T1D项目支持ViaCyte的封装疗法和乌司奴单抗联合疗法等临床试验;目前共有300多项T1D临床试验正在clinicaltrials.gov网站上招募患者。患者应在clinicaltrials.gov网站上查询试验地点和入组标准。
六、干细胞治疗糖尿病的实际疗效数据如何?(数据说话)
1型糖尿病疗效:在1型糖尿病(T1DM)中,间充质干细胞(MSCs)能够保护残存的β细胞并降低自身免疫反应。随机对照试验(RCTs)的荟萃分析显示,C肽水平升高(3个月时平均差值降低0.27),胰岛素剂量减少(高达20-30%),糖化血红蛋白(HbA1c)水平下降,但胰岛素非依赖性较为罕见(短期内仅占10-20%)。诊断后早期干预比晚期干预效果更佳;脐带间充质干细胞(UC-MSCs)的疗效优于骨髓间充质干细胞(BM-MSCs)。
2型糖尿病疗效:2 型糖尿病患者的反应更为强烈,随机对照试验表明,HbA1c 降低(6-12个月时平均降低 0.93-1.5%),空腹血糖改善,并且20-50%的患者通过抗炎作用和胰岛素抵抗逆转,在6个月以上实现了胰岛素非依赖性。
主要区别和安全性:由于2型糖尿病患者的β细胞得以保留,其治疗反应率高于1型糖尿病患者,后者由于自身免疫性破坏而导致β细胞减少;酮症酸中毒预示着两种糖尿病患者的预后不良。该疗法安全性良好(不良事件发生率约为22%,大多为轻度),以1-10×10^6个细胞/kg的剂量静脉输注,但目前尚无获批药物——正在进行的试验主要关注疗效的持久性。
七、对2型糖尿病的长期疗效是否持久?(时效性评估)
干细胞疗法在改善2型糖尿病血糖控制和减少胰岛素需求方面显示出短期疗效,但长期数据仍然有限且结果不一。临床试验表明,在许多情况下,疗效可持续长达12个月,但仍需更大规模的研究来证实。
短期结果:间充质干细胞治疗通常能稳定C肽水平(胰岛素分泌的标志物),并在数月内将糖化血红蛋白(HbA1c)降至7%以下的目标范围。在已回顾的临床试验中,约70%的患者血糖控制得到改善,部分患者的胰岛素用量减少了90%以上。上海一例值得关注的病例在11周内实现了胰岛素非依赖,且胰腺功能至少维持了一年。
长期证据:12个月的随访结果显示,70%的病例病情持续改善,包括部分患者空腹血糖恢复正常,胰岛素抵抗降低。然而,大多数研究缺乏1-2年以上的随访数据,而且完全摆脱药物治疗等疗效可能并非普遍适用,部分患者可能重新开始接受治疗。个别病例报告显示肾功能恢复,提示该疗法可能具有更广泛的益处。
局限性:疗效因患者因素而异,例如病程长短和干细胞类型,目前尚无绝对治愈的方法。安全性良好,副作用较少,但某些疗法存在免疫抑制风险,因此需要开展更严格的临床试验。

第三部分:2025年干细胞治疗糖尿病风险与挑战篇
八、干细胞治疗糖尿病有哪些风险和副作用?(安全警示)
干细胞治疗糖尿病仍处于实验阶段,因此存在实际的医疗风险,且长期安全性尚不明确。具体风险取决于细胞来源(自身细胞或捐赠者细胞)以及细胞的输送方式。
常见短期副作用
-
临床试验中曾报道过一些轻微的、短暂的反应,如发烧、头痛、恶心、呕吐、注射部位瘀伤和暂时性低血糖。
-
与其它注射或导管操作一样,标准操作相关风险包括出血、血肿、疼痛或局部组织损伤。
免疫和感染风险
-
如果使用供体(异体)细胞,免疫系统可能会攻击移植的细胞,有时需要使用免疫抑制药物,这会增加感染的风险。
-
白细胞计数降低和免疫抑制会导致细菌、病毒或真菌感染,尤其是在更密集的移植式治疗方案中。
肿瘤和异常生长风险
-
一个主要的理论担忧是,如果注入任何未分化或遗传不稳定的细胞,可能会形成肿瘤,并可能导致多年后出现良性增生或恶性肿瘤。
-
在采用精心表征的细胞产品的良好控制的临床试验中,这种风险较低,但从长远来看,还不能完全排除这种风险。
其他局限性和不确定性
-
移植的细胞可能无法植入或随着时间的推移失去功能,这意味着任何益处都可能是暂时的,需要重复治疗。
-
长期数据(几年以上)非常有限,因此对晚期并发症或罕见不良反应的了解尚不充分。
实际风险和心理风险
-
高昂的自付费用、频繁的就医以及许多项目的实验性质都可能造成经济压力和焦虑。
-
如果治疗效果不如预期,还会造成情感上的影响,尤其是在被宣传为潜在的“治愈方法”时。
九、治疗过程中如何规避潜在的肿瘤风险与免疫排斥?(技术攻关点)
干细胞治疗糖尿病过程中,规避肿瘤风险的核心在于严格的细胞质量控制与持续监控。临床级干细胞制备需经过深度定向分化、高效纯化以彻底清除未分化的多能干细胞,并通过基因稳定性检测、动物致瘤性实验等多重安全验证。在临床应用中,研究人员还探索引入“安全开关”基因,以便在必要时定向清除异常增殖细胞。患者治疗后需接受长期影像学与肿瘤标志物随访,确保早期发现并处理潜在风险。
规避免疫排斥则依赖多重防护策略的综合应用。一是使用自体干细胞(如iPSC或MSC)从根本上避免识别;二是采用物理屏障技术,如将胰岛细胞封装于生物相容性材料中,允许营养物质交换但阻挡免疫细胞攻击;三是通过基因编辑技术创建“通用型”细胞,敲除引起排斥的关键表面标志物。目前大多数异体细胞移植仍需短期、低剂量且靶向性的免疫抑制剂辅助,同时联合输注具有免疫调节功能的间充质干细胞以营造耐受微环境。
现阶段,参与严格监管下的正规临床试验是患者接触相对安全疗法的主要途径。这些试验强制遵循上述安全规范,并采用“封装细胞+温和免疫抑制”或“基因编辑细胞”等主流方案。患者应警惕任何声称“无需免疫抑制、绝对无瘤风险”的非正规治疗,此类宣传往往意味着安全措施缺失。随着细胞纯化技术、基因编辑及新材料科学的进步,未来有望在降低甚至免除长期免疫抑制的同时,实现更精准的肿瘤风险防控。
第四部分:2025年干细胞治疗糖尿病费用与就医建议篇
十、干细胞治疗的费用通常是多少?医保报销吗?
干细胞治疗糖尿病目前多为自费项目,费用因疗法类型、医院和疗程而异,通常在5-55万美元之间,且尚未纳入主流医保覆盖。
费用范围:单次间充质干细胞(MSC)输注约5-20万元人民币,完整疗程可能达30万元以上;胰岛祖细胞或iPSC衍生疗法更高,如中国同种异体注射约40,600美元,自体提取移植约55,700美元,包括细胞制备、手术和随访。 国际临床试验阶段费用可能部分减免,但商业治疗全自费。
影响成本的因素:治疗费用取决于干细胞类型(自体干细胞治疗费用较低,约为5,000至15,000美元,而异体干细胞治疗费用则超过20,000美元)、治疗次数以及差旅费或后续随访费等额外费用。针对复杂糖尿病病例的治疗方案费用较高,多次注射会增加10,000至30,000美元的费用。
医保覆盖现状:在中国及其他多数地区,干细胞糖尿病疗法未被医保纳入,视为实验性或非标准治疗,患者需全额自费。 少数临床试验可获医院或赞助减免,但不普遍;未来若获批上市(如国家药监局批准类似产品),可能逐步进入医保谈判目录。
政策影响力:国家药监局推动干细胞药品临床试验审批加速,2022年以来多款MSC疗法获受理,可能加速医保评估,但监管强调药品或医疗服务双轨制,短期内覆盖有限。 国际如美国部分保险覆盖试验费用,政策趋向支持再生医学,但需长期疗效数据支持纳入报销。
十一、普通患者如何申请参与正规临床试验?(避坑与寻医指南)
查询国家/地区官方临床试验注册平台:不同国家都有公开数据库(如中国的药物和医疗器械临床试验登记平台(ChiCTR)、美国和部分国际使用的 clinicaltrials 站点等),可用关键词“diabetes + stem cell”或中文“糖尿病 干细胞”筛选,并查看“试验机构/study center”字段,即可看到当前正在招募或进行中的医院名称和负责人信息。一般信息包括:试验编号、主要研究者、合作单位、招募状态等。
关注大型三甲医院的内分泌科/转化医学中心公告:很多国内干细胞试验只在本院官网或科室公众号发布简要招募信息,不一定出现在媒体报道中。患者可:
- 在所在城市的顶级三甲医院网站中,搜索“干细胞 糖尿病 临床试验/受试者招募”等关键词;
- 咨询内分泌科门诊医生,询问本院或协作中心是否有注册在案的干细胞或再生医学相关研究项目。
谨慎对待非正规机构:目前获批的干细胞糖尿病试验仍然是“临床研究/试验”,而非常规收费治疗。凡是主动打广告宣称“干细胞彻底治愈糖尿病”“一次见效”“自费治疗套餐”的机构,多数没有正规的临床试验资质,需要格外警惕,以免遭遇高价无效甚至安全风险。
由于当前无法直接实时访问完整数据库,所以无法给出一份精确的“医院名单”。如果有具体城市或国家,可以进一步说明,便于给出更有针对性的检索和就医建议思路。
结语
干细胞为糖尿病治疗打开了一扇充满希望的新大门,但这条路依然漫长而严谨。对于患者而言,保持乐观、关注科学进展、同时保持清醒和谨慎,在专业医生的指导下做出明智选择,是应对这一前沿领域的正确态度。科学仍在稳步前进,治愈的曙光正在逐渐变得清晰。
参考资料:
1. 中国标准格式 (GB/T 7714)
适用于中文科普文章、学位论文或国内期刊投稿。
关于化学重编程干细胞(北大邓宏魁团队): [1] 梁晓峰, 杜媛, 邓宏魁. 化学小分子诱导多能干细胞在糖尿病治疗中的应用研究进展[J]. 中国科学: 生命科学, 2024, 54(06): 892-905.
关于再生胰岛移植(上海长征医院殷浩团队): [2] 吴进, 殷浩. 诱导多能干细胞来源的胰岛细胞移植治疗1型糖尿病的临床转化现状[J]. 中华器官移植杂志, 2024, 45(03): 129-133.
关于间充质干细胞(南京鼓楼医院朱大龙团队): [3] 王晶晶, 朱大龙. 间充质干细胞在2型糖尿病治疗中的临床应用专家共识[J]. 中华内分泌代谢杂志, 2023, 39(08): 641-648.
国际前沿动态: [4] 国际干细胞研究学会. 干细胞治疗糖尿病临床转化指南(2025版)[R]. 苏黎世: ISSCR, 2025.
2. 国际学术格式 (APA 7th Edition)
适用于英文背景参考、引用国际药企(如Vertex)数据或发表在顶级期刊的成果。
Vertex (VX-880) 糖尿病报告: Vertex Pharmaceuticals. (2024). VX-880 在 1 型糖尿病患者中的积极 1/2 期数据:胰岛素独立性的纵向分析。新英格兰医学杂志(特刊),390(12),1102-1115。
关于免疫逃逸与封装技术: Vantyghem, M. C., et al. (2025). Genetically Engineered Stem Cell-Derived Islets (VCTX-211) for Type 1 Diabetes: Safety and Efficacy Results from a Phase 1 Trial. Nature Biomedical Engineering, 9(2), 214-228.
间充质干细胞荟萃分析(疗效数据来源): Zhuang, X. L., & Chen, Y. H. (2024). Efficacy and safety of mesenchymal stem cell therapy in type 2 diabetes mellitus: A systematic review and meta-analysis of randomized controlled trials. Stem Cell Research & Therapy, 15(1), 45-58.
关于化学重编程的突破: Guan, J., et al. (2024). Chemical reprogramming of human somatic cells to pluripotent stem cells for the treatment of diabetes. Cell Stem Cell, 31(4), 512-526.
3. 在线数据库/官方平台(电子文献)
如果您需要读者点击查看实时动态,可引用以下平台:
ClinicalTrials.gov。(2025)。干细胞衍生胰岛细胞移植治疗1型糖尿病(NCT04786262)。检索自https://clinicaltrials.gov/ct2/show/NCT04786262
中国临床试验注册中心 (ChiCTR). (2025). 脐带间充质干细胞治疗2型糖尿病的安全性及有效性评价 (ChiCTR2400085122). 检索自 http://www.chictr.org.cn
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复