
结果表明,A9-DPC移植12个月后,停药后运动障碍协会统一帕金森病评定量表 (MDS-UPDRS) III部分评分和Hoehn和Yahr分期均有所改善,且高剂量组的运动功能改善更显著。此外,多巴胺转运体经过正电子发射断层扫描 (PET) 成像显示移植后壳核摄取增加,且高剂量组的摄取量更高,支持移植物存活。这些结果表明双侧A9-DPC移植是安全的,并可能改善帕金森病患者的帕金森病运动症状。
帕金森病的核心问题与当前治疗局限
帕金森病是一种进行性神经退行性疾病,其核心病理特征是大脑黑质区特定多巴胺能神经元的选择性、不可逆丧失,导致调控运动的关键区域——纹状体出现多巴胺严重耗竭,从而引发震颤、僵直和运动迟缓等典型运动症状。

现有的标准疗法,如药物治疗和脑深部电刺激,主要通过外源性补充多巴胺或调节神经回路来缓解症状,但它们都无法阻止或逆转多巴胺神经元的持续死亡,属于治标不治本的对症处理,且长期应用常伴随疗效波动和运动并发症。
破局之道:细胞替代疗法与胚胎干细胞治疗帕金森病的潜力
面对这一困局,基于“细胞替代”思路的治疗策略应运而生。该疗法旨在通过移植健康细胞,直接“替换”已死亡的神经元,从根源上修复神经环路。早期的胎儿组织移植虽验证了这一概念的可行性,却受困于伦理争议、来源稀缺及细胞异质性等瓶颈。
人多能干细胞,尤其是人胚胎干细胞(hESC)技术的发展,为突破这些瓶颈提供了可能。hESC拥有无限自我更新能力,能作为稳定、可规模化的细胞来源,并通过精确的诱导分化,高效生成高纯度、功能特异的多巴胺能前体细胞。本研究报道的,正是基于hESC衍生的A9-DPC在1/2a期临床试验中为期1年的安全性与探索性疗效结果。
核心技术:A9-DPC的标准化制造流程
A9-DPC的制造始于临床级hESC系(SNU-hES32)。在严格的药品生产质量管理规范(GMP)条件下,通过一个成分明确、仅使用小分子的标准化方案,将干细胞定向诱导分化为中脑多巴胺能祖细胞(mDA)。
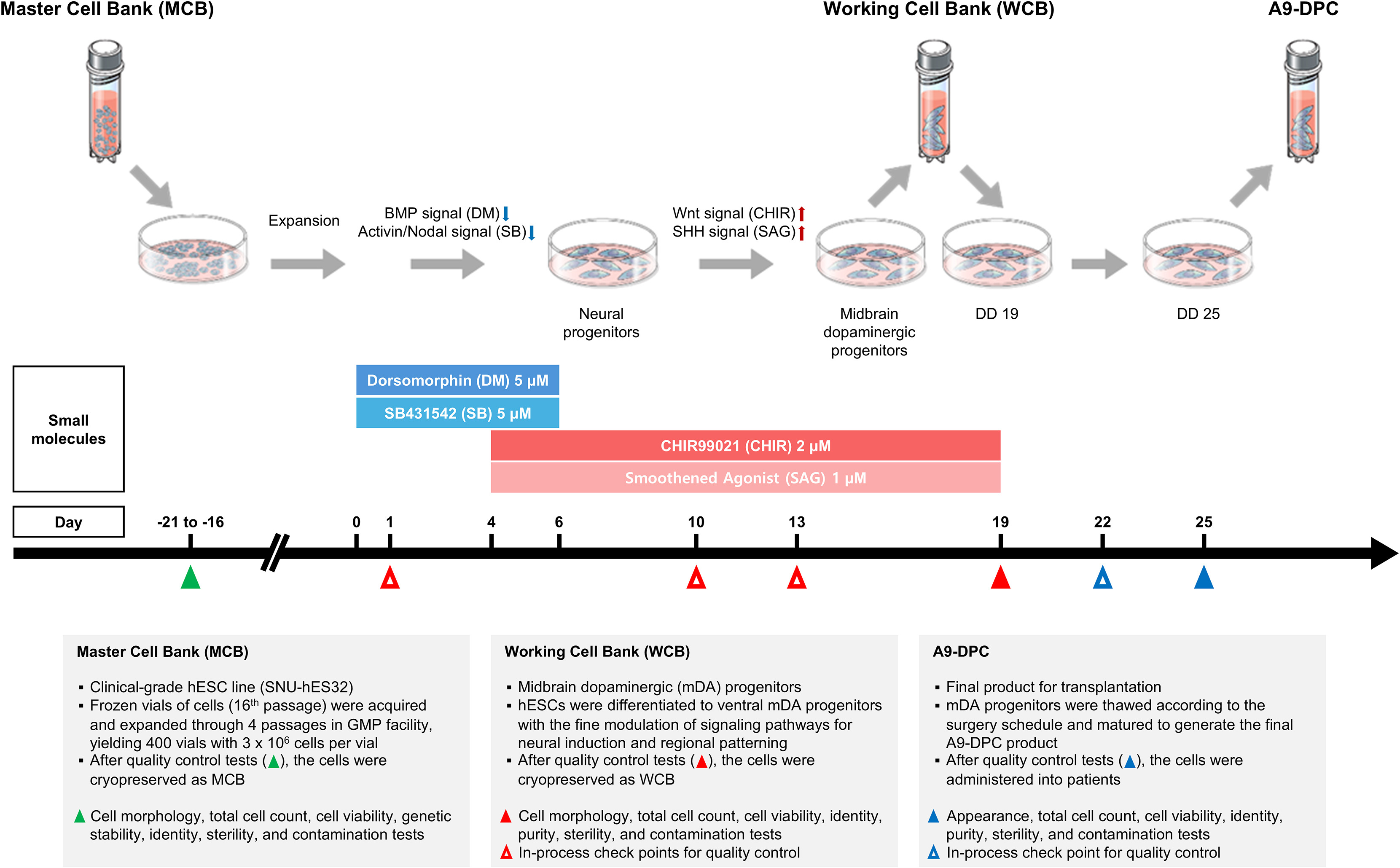
为确保持续稳定的细胞供应,在分化第19天获得的mDA祖细胞会被冷冻保存,建立工作细胞库(WCB)。需进行治疗时,细胞自WCB中解冻,并继续培养至分化第25天,成为最终的A9-DPC产品。所有批次必须通过严格的质量控制(QC),其中一批曾因支原体污染而被废弃。最终合格产品分装于小瓶,在2°C–8°C冷藏条件下运输,并在放行后36小时内完成移植。
A9-DPC治疗帕金森病的首次人体试验:患者招募与试验流程
这项1/2a期试验共招募了12名中至重度帕金森病患者。参与者被平均分为两组:低剂量组(315万个细胞,n=6)和高剂量组(630万个细胞,n=6)。所有参与者的平均年龄为60.3岁,平均病程达10.5年,确保了研究人群具有代表性且基线特征相似。
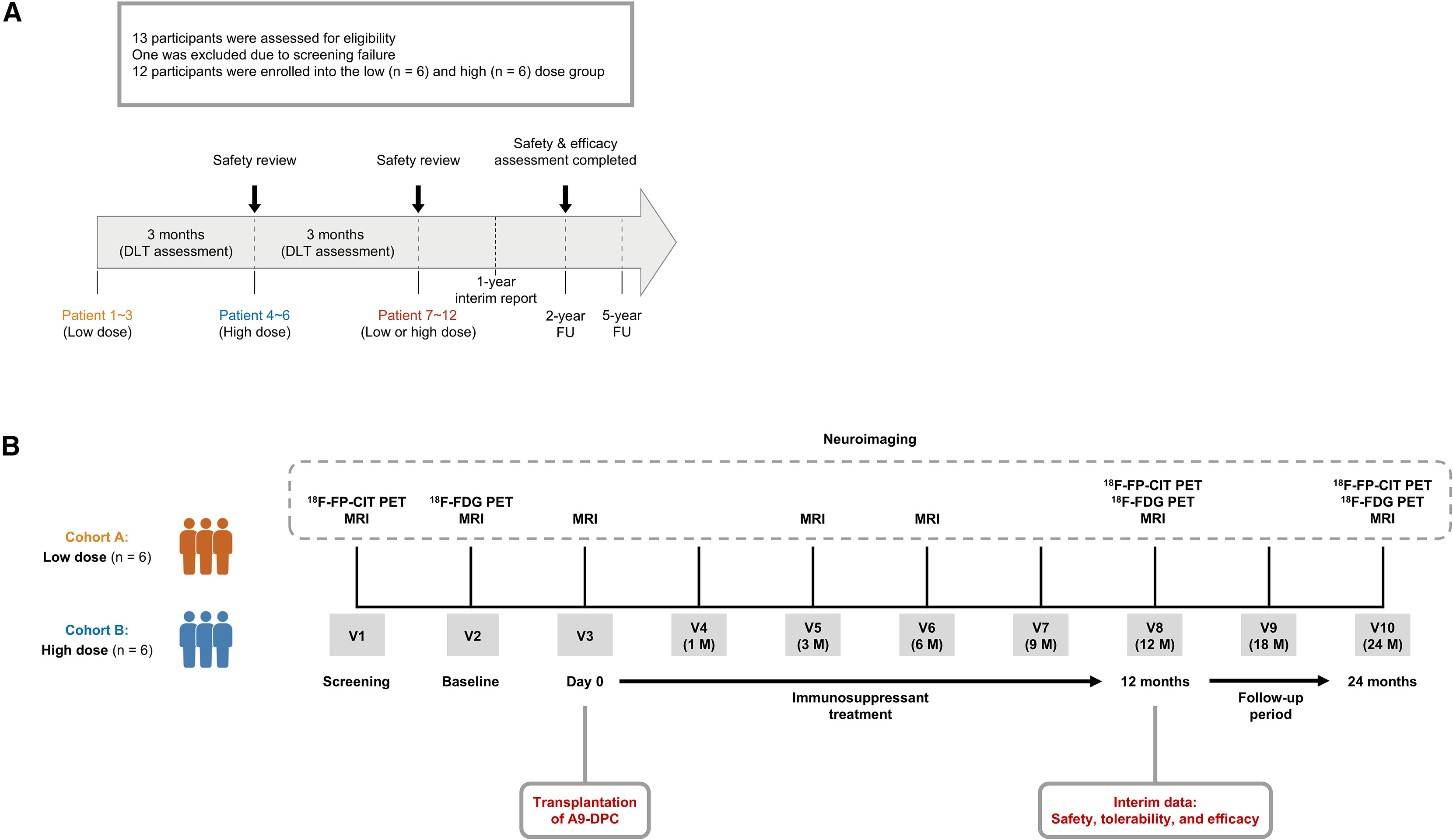
试验程序采用标准的“3+3”剂量递增设计以确保安全。首先为3名患者移植低剂量细胞,经过3个月观察,未出现剂量限制性毒性后,安全审查委员会才批准进行高剂量组移植。同样确认高剂量安全后,再扩大招募至每组6人。在整个试验期间,患者接受了全面的临床和影像学评估(包括脑MRI和特异性PET扫描),并统一接受了为期最长12个月的免疫抑制治疗,以评估移植细胞的安全性及初步疗效。
核心成果:胚胎干细胞治疗帕金森病的安全性与有效性实现双突破
1、安全性:无严重不良反应,细胞相关风险为零
在12个月的随访期内,A9-DPC移植表现出优异的安全性和耐受性。共记录的32起不良事件均被评估与细胞产品本身绝对无关。其中,仅1起为手术相关的无症状颅内出血;另有3起事件(涉及2名患者)被认为可能与免疫抑制剂有关,包括一过性高钾血症和新发糖尿病,这些情况均得到有效管理。唯一被报告的严重不良事件是一名患者的无症状血小板减少,该事件导致住院时间延长一天,但未进行特殊干预即自行缓解。
总体而言,所有12名患者中仅出现1例严重不良事件,且未确定其确切病因。最重要的是,在整个观察期内,没有任何患者出现肿瘤形成或移植物异常生长的迹象。这些数据共同表明,A9-DPC细胞治疗在帕金森病患者中具有可靠的安全轮廓。
2、有效性:运动症状显著改善,剂量依赖性明显
根据12个月的随访数据,A9-DPC移植在帕金森病患者中显示出明确的探索性疗效。最核心的改善体现在患者的“停药”运动功能上:所有参与者的主要终点指标——MDS-UPDRS第三部分(OFF)评分,平均显著改善了-14.1±6.2分(改善)(表 S3)。
更重要的是,疗效呈现出显著的剂量依赖性,高剂量组的改善幅度(-15.5分)(改善率约26%)显著大于低剂量组(-12.7分)(改善率约21%)(图3A),统计模型证实了高剂量组随时间推移有更大的改善(图3B)。另一项关键指标Hoehn和Yahr分期(OFF)也一致地显示出高剂量组更优的改善效果(表S3;图3C)。
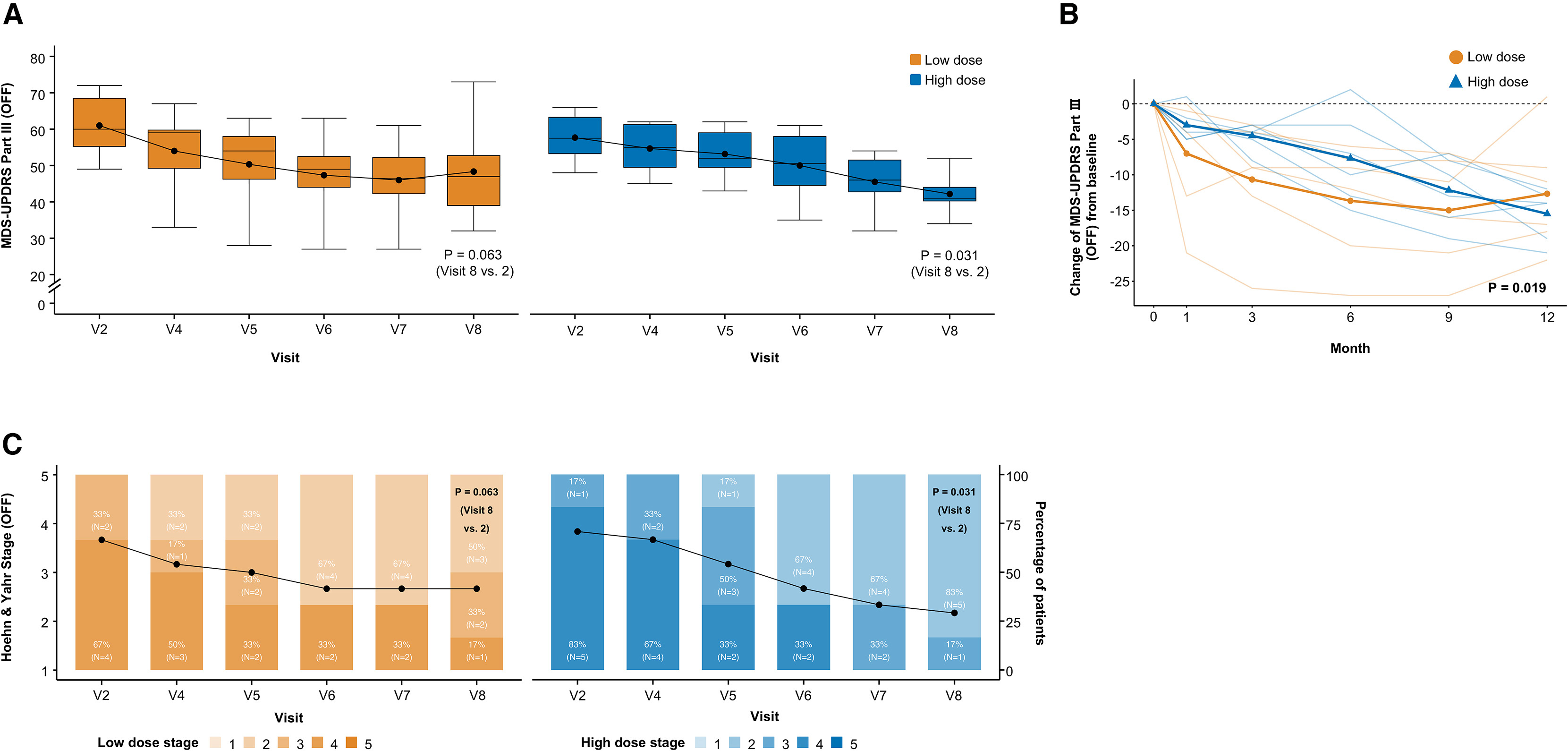
疗效表现具有高度特异性。与“停药”状态的显著改善形成鲜明对比的是,患者在“用药”状态下的运动功能未见显著变化。MDS-UPDRS第三部分 (ON) 评分的平均±SD 变化为0±4.6分(表S3)。MDS-UPDRS第三部分 (ON) 评分的平均变化在低剂量组中为-2.8±4.5分,在高剂量组中为2.8±2.6分(图S1A)。同样,对于H&Y (ON) 阶段,与基线相比,12个月时低剂量组中的平均±SD 变化为-0.2±0.4分,在高剂量组中为-0.2±0.4分(表S3;图S1B)。
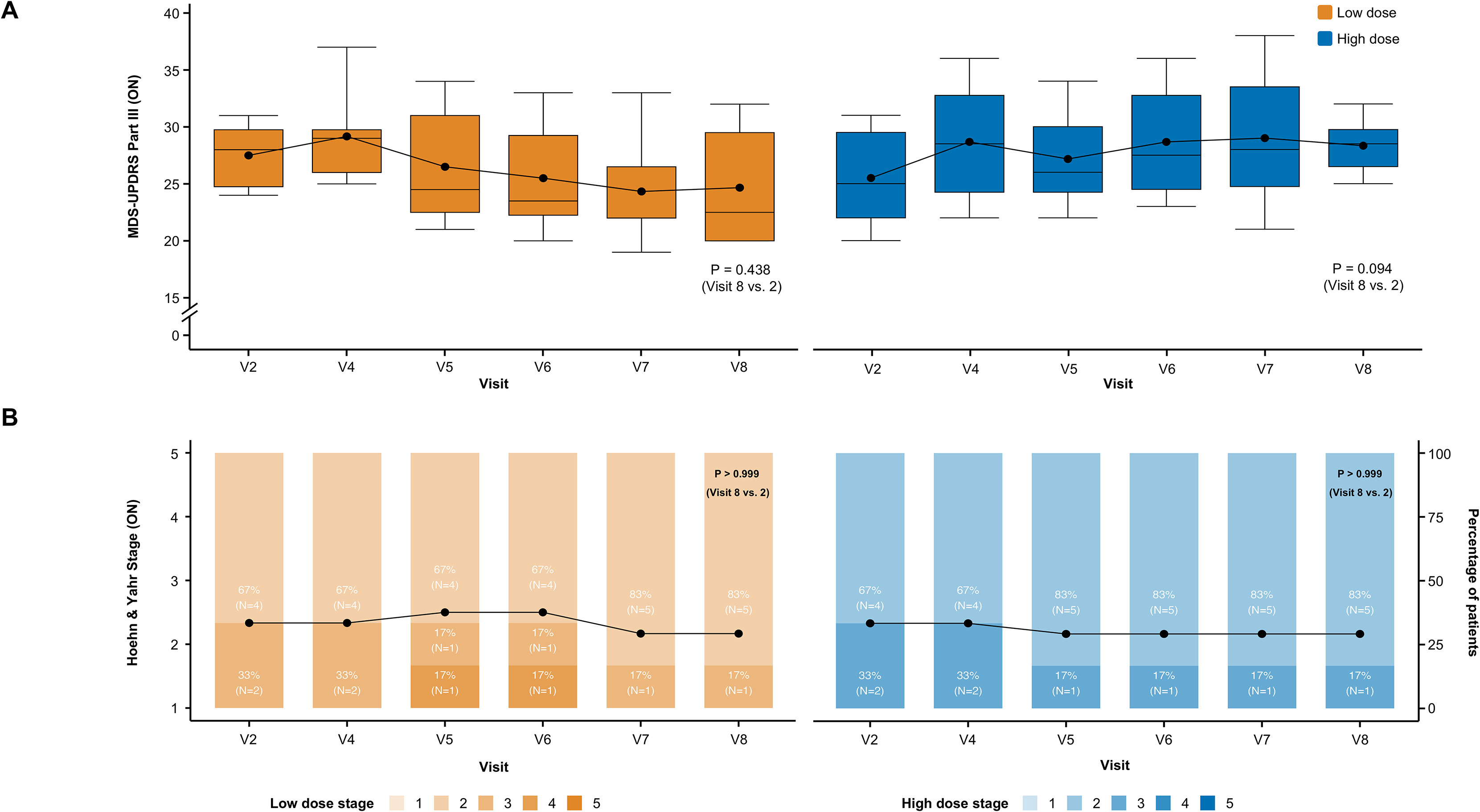
这一结果恰好符合细胞疗法的作用机制预期:移植的细胞旨在自身持续分泌多巴胺以改善药物失效期的症状,而非进一步增强药物峰值的效应。此外,疗效具有全面性,患者的日常生活活动能力、非运动症状及生活质量评分均从基线水平获得显著提升。
图S2和表S3展示了MDS-UPDRS的详细基线和12个月比较结果。低剂量组和高剂量组的MDS-UPDRS I、II、IV部分及总分均显著提高。基于帕金森病日记中16小时清醒时间,12个月时,低剂量组平均每日清醒时间从7.56小时减少至3.92小时(-3.64±2.45小时,p=0.031),高剂量组平均每日清醒时间从8.41小时减少至5.40小时(-3.01±2.05小时,p=0.031)。
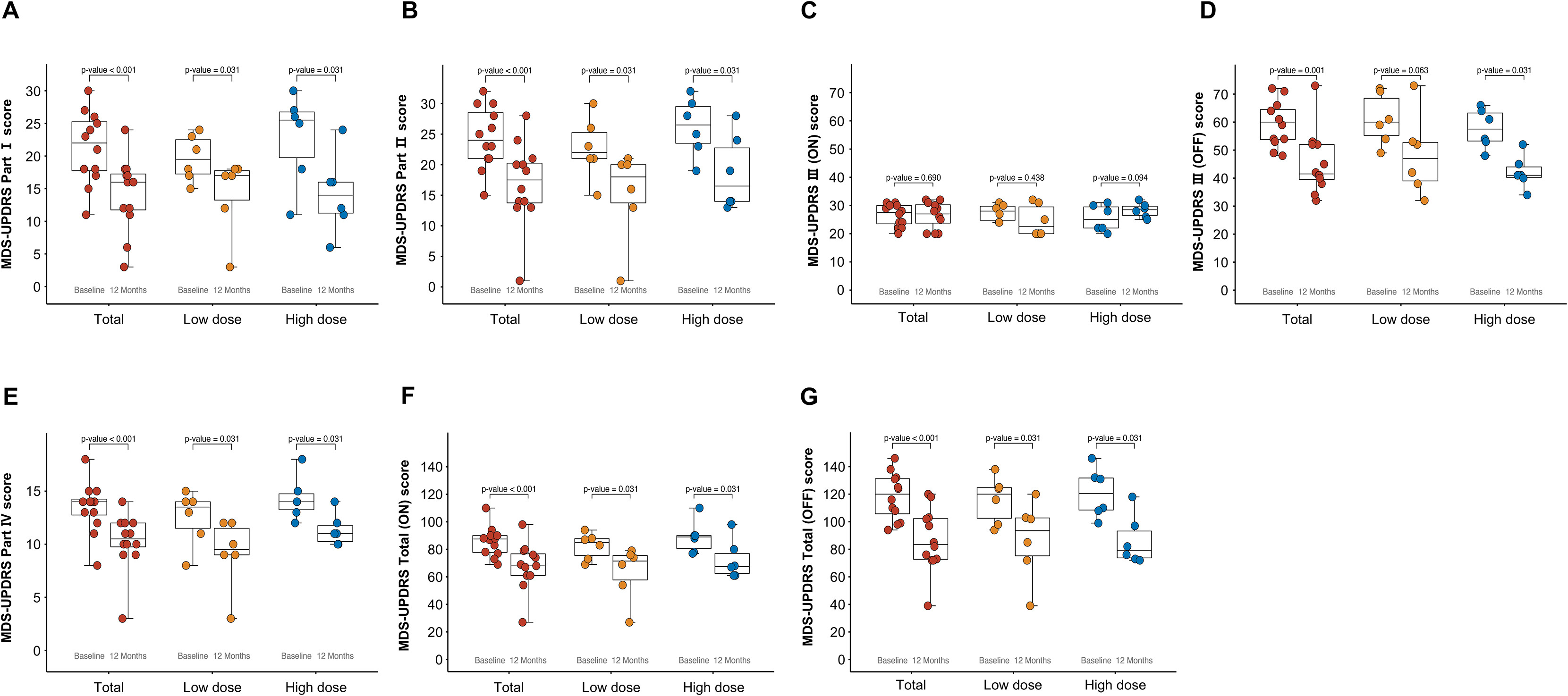
其他探索性疗效指标,包括非运动症状量表 (NMSS)、帕金森病问卷 (PDQ-39) 以及Schwab和England日常生活活动量表 (SE-ADL) 评分,在两组中也从基线到12个月有所改善(图S3A–S3F)。
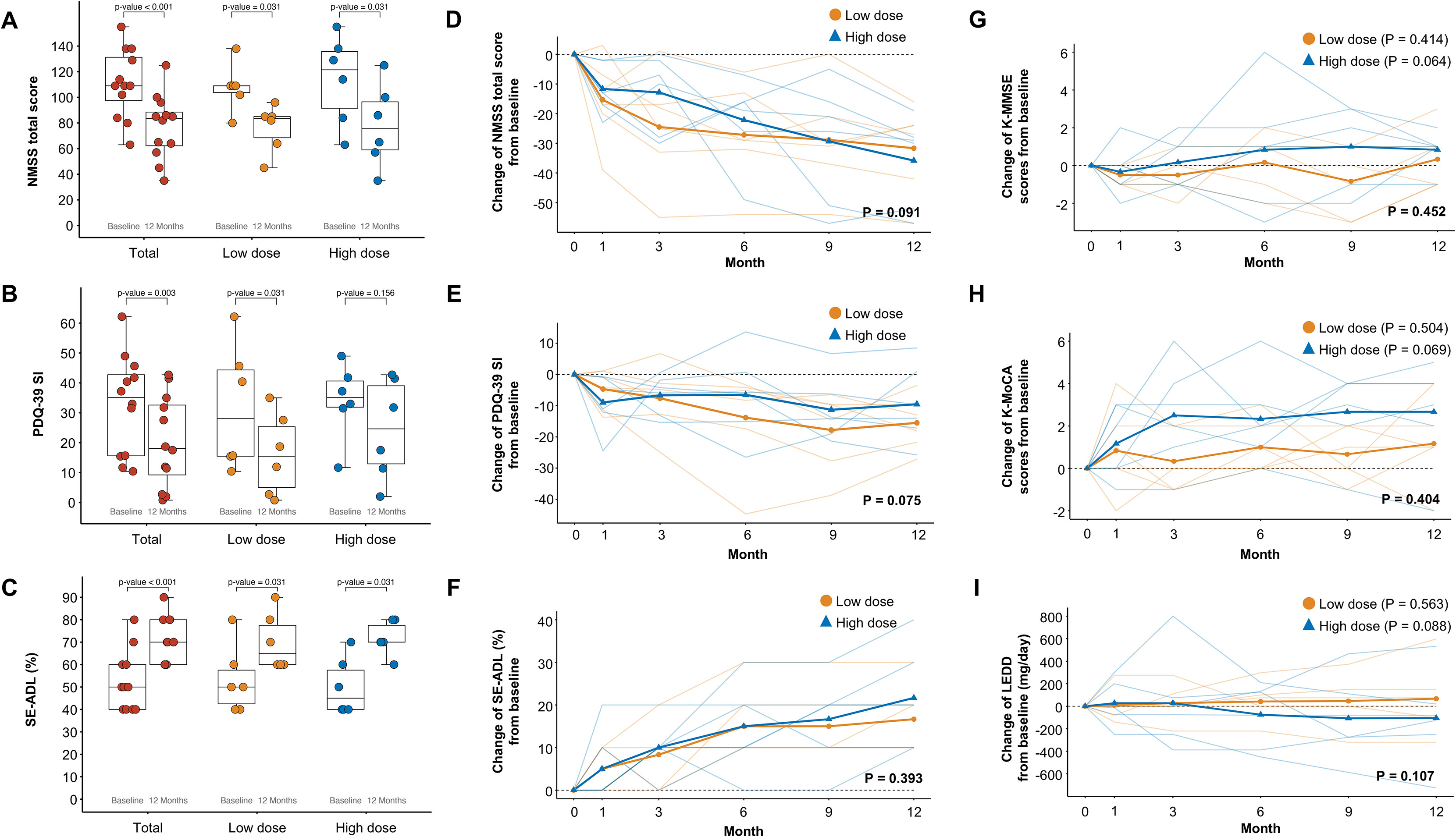
特别值得注意的是,在12个月的研究期间,尽管允许调整药物,但所有患者的左旋多巴等效日剂量保持稳定。这表明其运动功能的改善是源于细胞移植本身带来的生理性修复,而非通过增加传统药物剂量实现的。同时,认知功能在整个随访期内未受影响(说明该疗法未影响认知),进一步支持了该疗法良好的安全性特征。
关键证据:影像学证实细胞存活、整合与功能关联
安全性验证:根据术后影像学评估,人胚胎干细胞衍生的A9-DPC疗法在帕金森病患者中显示出积极结果。首先,安全性与移植准确性得到确认:脑部MRI扫描显示,移植部位未出现肿瘤或炎症迹象(图S4A和S4B),针道轨迹证实细胞被精确递送至目标区域——壳核;同时,¹⁸F-FDG PET未检测到细胞的异常增殖或迁移,共同证明了该疗法的解剖精准性和短期安全性。
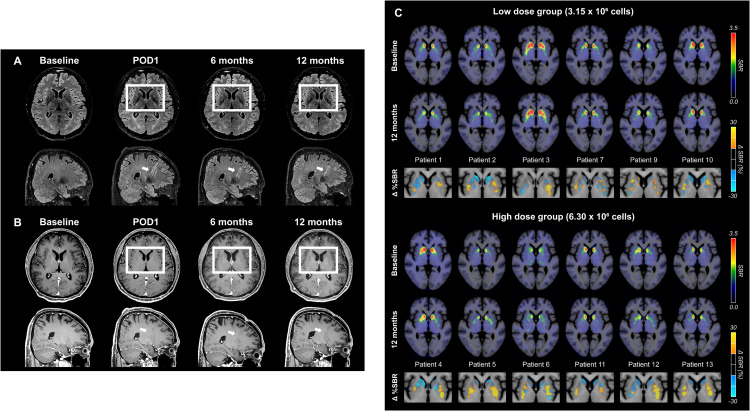
细胞存活与功能整合:在细胞存活与功能整合方面,连续的多巴胺转运体(DAT)影像(¹⁸F-FP-CIT PET)提供了关键证据。数据显示,移植后12个月,作为主要功能指标的后背壳核区的DAT特异性结合率(SBR)呈现剂量依赖性增加,高剂量组的变化尤为显著:高剂量组中位增长10.7%(p=0.041),低剂量组增长1.0%。
这一结果表明,移植的细胞不仅存活,而且成功在关键脑区建立了新的多巴胺能神经支配。
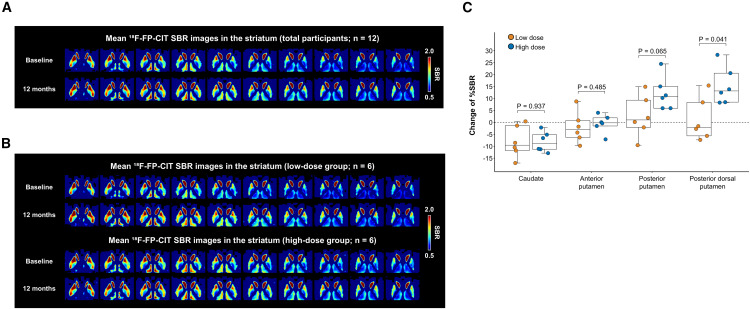
(A)纹状体中的18 F-FP-CIT SBR 图像。图中显示了所有参与者(n = 12)在基线和 A9-DPC 移植后 12 个月的平均18 F-FP-CIT SBR 的轴向图像。SBR 图像以小脑灰质为参考组织生成。SBR 的计算方法是将每个体素与参考区域的摄取值之差除以参考区域的摄取值。 (B)基线和 A9-DPC 移植后 12 个月的组平均18 F-FP-CIT SBR 图像。图中显示了低剂量组和高剂量组基线和移植后 12 个月的平均18 F-FP-CIT SBR 的轴向图像。SBR 图像以小脑灰质为参考组织生成。SBR 的计算方法是将每个体素与参考区域的摄取值之差除以参考区域的摄取值。 (C) 18 F-FP-CIT SBR的区域变化。图中显示了每个亚区域低剂量组和高剂量组从基线到 12 个月的 SBR 百分比变化。箱线图显示中位数(水平线)、IQR(箱线图)和全范围(须线图),并叠加了个体患者值。使用 Wilcoxon 秩和检验计算组间比较的p值。
机制关联:统计分析证实,后背壳核区DAT活性的提升与患者核心运动功能的改善程度呈显著正相关,为“移植细胞通过恢复多巴胺神经支配来缓解症状”提供了最直接的证据。
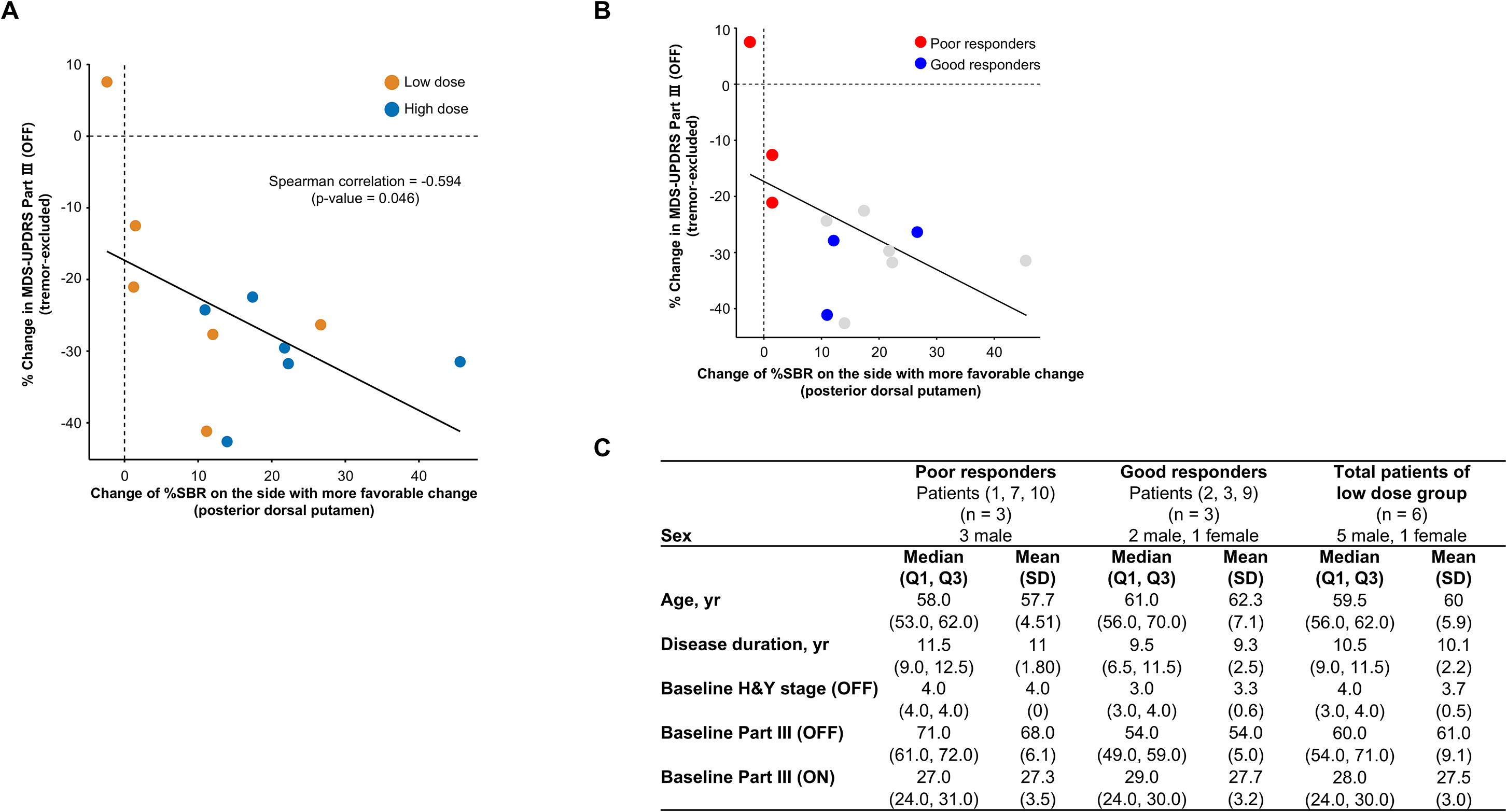
(A) 散点图显示了变化较有利侧(从基线开始)后背壳核中18 F-FP-CIT PET SBR 百分比的变化与 MDS-UPDRS 第三部分 (OFF) 评分(不包括震颤子评分)百分比变化之间的相关性( n = 12)。使用 Spearman 等级相关系数计算p值。 (B) 散点图显示变化较有利侧(与基线相比)后背壳核中18 F-FP-CIT PET SBR 百分比变化与低剂量组 ( n = 6) 中 MDS-UPDRS 第三部分 (OFF) 评分(不包括震颤分项)百分比变化之间的相关性。根据两项指标是否均显示出一致且显著的改善,将低剂量组患者分为反应不良或反应良好者。鉴于高剂量组所有患者的两项指标均显示出一致且显著的改善,我们将低剂量组 ( n = 6) 患者分为三组反应不良者(患者 1、7 和 10;标记为红色)和三组反应良好者(患者 2、3 和 9;标记为蓝色)。 (C) 使用中位数 (Q1, Q3) 和平均值 (SD) 汇总各组基线特征。各组基线年龄相当,但疗效良好患者的基线运动缺陷程度似乎较轻,这体现在较低的 MDS-UPDRS 第三部分 (OFF) 评分上。
研究意义与展望:干细胞治疗帕金森病的里程碑
这项单中心、开放标签、剂量递增的1/2a期试验表明,对于病史超过5年的中重度帕金森病患者,双侧壳核移植人胚胎干细胞衍生的A9-DPC总体安全且可耐受。
研究期间未观察到肿瘤形成、移植物过度生长、异位细胞迁移或免疫介导的炎症反应。手术操作精准,72条立体定向轨迹中仅出现1例无症状性脑出血(1.39%),与该类手术预期风险一致。
此项研究作为首个进入临床阶段的人胚胎干细胞衍生的高纯度多巴胺能祖细胞(A9-DPC)疗法,系统性地回答了细胞治疗领域的三大核心问题:
- 安全性方面:研究证实无严重细胞相关不良反应;
- 有效性方面:91.7%的患者在停药状态下运动功能改善,且高剂量组表现出更显著的临床获益,并有影像学证据支持其作用机制;
- 可行性方面:通过GMP条件下的标准化生产体系,成功实现了临床级细胞产品的稳定供应。
疗效数据显示,A9-DPC移植为患者带来了具有临床意义的改善。除运动功能评分(MDS-UPDRS III)和疾病分期(H&Y)的显著改善外,患者每日”关期”时间减少,生活质量、非运动症状及日常生活能力评分也均获提高。这些发现为细胞疗法的治疗价值提供了有力支持。
基于这些积极成果,研究团队下一步将开展双盲、安慰剂对照的多中心试验,纳入更多患者并延长随访时间。若结果得以验证,该疗法有望为帕金森病患者带来长期症状缓解的新希望。
参考资料:
[1]:https://www.acnnewswire.com/press-release/japanese/101164/s.biomedics-cell-therapy-for-parkinson’s-disease-shows-positive-data-from-its-phase-1/2a-clinical-trial
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复