在生命科学的前沿领域里,“多能干细胞”常被称为“万能细胞”。它们能分化成身体内几乎所有类型的细胞,被视为再生医学中最具潜力的希望。从受损组织修复到复杂疾病治疗,多能干细胞的应用正从实验室逐步走向临床。那么,这些“万能细胞”到底有几种类型?它们之间又有什么不同?下面,我们一起来了解。
多能干细胞有哪些类型?详解3种多能干细胞的主要类型的区别与应用
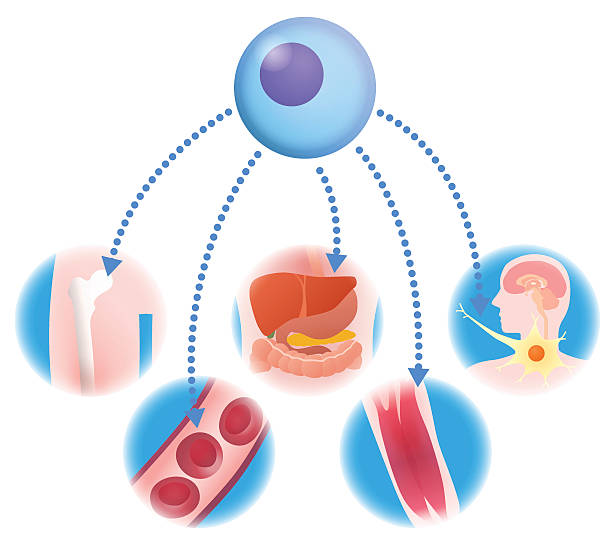
一、多能干细胞的基本概念
“多能”这个词的意思,是指细胞具备分化为多种类型组织的能力。与成体干细胞相比,多能干细胞就像“通才”,它们能在合适条件下生成神经细胞、心肌细胞、肝细胞、胰岛细胞等多种功能性细胞。
这种特性使它们成为再生医学的核心工具,被广泛研究用于组织修复、疾病模型构建及细胞替代治疗。
目前,多能干细胞主要包括三种类型:胚胎干细胞(ESCs)、诱导多能干细胞(iPSCs)以及一种较新的类型Muse细胞。
二、多能干细胞有哪些类型?3大类型详解
1. 胚胎干细胞(ESCs)
胚胎干细胞是最早被发现的多能干细胞,来源于受精后约5–7天的早期胚胎(囊胚阶段)的内细胞团。它们拥有最完整的分化潜能,几乎可以生成身体内的任何细胞类型,因此被视为再生医学研究的“金标准”。
在科研中,ESCs被广泛用于研究早期胚胎发育、遗传疾病机理及细胞分化规律。临床试验也在探索其在脊髓损伤、糖尿病、黄斑变性、帕金森病等疾病中的应用。
但由于获取ESCs需要破坏早期胚胎,伦理问题成为限制其临床推广的最大障碍。
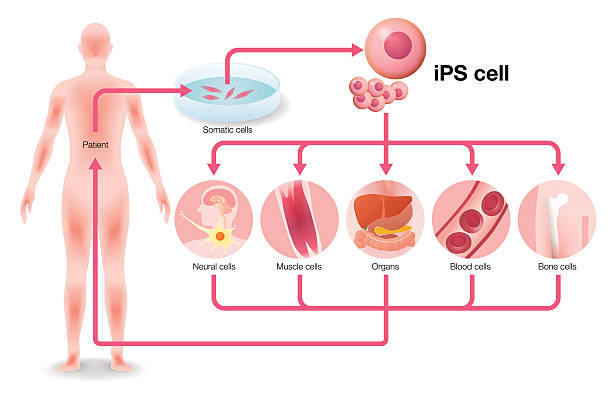
2.诱导多能干细胞(iPSCs)
诱导多能干细胞的出现堪称生命科学史上的一次革命。2006年,日本科学家山中伸弥通过将特定的“山中因子”(Oct4、Sox2、Klf4、c-Myc)导入成体细胞,使其“逆转生长”,恢复为具有胚胎干细胞特性的多能状态。
这种方法不再需要使用胚胎,从而规避了伦理争议。更重要的是,iPS细胞可以用患者自身细胞制备,再分化成所需的细胞类型进行移植,理论上能够避免免疫排斥,实现真正的“个性化再生治疗”。
目前,iPSCs被广泛用于心脏病、视网膜疾病、帕金森病等研究中,也成为药物筛选和疾病建模的重要平台。
不过,这项技术也面临一些挑战,如早期使用病毒载体带来的基因突变风险,以及部分细胞重编程不完全导致分化能力不足。随着非整合载体和化学重编程技术的发展,这些问题正在逐步改善。
3.Muse细胞
近年来,科学家发现一种天然存在于成人组织(如骨髓、脂肪、皮肤真皮)中的多能干细胞——Muse细胞(Multilineage-differentiating Stress-Enduring Cells)。
与前两种不同,Muse细胞无需基因改造,也不会形成肿瘤,被认为是更“安全”的多能干细胞类型。它们还能在进入体内后自动“归巢”到受损组织,自主参与修复。研究显示,Muse细胞在动物模型中可改善中风、心梗、肝损伤和皮肤创面愈合等多种疾病。
不过,Muse细胞在体内含量极低,分离纯化过程复杂,目前仍处于临床研究的早期阶段,但前景十分可期。
三、3者的区别:同为“多能”,路径不同
虽然三者都属于多能干细胞,但它们的来源和特性截然不同。可以简单理解为:
-
胚胎干细胞代表自然的起点;
-
诱导多能干细胞象征科技的力量;
-
Muse细胞则是人体自带的修复储备。
为了更直观地展示这三类细胞的核心差异,请见下表:
| 对比维度 | 胚胎干细胞 | 诱导多能干细胞 | Muse细胞 |
|---|---|---|---|
| 来源 | 早期胚胎 | 重编程的体细胞 | 成体组织(如骨髓、脂肪) |
| 伦理争议 | 高 | 极低 | 无 |
| 免疫排斥风险 | 高(异体移植) | 低(可用自体细胞) | 低(可用自体细胞) |
| 致瘤性风险 | 高 | 高 | 极低 |
| 技术成熟度 | 高,是“金标准” | 非常高,发展迅速 | 较新,处于上升期 |
| 主要应用 | 基础研究、作为分化参考标准 | 疾病建模、药物筛选、个性化细胞治疗 | 组织修复再生(如心梗、中风、皮肤溃疡) |
| 关键优势 | 分化潜能最完整 | 规避伦理、可个性化定制 | 安全性高、天然归巢 |
四、三者的应用前景:从实验室走向临床
随着技术的不断完善,多能干细胞正逐渐突破实验室边界。胚胎干细胞的研究成果为其他类型提供了标准和参照;iPS细胞则推动了“个体化再生医学”的实现;Muse细胞的发现,则让“即取即用”的安全干细胞治疗成为可能。
在未来,多能干细胞有望在神经修复、心血管疾病、肝脏损伤、糖尿病以及组织再生等多个方向发挥作用,真正为难治性疾病提供新的解决思路。
结语
无论是来自胚胎的“自然馈赠”,还是来自实验室的“技术奇迹”,多能干细胞都在重塑医学的未来。它们不仅拓宽了我们对生命本质的理解,也让“自我修复”这一看似遥远的概念逐渐变成现实。
可以预见,在未来的再生医学时代,多能干细胞将继续扮演关键角色,为人类健康带来新的希望。
参考资料:
[1]Alanazi, R.F.; Alhwity, B.S.; Almahlawi, R.M.; Alatawi, B.D.; Albalawi, S.A.; Albalawi, R.A.; Albalawi, A.A.; Abdel-Maksoud, M.S.; Elsherbiny, N. Multilineage Differentiating Stress Enduring (Muse) Cells: A New Era of Stem Cell-Based Therapy. Cells 2023, 12, 1676. https://doi.org/10.3390/cells12131676
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。

发表回复