在多能干细胞领域,诱导多能干细胞(iPSC)与胚胎干细胞(ESC)构成了两条截然不同的技术路线。自2006年山中伸弥团队首次实现体细胞重编程以来,这两种细胞类型在科研与临床应用中既相互竞争又相辅相成。
虽然iPSC和ESC都具备分化成人体约200种细胞类型的能力,但它们在来源、伦理属性、生物学特性及临床潜力上存在显著差异。本文将详细介绍两者的起源、主要特点、应用现状及各自优势与局限,帮助你全面理解多能干细胞的研究与临床价值。
诱导多能干细胞和胚胎干细胞有什么区别?从来源、伦理到临床应用的全面对比
一、诱导多能干细胞和胚胎干细胞有什么区别?一表看懂两大“万能细胞”
|
|
|
|
|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 主要优势 | 来源广、无伦理争议、可个体化定制。 | 最“天然”的多能状态,分化潜能强大且稳定。 |
|
|
|
|
|
|
|
|
二、来源与伦理:最根本的差异
2.1胚胎干细胞——自然的馈赠
它的来源是受精后约5-7天形成的早期胚胎(囊胚)。科学家从囊胚的内细胞团中分离获取ESCs,而这个过程会破坏胚胎本身。
这导致了其核心的伦理困境:一个早期胚胎是否算作一个生命?为了获取干细胞而破坏胚胎在伦理上是否正当?这一争议曾在全球范围内引发巨大的科学与宗教、伦理的辩论,并在一定程度上限制了其研究 funding 和范围。
2.2诱导多能干细胞——技术的奇迹
它的诞生是一场革命。2006年,日本科学家山中伸弥团队发现,通过向成熟的体细胞(如皮肤成纤维细胞)中导入4个特定的转录因子(Oct3/4, Sox2, Klf4, c-Myc,即“山中因子”),可以将其 “逆转” 回类似胚胎干细胞的多能状态。
这一发现完美地绕开了伦理陷阱。因为它使用的是人体内已分化的普通细胞,不涉及胚胎破坏,为干细胞研究开辟了一条全新的道路。山中伸弥也因此荣获了2012年诺贝尔生理学或医学奖。
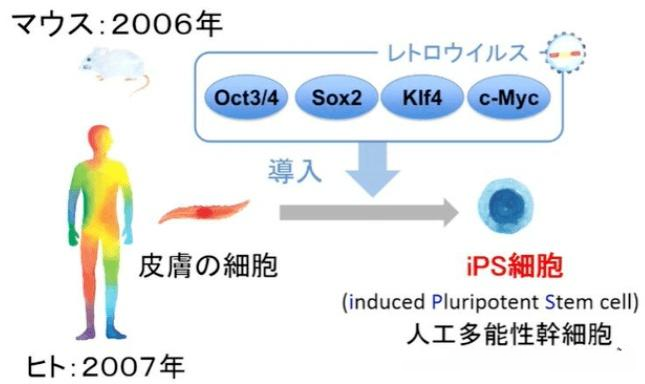
诱导多能干细胞的研究流程
三、技术、安全性与临床应用:各有各的赛道
3.1 技术发展与安全性
胚胎干细胞(ESCs):作为“前辈”,ESC的培养和定向分化技术已经相对成熟,也常被用作衡量其他干细胞的标准。然而,其致瘤性依然是最大的安全隐患——如果移植组织中残留未分化的ESC,可能在体内形成畸胎瘤。
诱导多能干细胞(iPSCs):安全性一直是关注的焦点。早期方法通常使用病毒载体导入基因,可能导致外源基因随机整合,引发突变,增加致癌风险。但随着新一代非整合技术(如仙台病毒、RNA或化学小分子)的发展,这类风险已大幅降低,为临床应用提供了更可靠的保障。
3.2 免疫排斥问题
胚胎干细胞:由于有些来源于他人(异体),其表面HLA与受体不匹配,移植后往往需要长期使用免疫抑制剂,这可能带来感染等副作用。
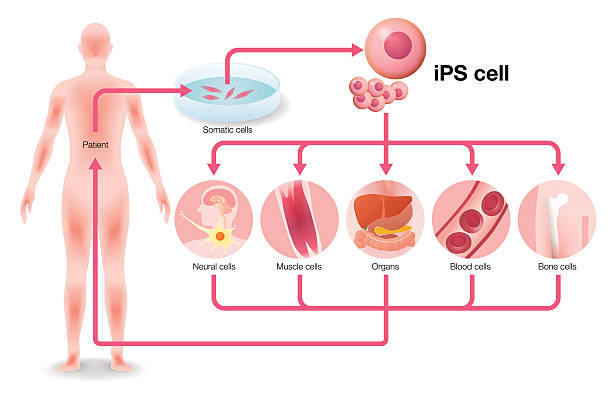
诱导多能干细胞:最大优势在于可构建“患者特异性iPSC库”。用患者自身细胞制备的iPSC,再分化为所需细胞进行移植,理论上可以完全避免免疫排斥,这也是其临床应用最吸引人的地方。
3.3 应用场景的侧重
胚胎干细胞:由于其最原始、最天然的多能性,它在基础科学研究中不可替代,尤其适合探索人类早期胚胎发育和基因功能。
诱导多能干细胞:在转化医学和临床应用方面优势更明显。
-
疾病建模:科学家可以从罹患罕见病的患者取皮肤细胞,重编程成iPSC,再分化为病变细胞(如神经细胞),在培养皿中创建“疾病模型”,用于药物筛选和机制研究。
-
个性化细胞治疗:这几乎是再生医学的终极目标。iPSC可以为每位患者量身定制所需细胞,例如为帕金森病患者提供多巴胺能神经元,为心衰患者提供心肌细胞,实现精准治疗。
四、面临的挑战与未来方向
尽管前景广阔,但两者都仍需克服重大挑战才能实现广泛的临床应用。
诱导多能干细胞的挑战:当前最大的瓶颈依然是安全性、免疫原性和异质性。必须开发出更安全的重编程技术,并建立严格的质量控制体系。此外,iPSCs的制备成本高、周期长,也是实现个性化治疗需要考虑的问题。
胚胎干细胞的挑战:除了伦理枷锁,其临床应用同样面临致瘤性和免疫排斥的安全担忧。同时,各国对ES细胞研究的严格监管也限制了其发展速度。
未来,科学研究可能会集中于开发无遗传修饰的重编程方法、建立iPS细胞库来部分解决免疫配型问题,以及利用基因编辑技术(如CRISPR)在iPS细胞阶段直接纠正遗传病基因突变。对ES细胞的研究也将继续深化我们对发育和细胞分化的理解。
总结:不是替代,而是协同进化
纵观干细胞领域的发展,ESCs和iPSCs的关系并非简单的“后者取代前者”,而更像是相辅相成、协同进化的伙伴。
-
胚胎干细胞 是基准和蓝图,为我们理解“多能性”提供了最根本的参照。
-
诱导多能干细胞 是创新与解决方案,以其独特的灵活性,将干细胞技术推向了个性化医疗的新纪元。
展望未来,我们可能会看到这样的图景:研究人员继续利用ESCs进行最基础的生命机理探索;而临床医生则更多地使用iPSCs来开发个体化的疗法,甚至建立大型的“超级供体”iPSC细胞库,以覆盖大多数人群的HLA类型,实现“现货型”细胞治疗。
科学的进步正是在这种互补与迭代中不断前行,而这两大“万能细胞”,无疑将继续引领再生医学走向更加光明的未来。
免责说明:本文仅用于传播科普知识,分享行业观点,不构成任何临床诊断建议!杭吉干细胞所发布的信息不能替代医生或药剂师的专业建议。如有版权等疑问,请随时联系我。
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。


发表回复