帕金森病(Parkinson’s Disease,PD)是一种常见的神经退行性疾病,在全球约有超过1000万人受到它的影响。它不仅仅是“手抖”的疾病,更是一场悄然发生在大脑深处的“多巴胺危机” [1]。
那么,帕金森病的发病机制究竟是什么?为什么会导致身体僵硬、动作迟缓甚至认知障碍?今天,我们用通俗易懂的方式,带你深入了解这一疾病的本质。
一、帕金森病:从“手抖”开始的大脑危机
帕金森病是一种进行性发展的中枢神经系统疾病,多发于中老年人。其典型症状包括:
-
静止性震颤(手抖)
-
动作迟缓
-
肌肉僵硬
-
平衡障碍
这背后的根本原因,是大脑中一个名为“黑质”的区域出了问题。
可以这样理解:健康人脑中的“黑质—纹状体通路”就像一条神经信号的“高速公路”,负责协调身体的运动。当黑质里的多巴胺能神经元受损后,这条“高速路”开始堵塞,信号传递不畅,身体动作也随之变得迟缓和僵硬。
二、核心病理改变:多巴胺能神经元损伤
帕金森病最核心的病理变化是:黑质致密部(SNc)的多巴胺能神经元逐渐变性和死亡,导致多巴胺水平显着下降。
多巴胺是一种非常重要的神经递质,它相当于“发动机的润滑油”,帮助我们的身体完成流畅的运动。当多巴胺不足时,运动系统出现障碍,就表现为手抖、僵硬、行动迟缓等典型症状。
此外,在病理切片中还常常可以看到被称为“路易小体(Lewy bodies) ”的结构,这是神经细胞内一种异常蛋白聚集的标志,也是帕金森病的重要病理特征之一。
帕金森病的发病机制
PD的病因和发病机制涉及α-突触核蛋白(α-syn) 的异常聚集、线粒体功能障碍、氧化应激和神经炎症(图1 )。
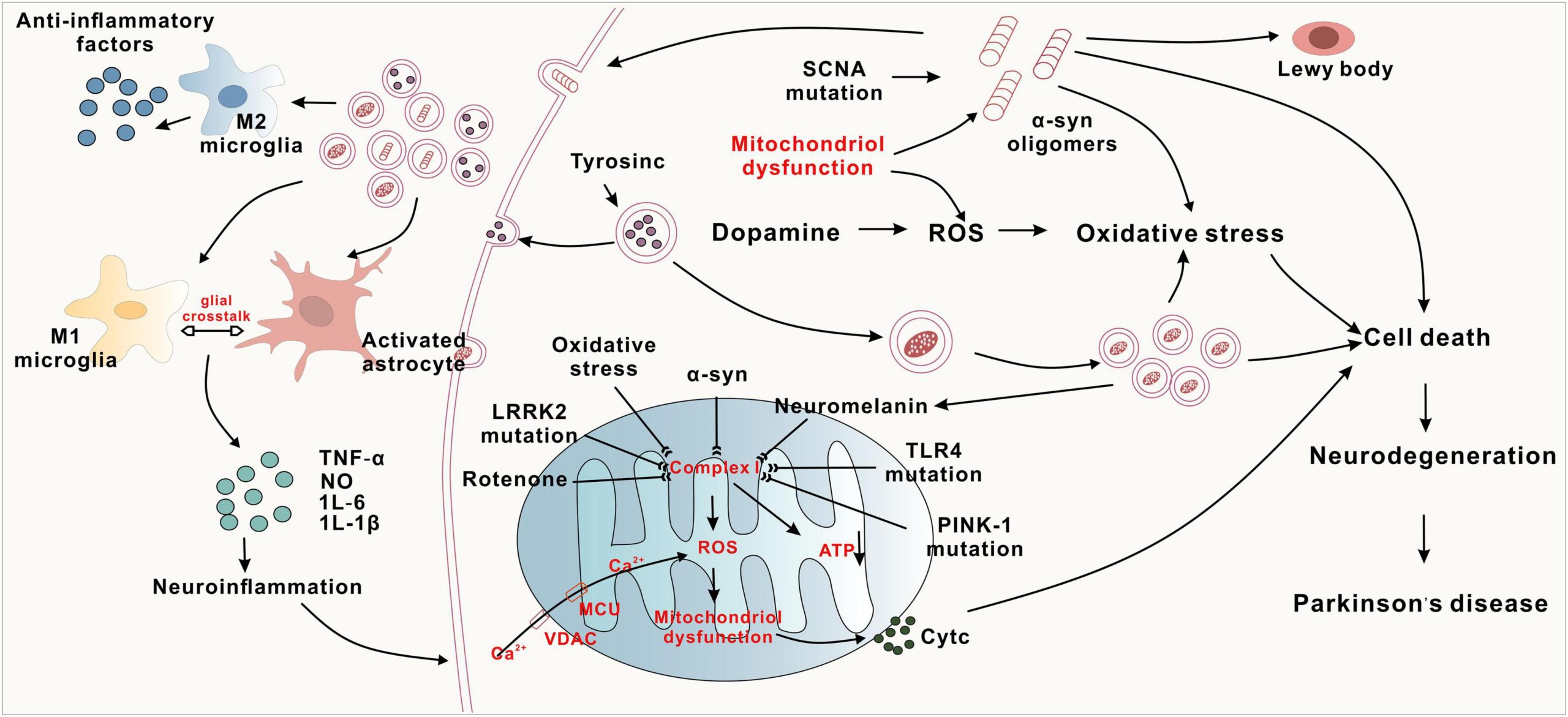
1.始动环节:帕金森病的发病机制之一α-突触核蛋白异常聚集
首先,α-突触核蛋白的异常聚集是帕金森病最核心的病理标志,它直接构成了神经毒性的基础。在环境毒素、感染等因素触发下,原本正常的α-突触核蛋白发生错误折叠,从可溶性单体转变为不溶性的有毒寡聚体并进一步聚集成纤维,最终成为路易体的主要成分。这些异常聚集的蛋白对神经元具有直接毒性,实验证明,人为促进其聚集会导致运动功能障碍和多巴胺能神经元的丢失,从而引发帕金森病。
其次,细胞清除机制的失效是导致α-突触核蛋白堆积的关键环节。一方面,神经元自身的蛋白降解系统功能不良;另一方面,负责“大脑清洁”的神经胶质细胞功能也严重受损。研究表明,小胶质细胞中的氧化应激传感器DJ-1功能受损会引发炎症反应并削弱其清除能力,而星形胶质细胞虽然能捕获α-突触核蛋白,但若其降解能力长期落后于捕获能力,反而会成为蛋白蓄积的“帮凶”,共同加剧多巴胺能神经元的退化。
最后,异常聚集的α-突触核蛋白表现出类似朊病毒的传播特性,这使得病理变化能在脑内不断扩散。错误折叠的蛋白聚集体可以从病变神经元中释放,在LAG3等特定受体的介导下,被相邻的健康神经元吸收。进入新细胞后,它们会作为“模板”诱导正常的α-突触核蛋白发生同样的错误折叠,从而实现跨突触传播,将病理影响从中脑黑质逐步扩散到其他脑区。这一恶性循环不仅直接导致神经元死亡,还会引发氧化应激、线粒体功能障碍等下游事件,共同推动帕金森病的发生与进展。
然而,蛋白质的堆积并非孤立事件,它与细胞内部的“清洁系统”失效密切相关。其中,蛋白质降解系统失调(包括泛素-蛋白酶体系统和自噬-溶酶体途径的功能障碍)是导致α-突触核蛋白等毒性蛋白无法被有效清除的根本原因之一。与此同时,这些异常蛋白的积累,不仅直接毒害神经元,更向周围的免疫细胞发出了“危险信号”,从而点燃了神经炎症的熊熊烈火。
2. 加速器:神经炎症的恶性循环
首先,神经炎症是帕金森病的一个核心致病因素,主要由大脑中的免疫细胞——小胶质细胞和星形胶质细胞的过度活化所驱动。当这些细胞被异常激活后,会释放大量的促炎细胞因子,如IL-1β、IL-6和TNF-α。研究表明,像胶质细胞成熟因子(GMF)这样的促炎蛋白的过度表达,会加剧这一过程;反之,抑制其表达则能减轻炎症、保护神经元并改善运动功能,这直接证明了小胶质细胞介导的炎症对多巴胺能神经元具有直接的毒性作用。
其次,神经炎症与帕金森病的其他核心病理过程,特别是α-突触核蛋白的异常聚集,形成了恶性循环。一方面,α-突触核蛋白的聚集可以激活小胶质细胞,引发炎症反应;另一方面,持续存在的炎症环境又会进一步促进α-突触核蛋白的错误折叠和聚集,并损害神经元的功能。这种互为因果的关系极大地加剧了多巴胺能神经元的退化,加速了疾病的进展。
最后,帕金森病中的神经炎症并不仅限于大脑内部,还涉及外周免疫系统的参与。在患者和动物模型中,可以发现被激活的外周免疫细胞浸润到黑质和纹状体等关键脑区。这表明,帕金森病的炎症反应是一个涉及中枢与外周免疫系统的全局性过程。尽管其具体机制尚未完全阐明,但所有证据都明确指出,靶向调控胶质细胞介导的神经炎症,有望成为未来帕金森病治疗的新策略。
持续的神经炎症会大量产生活性氧(ROS)等自由基,使神经元陷入氧化应激的泥潭。而氧化应激的环境,反过来又进一步加剧了蛋白质的错误折叠和线粒体的损伤。
3. 能量危机与毒性环境:线粒体功能障碍与氧化应激
氧化应激
首先,氧化应激是帕金森病发病的一个核心驱动因素,其本质是活性氧(ROS)的过量产生与细胞清除能力之间的失衡。在生理状态下,ROS参与正常的细胞信号转导,但在帕金森病患者黑质纹状体区域,ROS的过度积聚会导致多巴胺能神经元的能量代谢失衡,使其能量需求远超供应,最终直接引起神经元损伤、凋亡,并诱发α-突触核蛋白的异常聚集。
其次,氧化应激并非一个孤立的事件,它与帕金森病的其他关键致病机制形成了紧密的恶性循环。过量的ROS会损害线粒体功能,削弱其自噬能力,从而进一步加剧ROS的生成。同时,氧化应激还能激活小胶质细胞,促使其释放大量炎症因子,从而引发并放大神经炎症反应,共同构成一个推动神经元退行的destructive 网络。
最后,机体内源的抗氧化防御系统,如转录因子Nrf2,是抵抗氧化应激的关键。 Nrf2通路能够上调抗氧化酶和基因的表达,增强神经元对ROS的抵抗力。研究也表明,像Toll样受体4(TLR4)这样的信号分子通过调控氧化还原敏感的AP-1转录因子,在ROS反应中扮演重要角色,敲除TLR4被证实可减轻氧化损伤并改善运动症状。这些证据不仅证实了氧化应激的核心地位,也提示针对这些通路(如激活Nrf2)可能成为潜在的治疗策略。
线粒体功能障碍
首先,线粒体功能障碍是帕金森病中导致多巴胺能神经元死亡的核心环节。功能受损的线粒体会造成细胞能量货币ATP的合成急剧减少,同时产生过量的自由基,破坏细胞内的钙离子稳态。这种能量危机与毒性环境使得高能耗、高代谢需求的多巴胺能神经元尤其脆弱,最终因无法维持正常功能而走向退行性病变。
其次,与帕金森病相关的多个致病基因,其功能直接指向了线粒体质量控制的失灵,特别是“线粒体自噬”这一关键过程。例如,PINK1和PRKN基因的突变会破坏其介导的清理受损线粒体的通路,导致功能异常的线粒体在细胞内堆积,并释放mtDNA等物质,进而触发有害的神经炎症反应,形成恶性循环,加速神经元死亡。
最后,线粒体功能障碍的影响还延伸至其动态分布与生物合成。研究发现,LRRK2基因的突变会干扰线粒体在神经元长轴突中的正常运输,使其无法到达需要能量的部位;而调控线粒体新生的关键因子PGC-1α的下调,则削弱了细胞替换和修复线粒体网络的能力。这些机制共同表明,线粒体系统的全面失调是推动帕金森病神经退行性变的一个根本性原因。
综上所述,帕金森病的发病机制是一个由多条通路构成的恶性循环网络(如图1所示)。线粒体功能障碍和蛋白质降解系统失调是两大上游始动因素,它们导致氧化应激和α-突触核蛋白的异常聚集。而异常聚集的α-突触核蛋白一方面直接损伤神经元,另一方面激活神经炎症;神经炎症和氧化应激又反过来进一步加重线粒体损伤和蛋白质聚集。这个自我强化的破坏性循环,最终导致黑质多巴胺能神经元无可挽回的死亡。
4. 遗传与环境因素的交互
- 一些家族性帕金森病患者存在基因突变(如SNCA、LRRK2)。
- 农药接触、重金属暴露、脑外伤等环境因素也可能提高患病风险。
遗传和环境就像“双刃剑”,共同推动疾病发生。
帕金森病的发病机制告诉我们什么?
理解帕金森病的发病机制,不仅是为了揭示疾病本质,更是寻找治疗突破口的关键。
-
针对α-突触核蛋白的免疫治疗正在研发中
-
线粒体保护剂和抗氧化疗法成为热门方向
-
干细胞移植与基因治疗也被视为未来可能改变病程的创新手段
虽然帕金森病尚无根治方法,但随着机制研究的深入,我们正在逐步“破解”这一疾病的密码。
总结
帕金森病(PD)的机制研究虽取得了长足进展,但其复杂性也提示:任何单一靶点的治疗策略可能都难以遏制疾病。正如我们所见,α-突触核蛋白聚集、基因突变、氧化应激和神经炎症共同抑制了线粒体复合物I的功能,导致能量危机与细胞死亡;而多巴胺代谢异常与小胶质细胞的激活则进一步加剧了这一过程。因此,未来的帕金森病治疗药物研发必须超越传统思路,更加注重多途径、多靶点的联合干预,例如开发能够同时抑制α-突触核蛋白聚集、缓解氧化应激并保护线粒体功能的化合物。
基于上述发病机制的深入理解,下一篇文章我们将系统盘点帕金森病的现有与新兴治疗方法。从经典的左旋多巴替代疗法,到针对这些复杂机制的多靶点治疗策略(如α-突触核蛋白清除剂、线粒体保护剂、抗炎疗法等),乃至深部脑刺激(DBS)等外科干预手段,探索我们如何在这场与疾病的多线作战中,为患者赢得更好的生活。
参考资料:[1]:https://www.frontiersin.org/journals/neuroscience/articles/10.3389/fnins.2024.1210447/full
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复