
脐带干细胞新药获药监默许开展中-重度变应性鼻炎人体临床研究
近日,一款脐带干细胞新药研发迎来关键进展。根据国家药监局药品审评中心(CDE)“信息公开—临床试验默示许可”栏目公示,人脐带间充质干细胞(UC-MSC)注射液(受理号:CXSL2500627) 已获默示许可,拟用于中-重度变应性鼻炎的临床研究。这标志着该脐带干细胞新药在完成后续伦理审查、临床登记等程序后,可正式按方案进入人体临床试验阶段。
对干细胞领域而言,这预示着该疗法正从重症免疫疾病向高患病率的过敏性疾病延伸,显示出赛道的新一轮扩容趋势——从“对症控制”走向“免疫再平衡”。

当前治疗体系成熟,但仍存提升空间
中-重度变应性鼻炎患者目前主要依赖鼻用糖皮质激素(INCS)作为基础治疗,必要时联合鼻喷抗组胺药或复方喷雾。特异性免疫治疗(如舌下/皮下脱敏)虽能带来停药后的持续效果,但在临床实践中仍面临症状反复、患者依从性波动、合并哮喘或其他Ⅱ型炎症表型等挑战,部分人群的症状控制水平与生活质量仍有待进一步提高。
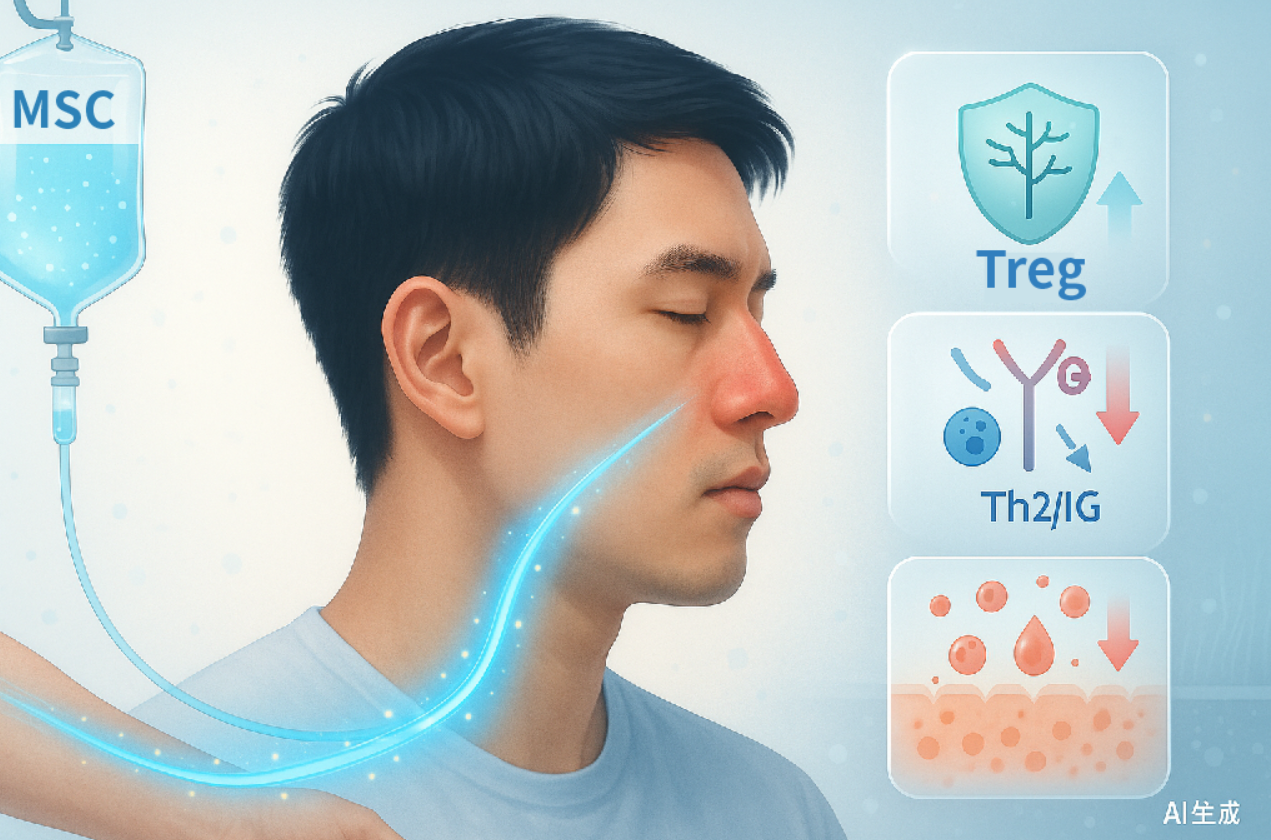
MSC的介入路径:从免疫调节切入鼻腔修复
脐带间充质干细胞以其免疫调节与炎症微环境修复能力见长。在动物模型及早期临床探索中,MSC显示出上调调节性T细胞(Treg)、抑制Th2反应与IgE水平、降低嗜酸性粒细胞浸润、改善鼻腔黏膜屏障功能等潜力。这一路径不再局限于“症状对抗”,而是尝试从根本上重塑免疫平衡,为传统药物难以充分覆盖的“高炎症”亚群提供了新的治疗思路。
研究稳步推进,我国已具备领跑优势
在技术端,2023年我国已有三甲医院登记开展人脐带间充质干细胞治疗中-重度持续性变应性鼻炎的Ⅰ期临床研究(NCT05151133)。该研究设计为单次静脉输注,设置三档剂量组(0.5×10⁶、1.0×10⁶、2.0×10⁶ cells/kg,每组6例,共18例),主要终点为安全性评估,并探索症状缓解与生活质量改善情况。该试验是国际公开数据库中较早进入人体阶段的同类探索之一,显示我国在该方向已具备一定的临床领跑优势。

总结与展望
CXSL2500627获得“默示许可”,将脐带MSC正式推入高流行率的过敏性疾病赛道。方向已明,窗口已开;下一步的关键在于可重复的人体数据。若能在分层人群中稳定证实其可降低症状、减少药物依赖、提升生活质量,并与现有疗法形成有效互补,变应性鼻炎的临床管理“工具箱”有望得到实质性扩充。建议关注该领域的读者持续跟踪后续临床登记、患者招募信息及关键数据读出节点。
信息来源:国家药品监督管理局药品审评中心
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复