国家药监局药物临床试验登记与信息公示平台近日更新信息,一项关于“华通氏胶间充质干细胞注射液”治疗膝骨关节炎的Ⅰ期临床试验已完成登记,标志着国内在干细胞治疗膝骨关节炎这一再生医学热门赛道上再添新的探索力量。
干细胞治疗膝骨关节炎的试验设计:聚焦安全,探索剂量
据公开信息,本研究采用单中心、单臂、开放标签设计,由北京大学第三医院骨科团队牵头。计划招募18名40-75岁、经确诊为Kellgren-Lawrence Ⅱ–Ⅲ级的膝骨关节炎患者。
试验核心目的是评估该干细胞注射液关节腔内注射治疗骨关节炎的安全性与耐受性。研究将设置三个剂量递增组(1×10⁷、2.5×10⁷、5×10⁷ 个细胞/关节),所有受试者均接受单次注射,并完成为期48周的随访。研究团队将严密监测不良事件,同时借助WOMAC(骨关节炎指数)、VAS(疼痛视觉模拟评分)、SF-36(生活质量评分)及影像学检查(X线、MOAKS评分)等工具,同步收集其在缓解疼痛、改善关节功能与结构方面的初步疗效信号。当前,试验状态为“进行中(尚未招募)”。

行业背景:成熟赛道,规范前行
需要明确的是,干细胞治疗膝骨关节炎并非颠覆性新概念。此前,全球学界已针对骨髓、脂肪、脐带(含华通氏胶)等多种来源的间充质干细胞开展了大量研究,众多项目已推进至Ⅱ期甚至Ⅲ期临床阶段,整体安全 profile 良好,并在缓解疼痛、改善功能方面展现出持续积极的潜力。

在国内,部分成熟的干细胞技术已获准在指定医疗机构进行规范化应用与数据收集。例如,“脐带间充质干细胞注射治疗膝骨关节炎”在部分机构的收费约为3.6万元/次。政策层面,无论是《膝骨关节炎诊疗指南(2024版)》还是相关的干细胞临床应用指导原则,均已将干细胞注射纳入规范路径,为其研究与转化明确了方向。
因此,本次Ⅰ期试验的更重要意义在于:它是在国家严密监管体系下,于一个技术理念相对成熟的赛道中,为“华通氏胶”这一特定细胞来源增加了新的、标准化的制备方案,旨在进一步积累属于中国监管体系认可的本土临床数据。
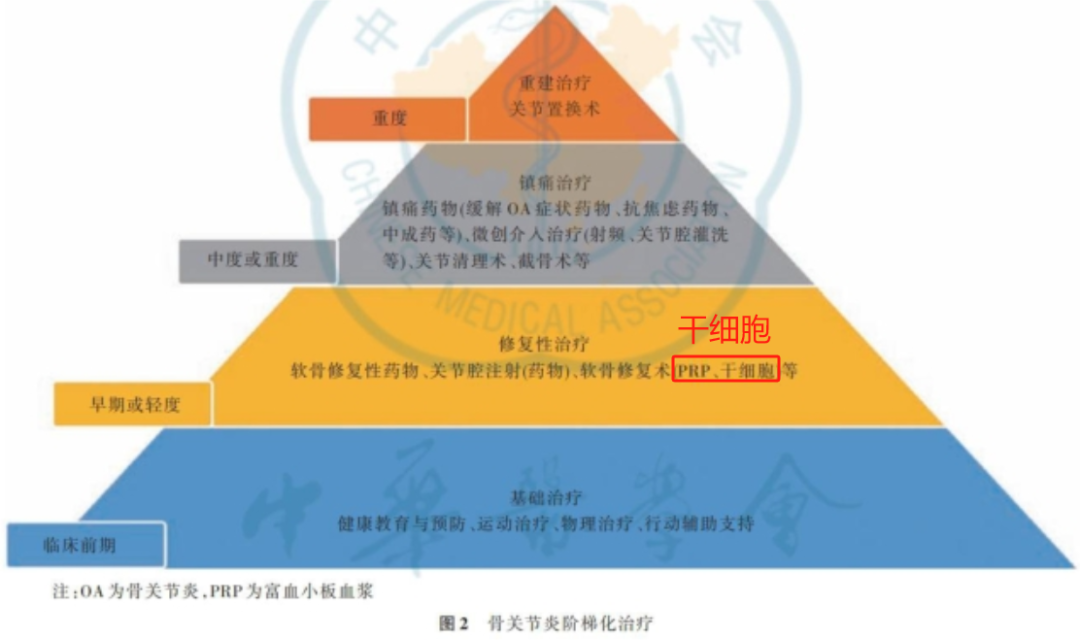
对于关注此领域的患者与行业人士而言,可以将其通俗地理解为:这并非从0到1的突破,而是“在一条已被验证的车道上,又一位符合国家标准的新选手正式上路”。
信息来源:国家药品监督管理局药品审评中心
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。



发表回复